CD74与RUNX3 在人胰腺癌细胞内存在相互作用
黄耀星,余丹纯,孙小娟,江舒曼,李伟冬,贾 林
广州市第一人民医院消化内科,广东 广州 510180
胰腺癌是恶性程度最高的消化系肿瘤,发病率占我国恶性肿瘤第8位,5年生存率仅为7.2%[1]。转移是胰腺癌患者死亡的主因[2],发现和验证与胰腺癌转移有关的基因及分子机制对胰腺癌的诊疗有着重要意义。CD74是II型跨膜糖蛋白,可在多种癌前病变和恶性肿瘤组织中表达[3]。有文献报道CD74与胰腺癌的预后及神经侵袭密切相关,CD74在具高神经侵袭转移特性胰腺癌细胞Capan-2中高表达,降低CD74表达水平可抑制细胞的体外侵袭力[4-6],而CD74在胰腺癌侵袭转移中的作用机制尚不清楚。Gil-Yarom等[7]在淋巴细胞研究中发现,CD74的胞内段可能与RUNX1和RUNX3结合,作为转录因子发挥作用。目前已有报道证实RUNX3是胰腺癌转移的分子开关[8],而胰腺癌细胞CD74内源化后能否激活类似淋巴细胞的下游信号通路目前尚无研究报道。
为在活体胰腺癌细胞内证实CD74与RUNX3之间的相互作用,本研究采用前期构建的CD74-siRNA慢病毒载体转染Capan-2细胞,利用免疫共沉淀技术验证CD74与RUNX3是否存在蛋白相互作用,为胰腺癌侵袭转移机制提供更多的实验证据。
1 材料与方法
1.1 实验材料
人胰腺癌Capan-2细胞株(北京北纳创联);慢病毒载体(Clonetech)、pSUPERretro-puro质粒(Oligoengine)、Lipofectamin 2000(Invitrogen);DH5α感受态细胞、293T细胞(广州博川生物);限制性内切酶(NEB);质粒提取试剂盒(北京天根生化);10%胎牛血清RPMI-1640培养基、DMEM培养基(Gibco);Trizol试剂盒、CD74、RUNX3引物(Invitrogen)、RT-PCR所需DNA聚合酶和Sybrgreen试剂(TaKaRa);鼠抗人CD74和RUNX3(Abcam),羊抗鼠二抗、β-actin(Santa Cruz);免疫共沉淀试剂盒Anti-HA Immunopreci-pitation Kit(IP 0010,Sigma);BCA-100蛋白质定量试剂盒(上海博彩生物);ECL化学发光试剂盒(北京普利莱)。
1.2 CD74-siRNA慢病毒载体构建
采用课题组前期研究筛选的CD74-siRNA最佳抑制序列和慢病毒载体,酶切鉴定正确后包装质粒,磷酸钙法转染293T细胞,收获并浓缩病毒上清液,-80 ℃冰箱保存备用[9]。
1.3 细胞培养和慢病毒感染
人胰腺癌Capan-2细胞在含10%胎牛血清、青链霉素的RPMI-1640培养基,37 ℃、5% CO2恒温箱中培养。取状态良好细胞接种于25 cm2培养皿,待融合度达80%~90%时,按照慢病毒转染说明操作。分为对照组(空白载体)和实验组(CD74-siRNA),每组按1:1000浓度加入4 μg/mL的聚凝胺,12 h后更换正常培养液,第2天重复进行,共感染4次;感染结束后加入0.5 μg/mL嘌呤霉素筛选阳性克隆3 d以上;每日更换培养液,观察并去除死细胞,细胞长满后冻存(P0代)并传代,收集P2代细胞评估转染效率。
1.4 实时荧光定量PCR
Trizol法提取两组细胞的总RNA,测定RNA纯度和浓度,逆转录合成cDNA,利用Primer 5.0软件设计引物,CD74、RUNX3、β-Actin等引物序列(表1)。扩增条件:95 ℃预变性30 s、95 ℃10 s、60 ℃10 s、72 ℃10 s,40个循环;72 ℃延伸10 min。读取Ct值,以 2-△△Ct值代表各组mRNA相对表达量。

表1 引物的序列
1.5 Western blot检测
两组细胞在冰上操作,RIPA裂解并提取总蛋白,BCA法测定蛋白浓度。将蛋白分为2份,一份用于Western blot,另一份用于免疫共沉淀。以总蛋白20 μg进 行 10%SDS-PAGE电 泳 , 电 转 膜 至 PVDF,5%脱脂奶粉封闭1 h,加入1:1000稀释的鼠抗人CD74、RUNX3一抗,4 ℃孵育过夜。TBST洗涤后加入羊抗鼠二抗,室温孵育1 h,ECL发光法显影拍照,β-actin为内参。Image J软件分析计算CD74、RUNX3和β-actin蛋白相对表达量。
1.6 正反向免疫共沉淀实验
按照免疫共沉淀试剂盒说明书操作。Capan-2细胞经RIPA裂解提取蛋白后,分为正向和反向免疫共沉淀组,各取裂解液分别加入1 μg的CD74抗体和RUNX3抗体,4 ℃缓慢摇晃孵育过夜;将用缓冲液预处理过的10 μL HA琼脂糖beads加入和抗体孵育过夜的细胞裂解液中,4 ℃缓慢摇晃孵育2~4 h,使抗体与HA琼脂糖beads偶连;免疫沉淀反应后,在4 ℃条件下以12 000 r/min速度离心30 s,将琼脂糖beads离心至管底;小心吸去上清,琼脂糖beads用1 mL裂解缓冲液洗3~4次;最后加入15~20 μL的1×SDS上样缓冲液,100 ℃煮5 min。上述样品用10%的SDS-PAGE电泳,并进行Western blot分析(同实验1.5步骤)。
1.7 统计学方法
数据采用SPSS 19.0进行统计学处理。计量资料以均数±标准差表示,两组均数比较采用t检验,多个样本均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 siRNA慢病毒转染对细胞CD74蛋白和mRNA表达的影响
Western blot结果显示,实验组CD74蛋白相对表达量为0.09±0.01,对照组CD74蛋白相对表达量为2.78±0.04,实验组CD74蛋白表达量较对照组显著下降(P<0.05,图1);qRT-PCR结果显示,实验组与对照组CD74 mRNA的2-△△Ct值分别为0.39±0.001、1.00±0.00,CD74-siRNA慢病毒转染可抑制CD74 mRNA的表达(P<0.05,图2)。

图1 两组细胞CD74和RUNX3蛋白表达差异

图2 两组细胞CD74 mRNA表达差异
2.2 抑制CD74对细胞RUNX3蛋白和mRNA表达的影响
实验组与对照组的RUNX3相对蛋白表达量为0.006±0.0004、1.24±0.09(图1);qRT-PCR结果显示,实验组与对照组RUNX3 mRNA的2-△△Ct值分别为0.53±0.02、1.00±0.00;抑制CD74可降低Capan-2细胞RUNX3蛋白与mRNA的表达量(P<0.05,图3)。
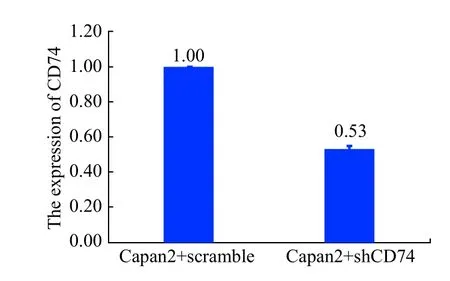
图3 两组细胞RUNX3 mRNA表达差异
2.3 免疫共沉淀法验证CD74与RUNX3 在细胞内相互作用
用CD74抗体与Capan-2细胞的总蛋白裂解液进行免疫共沉淀,免疫复合物经电泳转膜后,进一步用CD74抗体和RUNX3抗体进行Western blot分析。结果表明,Western blot能在免疫复合物中检测到RUNX3蛋白。
继而用RUNX3抗体与Capan-2细胞的总蛋白裂解液进行反向免疫共沉淀,免疫复合物经电泳转膜后,同样用CD74抗体和RUNX3抗体进行WB分析。结果表明,WB法能在免疫复合物中检测到CD74蛋白,Capan-2细胞株中CD74与RUNX3存在相互作用(图4)。
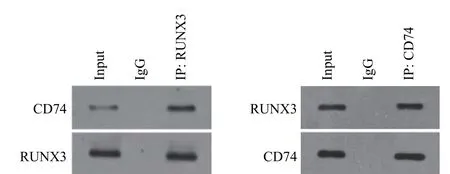
图4 免疫共沉淀结果
3 讨论
胰腺癌患者预后在过去十余年间未能得到显著改善,其诊断大多预示患者迅速痛苦的死亡发生,高侵袭转移倾向是该疾病的特征标志[10]。近年来,有关胰腺癌发生发展的遗传和基因变化的研究取得一些进展,希望能够在分子水平找到更好的诊治胰腺癌解决办法。目前已知CD74表达与多种恶性肿瘤进展和转移有关。在胰腺癌领域,Hustinx等[11]发现CD74在胰腺癌组织中高表达,Nagata等[12]认为CD74是胰腺癌的独立预后因子。前期研究表明,CD74不但在胰腺癌组织中高表达,而且与神经侵袭程度呈正相关;通过体外实验抑制细胞CD74的表达,可降低细胞增殖、迁移和侵袭等能力[5-6]。上述研究结果提示CD74可能作为胰腺癌治疗一个新靶点,而随着近年Immunomedics公司研制出以CD74为靶点的人源化Milatuzumab,并和阿霉素构成抗体偶联药物,使得临床抗CD74策略治疗血液系统恶性肿瘤成为可能[13-15]。
目前,CD74在胰腺癌中是否有着与血液肿瘤相似的作用通路和机制尚未完全阐明。有研究报道CD74可作为巨噬细胞迁移抑制因子的细胞表面受体,两者结合后诱导系列信号传导途径,包括CD74膜内段切割、细胞内结构域(CD74-ICD)释放等方式发挥作用[16-17]。有研究发现,B淋巴细胞胞内CD74-ICD可与转录因子RUNX(Runt相关转录因子)相互作用,CD74活化后RUNX3水平可显着上调,共同形成蛋白复合物,但复合物的确切功能尚不清楚,提示CD74可能作为一种新转录因子在肿瘤细胞中发挥作用[5]。RUNX3基因是近年来发现的新抑癌基因,Whittle等[8]发现RUNX3是调节胰腺癌转移的分子开关,高水平的RUNX3意味着高转移潜能,如果RUNX3低水平,转移风险则相对较低,有助于帮助胰腺癌临床治疗策略的选择[18-19];Rossi等[20]对动物模型的研究也发现RUNX3能够促进PDAC转移。
综上所述,本研究推测CD74在胰腺癌细胞中可能存在相似的作用机制,调节RUNX3通路进而影响侵袭和转移,但国内外尚未见在胰腺癌研究中有相关报道。为此,本实验在前期构建CD74-siRNA慢病毒载体基础上,转染人胰腺癌Capan-2细胞抑制CD74表达,观察CD74水平与RUNX3表达之间的关系;运用免疫共沉淀技术进一步确定两种蛋白质在完整细胞内生理性相互作用[21]。研究结果表明,与对照组相比,抑制Capan-2细胞CD74基因表达可显著降低RUNX3蛋白和mRNA表达量,正向和反向免疫共沉淀法均证实CD74与RUNX3在Capan-2细胞内可形成复合物,RUNX3参与调控CD74激活后人胰腺癌Capan-2细胞的生物学行为,为临床靶向CD74治疗胰腺癌提供了实验室证据。
但CD74和RUNX3蛋白之间是紧密结合还是短暂相互作用,复合物如何调控胰腺癌细胞其他基因表达及其具体机制,尚需在后续实验中加以完善。

