抗中性粒细胞胞质抗体相关性血管炎肾脏损害与血清C3的关系
苏丽雅·艾山江 叶力夏提·阿德力别克 桑晓红 米娜娃尔·玉努斯 李 静
抗中性粒细胞胞质抗体(ANCA)相关性血管炎(AAV)是累及全身小血管导致多脏器损伤的自身免疫性疾病,其肾损伤主要的临床表现为血尿、蛋白尿、水钠潴留(高血压)和肾功能损害等,疾病进展迅速,短时间内可致不可逆性肾功能衰竭,预后极差。AAV的发病机制至今尚未完全明确,可能与遗传、感染、环境因素、细胞免疫等有关。近几年,补体在AAV中的发病作用成为最新研究热点,已有研究证实,血清补体C3的降低与AAV的预后不佳相关[1-2]。本研究回顾性分析AAV患者的临床特征及预后,探讨补体C3在AAV肾脏损害的发病、诊治及评估预后中的作用。
对象和方法
研究对象 2010年01月~2018年01月于新疆医科大学第一附属医院确诊为AAV初治患者共304例,其中临床资料完整的200例患者纳入本研究,均符合以下条件:(1)符合 Chapill Hill会议2012年公布的最新血管炎分类诊断及命名共识[3];(2)所有患者均行血清ANCA和补体C3检测,且ANCA阳性;(3)所有患者均有肾损害的表现,如血尿、蛋白尿、水钠潴留、血清肌酐(SCr)升高等;(4)在院病历完整,住院时间>24h的首诊及初治者。
排除标准:(1)继发性血管炎患者,如继发于感染、结缔组织病、药物、肿瘤等;(2)合并自身免疫性疾病的患者,如类风湿性关节炎、系统性红斑狼疮、干燥综合征等;(3)临床病历资料不完整的患者。
相关资料收集
一般资料 收集患者的年龄、性别、临床症状、治疗方案及随访资料。
实验室资料 首次就诊时的ANCA滴度及类型、SCr、24h尿蛋白定量、血清白蛋白、血红蛋白、白细胞计数(WBC)、血小板、补体水平、红细胞沉降率和C反应蛋白等,并估算肾小球滤过率(eGFR),评估伯明翰血管炎活动性评分(BVAS)[4]。
治疗方法 治疗方案包括常规治疗及强化治疗。(1)常规治疗:口服糖皮质激素(泼尼松/甲泼尼龙)+静脉注射环磷酰胺(CTX),口服泼尼松初始量按照0.6~1 mg/(kg·d)的标准,4~6周后逐渐减量,12周后减量至10 mg/d维持。CTX剂量为0.4 g/次 (根据WBC调整剂量),2次/月,使用6~8月达累积量后可改为吗替麦考酚酯(MMF)0.5 g/d,口服维持。(2)强化治疗:静脉滴注甲泼尼龙冲击+口服泼尼松+静脉滴注环磷酰胺,先予以静点甲泼尼龙0.5~1 g/d,3d为一个疗程,应按个体化方案使用1~3个疗程,之后口服泼尼松片[0.6~1 mg/(kg·d)+静脉滴注环磷酰胺治疗(0.4 g/次,2次/月)]。根据指南,以下患者使用血浆置换疗法:SCr迅速升高者或在起病时需要透析的重症急性肾衰竭患者;弥漫性肺泡出血者。
患者分组及相关定义 以我院检验科血清补体C3检测值的正常范围下限值为分界点,将200例患者分为低C3组(C3<0.79 g/L,n=85)、正常 C3组(C3≥0.79 g/L,n=115)。再将200例患者按结局发生与否分为终点事件组(n=75)与非终点事件组(n=125)。
通过电话随访,或因复查再入院时的资料视为随访资料,随访起点为患者就诊时间,随访终点为2018年01月31日或发生终点事件。
终点事件 定义为患者死亡或ESRD。ESRD定义为eGFR<15 ml/(min·1.73m2)或进入维持性透析(透析时间≥3个月)。
统计学方法 采用《SPSS 22.0》软件统计学分析,正态分布的计量资料比较采用两独立样本的t检验,总体分布以均数±标准差表示;偏态分布的计量资料比较采用Wilcoxon符号秩和检验,以中位数(四分位数间距)表示。计数资料采用Χ2检验,对两组进行率及构成比的比较。采用Kaplan-Meier法完成生存分析,对数秩检验来比较低C3组与正常C3组的生存率。以单因素分析中有意义的变量纳入多因素COX分析。P<0.05为差异有统计学意义。
结 果
一般资料 200例患者中男性82例、女性118例,平均年龄60岁,MPO阳性155例(77.5%),PR3阳性45例(22.5%)。75例患者发生终点事件。
不同C3水平的AAV患者的比较
临床特征 低 C3组 SCr、24h尿蛋白定量、BVAS评分均高于正常C3组(P<0.05);低C3组血红蛋白、血小板计数、eGFR、C4、C反应蛋白、红细胞沉降率均低于正常C3组(P<0.05);两组患者年龄、性别、ANCA类型及滴度、WBC、白蛋白水平均无显著差异(表1)。

表1 两组患者人口学及血清学特点的比较
系统受累情况 两组肾脏受累表现(蛋白尿、SCr升高)的比较有显著性(P<0.05);两组患者非特异性临床表现及其他系统受累发生率比较,差异均无统计学意义(表2)。
治疗方案 低C3组强化治疗、肾脏替代治疗及血浆置换疗法使用率高于正常C3组(P<0.05);两组单用激素、激素联合CTX治疗的比例无统计学差异(表3)。
预后 两组共75例发生终点事件,低C3组为45例,其中死亡13例(10例因肾功能衰竭导致多脏器功能衰竭死亡,3例因AAV侵犯肺部死亡);正常C3组为30例,其中死亡7例(肾衰竭患者2例,肺泡出血1例,肺部感染3例,主动脉夹层1例)。生存曲线显示,正常C3组患者累计肾脏存活率显著高于低 C3组(Log-rank=14.131,P<0.001)(图 1)。
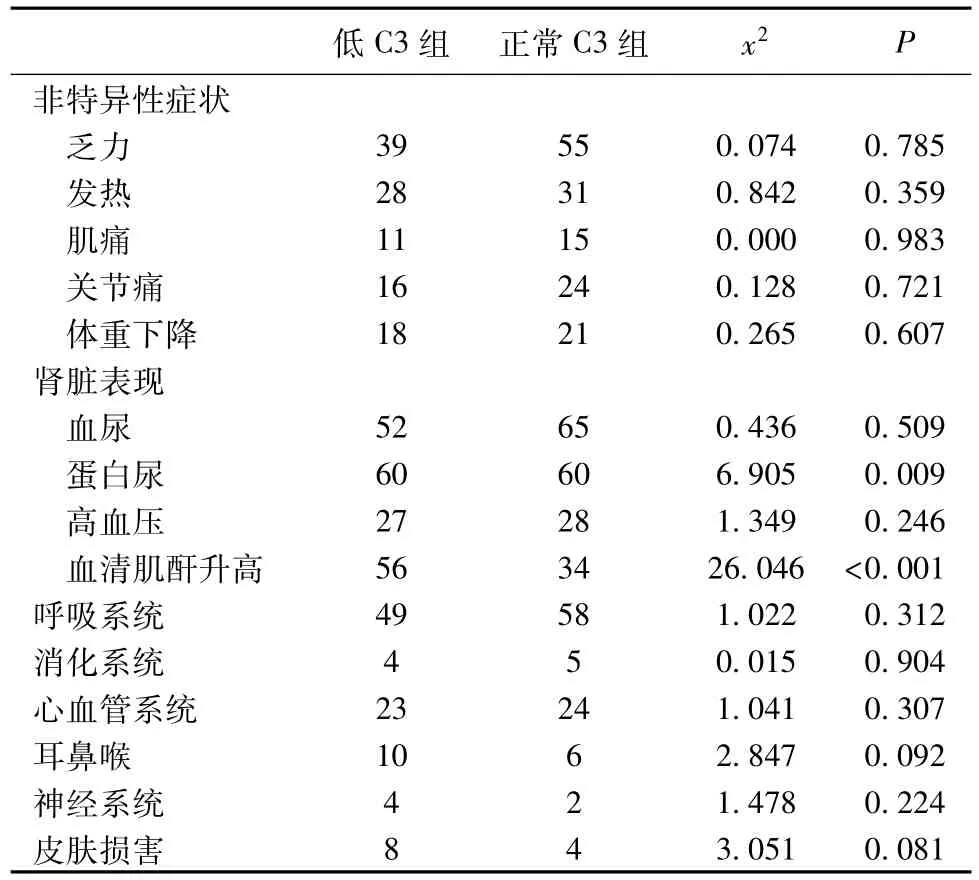
表2 两组患者临床表现的比较

表3 两组治疗方案的比较
终点事件组和非终点事件组AAV患者的比较
基线实验室指标 终点组患者年龄、24h尿蛋白定量、SCr水平均高于非终点组(P<0.05),两组性别ANCA类型比较有统计学意义,终点组血红蛋白水平、血小板数、补体C3水平、eGFR值均低于非终点组(P<0.05)(表4)。
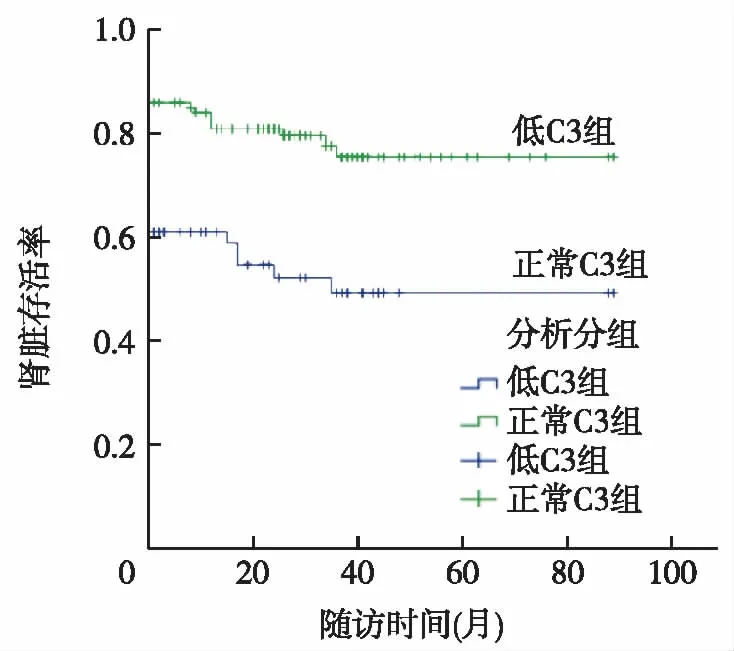
图1 两组肾脏存活率的比较
AAV患者预后影响的多因素COX分析
单因素分析后,将有统计学意义的指标纳入多因素COX分析,结果显示,年龄和SCr水平升高及24h尿蛋白定量为AAV患者预后影响的独立危险因素(P<0.05)(表 5)。

表4 终点组和非终点组患者实验室指标的比较
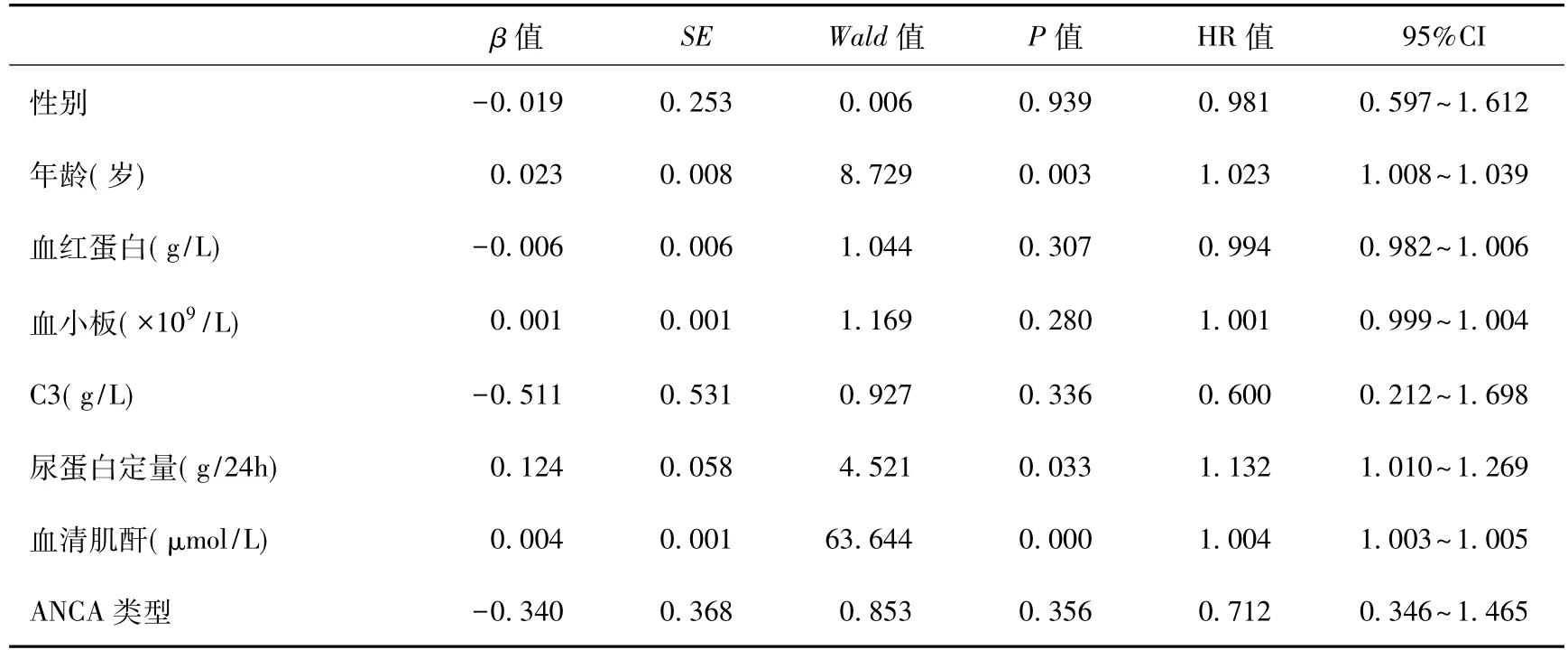
表5 影响患者预后的COX回归分析
讨 论
AAV可累及全身多个脏器,多以肾脏表现为首发症状,常表现为蛋白尿、血尿和SCr升高,因肾脏有特殊的血管分布及血流较丰富,成为各种类型的小血管炎最易侵犯的器官。
补体系统有三种激活途径,补体通过旁路途径激活从而实现AAV的肾脏损伤,而一旦旁路途径被激活,就会自我维持,并作为炎症的放大回路,加重AAV 病变部位的炎症[5]。相关研究证实[5-6],补体在AAV的发病机制中至关重要。C3、C5是补体激活途径的汇聚点,各途径都可导致C3转化为C3a和C3b。C3b又可活化 C5转化酶,将 C5裂解成C5a和 C5b,并形成膜攻击复合体(MAC)C5b-9。中性粒细胞在刺激因子(C5a等)的作用下被激活,并发生脱颗粒和呼吸爆发,中性粒细胞脱颗粒后的产物MPO和PR3黏附在血管内皮细胞,PR3的摄入加快内皮细胞的凋亡,MPO的摄入虽不影响内皮细胞的凋亡,但可致内皮细胞释放氧自由基从而损伤血管内皮[7],导致AAV的发生,以上机制可能是AAV出现广泛多器官损伤的原因之一。
相关研究得出,AAV患者肾组织中可伴C3沉积[8],补体 C3的沉积与患者肾功能下降呈正相关[9],Villacorta等[10]研究指出补体 C3 降低是 AAV患者预后影响的独立危险因素,越来越多的研究亦证明血清补体 C3降低的患者预后差[11-12],而补体的降低则是与补体异常活化导致大量消耗C3有关。本文回顾性分析200例AAV患者,C3降低的患者初诊时SCr水平高,约35%的患者就诊时即需行血液透析治疗,表明低C3组患者肾功能损伤更重,考虑C3大量消耗后免疫复合物清除作用减弱、加重肾脏损害有关,初步可通过监测补体C3评估病情预后。低C3组患者血红蛋白水平低于正常C3组,可能因低C3组患者肾脏受损更重,肾损伤导致促红细胞生成素的减少,同时疾病本身及高SCr水平均影响患者消化系统,导致患者纳差、摄入营养不足有关。
值得注意的是,低C3组患者C反应蛋白和红细胞沉降率值较低,结果与 Augusto[12]、谢丽娇[13]等报道相一致,考虑与补体旁路途径激活有关,其发生机制及临床意义仍待进一步研究。
比较两组治疗方案发现,低C3组患者治疗强度明显强于正常C3组,而生存分析提示低C3组患者的累计肾脏存活率明显低于正常C3组患者,肾脏预后基本可直接反应AAV患者的预后,表明低C3组患者预后及疗效差,可能与肾损害重、肾小球硬化后免疫抑制治疗效果欠佳有关,主要死因是肾功能衰竭导致的多脏器功能衰竭,提示低补体患者早期个体化治疗的重要性。多因素COX分析后得出年龄、SCr水平、24h尿蛋白定量的增高是影响AAV患者预后的独立危险因素,故临床医师应在诊治过程中及早高度关注高危患者,做到早期诊治,对高危患者采取积极有效措施,尽早延缓肾脏功能恶化进展,从而改善预后。
总之,本研究从临床角度分析了补体C3水平与AAV肾脏表现和预后的关系,发现伴C3补体下降的AAV患者肾脏受累更严重,疗效及预后更差,提示应更重视伴低补体血症的AAV患者。本文属小样本单中心回顾性研究,多数患者未行肾活检明确肾脏损害的性质和严重程度,缺少前瞻性研究方案规范患者的治疗,其结果尚需进一步研究证实。

