超声造影对甲状腺癌颈部转移性淋巴结的定性分析
牛 艳 刘慧平
随着颈部超声检查的普及,甲状腺癌在我国发病率也逐年上升。甲状腺癌的预后相对比较高,但是也是最容易发生颈部淋巴结转移的恶性肿瘤[1-2]。甲状腺癌颈部淋巴结转移率一直维持在50%左右,最常见部位是中央区,其次是同侧颈侧区[3]。由于颈部淋巴结引流较为丰富,占全身淋巴结的30%,血液系统的淋巴瘤也可引起颈部淋巴结病变[4]。早期诊断与鉴别甲状腺癌颈部转移性淋巴结与淋巴瘤有利于进行疾病的早期诊治,改善患者的预后[5]。超声具有费用低、无创、简便等优点,已成为颈部淋巴结病变的常规检查方法[6]。不过在常规超声中,淋巴瘤与转移性淋巴结均可表现为体积增大、淋巴门结构消失、纵横比<2;彩色多普勒均可表现为正常淋巴门样血流信号消失,因此鉴别诊断效果不佳[7]。超声造影(contrast enhanced ultrasound,CEUS)是将微泡造影剂经外周静脉注射后到达靶器官或靶组织,通过增强后散射、改变声衰减等原理,增加血流与周围组织间回声的差异,提高超声诊断的准确性[8],特别是实时CEUS能动态、连续、实时地观察病灶的微循环水平造影剂灌注全过程,利用不同组织之间的灌注时相差异提高诊断的敏感性。当前CEUS已广泛应用于乳腺癌、肝纤维化等疾病的诊断,也取得了比较好的效果[9],但是在转移性淋巴结与淋巴瘤定性分析应用方面还无相关报道。本研究选择本院收治的颈部淋巴结病变患者进行CEUS检查,探讨其对甲状腺癌颈部转移性淋巴结的定性价值。现总结报告如下。
1 资料与方法
1.1 一般资料
采用回顾性、总结研究方法,研究时间为2013年4月至2018年3月,选择在我院诊治的疑似甲状腺癌颈部转移性淋巴结或淋巴瘤的颈部淋巴结病变患者80例作为研究对象,纳入标准:医院伦理委员会批准了此次研究;患者颈部单侧发病,在自愿条件下签署知情同意书;医院伦理委员会批准了此次研究;临床资料完整;患者发现颈部淋巴结病变后均未接受任何治疗;通过淋巴结活检获得病理组织学诊断结果。排除标准:妊娠与哺乳期妇女;没有获得CEUS检查结果者,没有获得手术组织病理学检查结果者;临床资料不全的患者。
1.2 超声方法
选择百胜ESAOTE MyLab超声仪器,使用线阵探头L522、L523,探头频率3~9 MHz、4~13 MHz。患者取标准位,垫高颈部,头部适当后仰,嘱患者平静呼吸以保证图像质量,显露检查部位。适当施压以获取灰阶超声图像,评估靶淋巴结的短径、长径等状况,若为多发病灶处的肿大淋巴结,则评估最大淋巴结。
超声造影剂采用微泡造影剂SonoVue(意大利,Bracco公司),造影机械指数0.07。经肘静脉快速团注SonoVue混悬液1.2 ml,然后推注0.9%的氯化钠溶液5 ml,持续观察并动态储存造影图像。
1.3 观察指标
(1)采用常规超声记录淋巴结长径、短径。(2)常规CEUS指标:记录造影模式、造影剂分布、造影灌注区。(3)实时CEUS指标:造影剂平均通过时间(MTT):造影剂全部通过病灶组织所需要的时间;峰值强度(PI):感兴趣区内造影增强曲线的最大强度值;达峰时间(TTP):开始注射造影剂后感兴趣区内造影剂增强达到最大强度的时间;显影时间(AT):开始注射造影剂后到感兴趣区出现造影剂的时间。
为了确保研究数据的真实性与可靠性,所有超声检查工作均由本科室两位超声医生独立完成与进行判定,另由一名不知道超声结果的病理科医生进行病理数据分析与统计。
1.4 统计方法
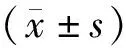
2 结果
2.1 一般资料对比
在80例患者中,病理诊断为甲状腺癌颈部转移性淋巴结患者40例(转移组),其中男性14例,女性26例;年龄32~77岁,平均年龄(48.93±4.46)岁。
病理诊断为淋巴瘤患者40例(淋巴瘤组),其中男性17例,女性23例;年龄20~78岁,平均年龄(48.84±4.51)岁;疾病类型:非霍奇金淋巴瘤36例,4例霍奇金淋巴瘤。
2组性别、年龄对比差异无统计学意义(P>0.05)。
2.2 灰阶超声指标对比
转移组的淋巴结长径、短径显著少于淋巴瘤组(P<0.05),2组长短径比值对比差异无统计学意义(P<0.05)。见表1。
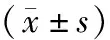
表1 2组常规超声指标对比
2.3 常规CEUS指标对比
相对于淋巴瘤组,转移组CEUS主要表现为造影模式离心性、造影剂分布不均匀与存在无灌注区,对比差异有统计学意义(P<0.05)。见表2。

表2 2组常规CEUS指标对比/例
2.4 实时CEUS指标对比
转移组的MTT值显著高于淋巴瘤组(P<0.05),2组PI、TTP与AT值差异无统计学意义。见表3。
2.5 诊断效果
在80例患者中,CEUS诊断为甲状腺癌颈部转移性淋巴结42例,淋巴瘤38例,CEUS对甲状腺癌颈部转移性淋巴结的定性敏感性与特异性为97.5%(39/40)和92.5%(37/40)。见表4。


组别例数AT/sTTP/sPI/dbMTT/s转移组409.03±0.6119.11±0.56-50.39±5.3948.29±4.30淋巴瘤组408.79±0.6418.92±0.59-53.11±6.1344.98±2.55t0.5330.3240.9136.303P0.4110.6140.1550.016

表4 CEUS对甲状腺癌颈部转移性淋巴结的定性价值/例
3 讨论
淋巴结由淋巴细胞集合而成,可参与机体的免疫反应,为体内重要的免疫器官。临床上有多种疾病均易导致淋巴结肿大,其中颈部淋巴结病变往往发生在疾病的早期,可以是其他疾病的局部改变,也可以是独立性的淋巴结病变[10]。当前我国甲状腺癌颈部转移性淋巴结的发病率较高,且有逐年升高的趋势[11]。由于病因的不同,甲状腺癌颈部转移性淋巴结与淋巴瘤在临床上也具有不同的影像学表现,需要加强早期检测与诊断[12]。
颈部淋巴结的一些超声特征性表现可用于转移性淋巴结与淋巴瘤的鉴别诊断,如淋巴结边缘、淋巴门、大小、形态、边等,但是这些指标的诊断敏感性和特异性都比较低[13]。本研究显示转移组的淋巴结长径、短径显著少于淋巴瘤组(P<0.05),2组长短径比值对比差异无统计学意义(P<0.05)。也有研究表明甲状腺癌颈部转移性淋巴结常表现为纵横比<2、淋巴门消失、组织回声偏低且强弱不均、血流分布杂乱等,但做到鉴别淋巴瘤与转移性淋巴结仍然比较困难[14]。
甲状腺癌是来源于甲状腺滤泡上皮细胞、具有典型的乳头、滤泡结构的恶性上皮细胞肿瘤,为低度恶性癌,生长缓慢[15]。CEUS是近年来超声影像诊断学领域中一个重要的进展,可实现实时动态观察病灶内造影剂的灌注全过程[16]。CEUS有助于淋巴结疾病的诊断和鉴别诊断。转移性淋巴结内的肿瘤组织,常呈低灌注。本研究显示相对于淋巴瘤组,转移组CEUS主要表现为造影模式混合性、造影剂分布不均匀与存在无灌注区,对比差异有统计学意义(P<0.05)。从机制上分析,甲状腺癌颈部转移性淋巴结皮质内血供不如淋巴瘤丰富,因此多表现为局灶性的低灌注区,并可出现因坏死液化而导致的无灌注区[17]。
CEUS可反映组织的血流灌注信息,时间-强度曲线分析反映了造影过程中病灶内造影剂灌注随时间变化的特点,能客观地评价不同病理类型淋巴结各自不同的血流灌注方式[18]。本研究显示转移组的MTT值显著多于淋巴瘤组(P<0.05),2组PI、TTP与AT值对比差异无统计学意义(P>0.05)。从机制上分析,甲状腺癌颈部转移性淋巴结的新生血管丰富,存在着大量的动静脉瘘,管壁缺乏肌层,血流流速流量相对较快,从而MTT减少[19]。
淋巴瘤是由淋巴造血系统产生的恶性肿瘤,主要表现为淋巴结无痛性、进行性肿大, 孤立或散在于颈部、腋下、腹股沟等处,晚期可相互融合,引起局部压迫症状[20]。在临床超声工作中,超声鉴别浅表淋巴结的良恶性多相对容易,而对恶性淋巴瘤与转移性淋巴结的鉴别诊断有一定困难。本研究显示CEUS对甲状腺癌颈部转移性淋巴结的定性敏感性与特异性为97.5%和92.5%。主要在于CEUS能有效观察组织内的血流灌注信号,了解血流分布信息,从而有助于淋巴结疾病的诊断和鉴别诊断[21]。但不同病理类型的甲状腺癌颈部转移性淋巴结的造影剂灌注特点有一定的重叠性,将需要进一步加大样本量进行分析,总结出不同病理类型甲状腺癌颈部转移性淋巴结的实时CEUS特点及规律。
总之,CEUS对甲状腺癌颈部转移性淋巴结的定性诊断有很好的价值,可给临床医生提供客观、直观的造影信息,具有重要的临床诊断价值。

