SMARCC1基因对肝癌细胞HepG2增殖和凋亡的调控作用
柯少波 石 薇 陈佳梅 邱 虎 陈永顺
肝癌是全球最为常见的恶性肿瘤之一,在我国大多数患者是由肝硬化和慢性肝炎进一步发展而来[1]。手术治疗仍是目前最为有效的治疗手段,但复发率较高已经供肝缺乏[2]。肝癌的基因治疗主要通过调控肿瘤细胞遗传物质达到有效的抗肿瘤作用[3]。SMARCC1蛋白是染色体重塑复合体亚基的主要成员之一[4],多项研究表明其参与了肿瘤的发生和发展[5-6]。本课题组前期研究发现,沉默SMARCC1能抑制乳腺癌细胞的生物学活性,抑制肿瘤的侵袭转移[7]。本研究拟通过下调肝癌细胞SMARCC1基因,探讨SMARCC1对乳腺癌增殖和凋亡的影响。
1 材料与方法
1.1 材料与细胞培养
肝癌细胞HepG2系购自武汉大学细胞典藏中心,低糖DMEM培养基、血清、胰蛋白酶等均购自武汉爱生源生物有限公司,Trizol和Lipofectamine2000为美国Invitrogen公司产品,SMARCC1-siRNA及其对照物购自广州锐博生物公司,细胞培养瓶、培养板、MTT试剂、等耗材均购自武汉谷歌生物公司,凋亡试剂盒购自碧云天公司。
1.2 实验分组与转染
肝癌细胞HepG2采用低糖DMEM培养基(含有10%胎牛血清和1%双抗)培养,置于37 ℃、5%二氧化碳及饱和湿度的恒温培养箱中培养。为研究下调SMARCC1对肝癌细胞HepG2增殖、凋亡和蛋白表达的影响,本实验将细胞系分为两组,SMARCC1下调组(转染SMARCC1-siRNA)和 对照组(转染siRNA阴性对照物),将细胞置于六孔板中培养,当细胞融合程度达到70%左右时进行瞬时转染,转染操作按照广州锐博公司产品说明书进行,转染试剂采用Lipofectamine 2000,转染最终浓度为50 nmol/L。
1.3 MTT检测细胞增殖
转染24小时后,将细胞以每孔3000个细胞接种于96孔板中,每孔细胞悬浮液的体积为100 μl,分为实验组和对照组,每组设置5个复孔,并设置空白对照孔,培养24 h、48 h、72 h后采用MTT法检测细胞增殖。MTT检测方法概括为:在96孔板的每孔中加入10 μl的5 mg/L的MTT溶液, 37 ℃条件下放置下4 h后,弃掉培养基,每孔加入150 μl的DMSO溶液,孵育10 min,置于振荡器上微震荡15 min,使得甲瓒结晶充分溶解于DMSO中,采用酶标仪检测各组的吸光度值(OD值),通过空白对照孔调零。
1.4 流式细胞术检测细胞凋亡
流式细胞仪检测细胞凋亡:转染48 h后,收集细胞约1×106个/ml,PBS洗涤一次、离心、弃上清,然后将细胞悬浮液重悬于1 ml孵育缓冲液中。取100 μl细胞(约1×105个)加5 μl的PI试剂和5 μl的AnnexinV-FITC试剂,置于室温下避光孵育15 min。最后加400 μl的孵育缓冲液,一般在1 h内上流式细胞仪机检测。FCM激发波长为488 nm,采用波长515 nm的通带滤器检测FITC的荧光,另一波长>560 nm的滤器检测PI。
1.5 RT-PCR检测mRNA表达
Trizol法提取细胞的总RNA,检测RNA浓度和纯度是否达标,然后按照TagMan RNA逆转录试剂盒(购自美国ABI公司)说明书进行逆转录,获得cDNA。采用SYBR Green PCR master mix试剂盒(购自日本TAKARA公司)进行qRT-PCR。采用2-△△方法进行定量分析,以β-actin作为内参,计算caspase-3、Bcl-2,相对表达量。
1.6 Western blotting检测蛋白表达
提取细胞总蛋白。配置SDS-PAGE分离胶和浓缩胶,加样,电泳,浓缩胶80 V电泳35 min,分离胶100 V电泳90 min,分离蛋白,注意设置marker蛋白。采用湿转发进行转膜,350 mA,转膜120 min,将蛋白转至PVDF膜上。然后进行免疫杂交操作。取出PVDF膜,用BSA封闭1小时,兔抗人一抗孵育过夜(4 ℃条件下),caspase-3 抗体购自武汉三鹰公司,稀释比为1∶1 000,Bcl-2一抗购自Abcam公司,抗体稀释比为1∶1 000,Actin一抗购自三鹰公司抗体稀释比为1∶3 000;TBST系膜3次,每次5 min,二抗(山羊抗兔)孵育1 h,二抗为HRP标记山羊抗兔 IgG,购自三鹰公司,抗体稀释比为1∶5 000,TBST洗膜,每次5 min,化学发光法显影,在暗室中进行曝光操作,扫描胶片上蛋白条带并用软件分析蛋白条带灰度值。
1.7 统计学分析
2 结果
2.1 下调SMARCC1对HepG2细胞增殖及凋亡作用
MTT实验结果表明,转染后24 h,48 h和72 h SMARCC1下调组的HepG2细胞增殖均低于对照组(P<0.05),且随着时间增加,SMARCC1下调组的MC F-7细胞增殖被抑制程度越大,具有时间依赖性,见图1。Annexin V-FITC/PI法检测细胞凋亡结果表明,SMARCC1下调组晚期凋亡率(7.3±0.9)%高于对照组晚期凋亡率(1.3±0.1)%,P<0.01。
2.2 两组细胞Caspase-3、Bcl-2 的mRNA表达水平比较
RT-PCR实验结果表明,实验组 Caspase-3的mRNA相对表达量高于对照组,实验组Bcl-2mRNA相对表达量低于对照组,均差异有统计学意义。见表1。

图1 MTT实验结果

组别Caspase-3Bcl-2对照组0.257±0.0680.724±0.055实验组0.452±0.0760.306±0.072t8.3659.749P<0.01<0.01
2.3 两组细胞Caspase-3、Bcl-2 蛋白表达水平比较
Western blotting实验结果表明,实验组 Caspase-3蛋白表达相对灰度值比高于对照组,实验组Bcl-2蛋白表达相对灰度值比低于对照组,差异均有统计学意义,见表2和图2。
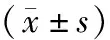
表2 两组细胞Caspase-3、Bcl-2蛋白灰度值比较

图2 两组细胞蛋白条带图
3 讨论
核小体染色质重塑复合体主要通过改变染色质空间结构而调控其疏松程度,从而调控下游基因的转录表达和细胞表型等过程,是表观遗传学的重要机制之一[8-9]。SWI/SNF复合体及其介导的核小体染色质重塑已经是肿瘤研究的焦点,SWI/SNF亚基基因在卵巢癌[10]、胃癌[11]、肝细胞癌[12]、膀胱癌[13]、肾癌[14]、乳腺癌等肿瘤中高度突变,参与了肿瘤发生、发展,可能是1种普遍癌症发生机制。SWI/SNF复合体的核心亚基之一SNF5在人和小鼠中表现为一种抑癌基因,SNF5在肝癌组织中表达低于癌旁组织,其表达量与肝癌细胞分化程度有关,SNF5在肝细胞肝癌中呈现为低表达,并且其低表达与肝细胞肝癌的低分化程度显著相关。SMARCC1是SWI/SNF复合体的亚基之一,本研究下调肝癌细胞系的SMARCC1基因,MTT和凋亡实验结果表明,下调SMARCC1抑制了肝癌细胞的增殖,促进其凋亡。研究表明SMARCC1在乳腺癌、前列腺癌等中均呈现高表达,且细胞实验表明内源性的高表达促进了肿瘤细胞的增殖和侵袭,因此,SMARCC1可能是1种癌基因[15]。 另有研究者表明,SMARCC1在前列腺癌组织中呈现高表达,SMARCC1的表达高低与前列腺癌复发、淋巴转移及病理Gleason分级呈正相关[16]。
为进一步探讨下调SMARCC1而促进肝癌细胞HepG2凋亡的机制,本研究采用RT-PCR法及Western blotting 法检测实验组和对照组细胞增殖相关基因caspase-3和Bcl-2基因的蛋白和mRNA表达水平变化,结果表明,SMARCC1下调组细胞caspase-3的蛋白和mRNA表达水平均高于对照组,而SMARCC1下调组细胞Bcl-2的蛋白和mRNA表达水平均低于对照组。Caspase-3是caspase家族的重要成员之一,是1种蛋白酶,活化的caspase-3能促进肿瘤细胞凋亡,在恶性肿瘤细胞凋亡中起着不可替代的作用。caspase-3参与肿瘤细胞凋亡机制之一主要是诱导CTL细胞杀伤,本研究SMARCC1下调组的肝癌细胞caspase-3表达增加,说明下调SMARCC1后可能通过上调caspase-3基因表达而促进肝癌细胞的凋亡。B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)同样是细胞凋亡研究中最受关注的基因之一,Bcl-2是重要的癌基因,能够与其家族的Bcl-X1、Bcl-Xs、Bax等结合,形成同源的蛋白二聚体,抑制肿瘤细胞凋亡。在Bcl-2与Bax形成的二聚体中,如果Bax相对量高于Bcl-2,则促进肿瘤细胞凋亡,而Bcl-2若高于Bax则抑制肿瘤细胞凋亡,从而促进肿瘤发生发展。本实验中下调SMARCC1后Bcl-2基因表达水平被抑制,说明下调SMARCC1基因可能通过抑制癌基因Bcl-2而抑制肿瘤细胞增殖活性。
总之,下调SMARCC1基因能抑制肿瘤细胞增殖活性,促进其凋亡,其机制可能与活化caspase-3蛋白及抑制癌基因Bcl-2等通路相关。

