辛硫磷对鲫肝微粒体CYP3A酶活性、mRNA及蛋白表达的影响
李 思,刘晓宇,2
(1.华中农业大学食品科技学院,武汉 430070;2.环境食品学教育部重点实验室,武汉 430070)
有机磷化合物是杀灭传染病媒介昆虫、防治农作物病虫害的有效药物。现使用的有200余种,常用的有辛硫磷、毒死蜱、敌敌畏、氧化乐果和敌百虫等。其中我国生产的有机磷农药占我国农药总产量的50%以上[1]。目前,环境中的有机磷农药对其造成的危害已严重制约了我国水产养殖业的发展和水产品的出口。辛硫磷作为一种常见的有机磷农药广泛应用于水产养殖中的清塘和病虫害防治[2],施用于田间的辛硫磷还可以通过地表径流进入地表水,造成水体污染[3]。鲫(Carassiusauratusgibebio)是我国重要的大宗淡水鱼类之一,位居大宗淡水鱼第四位。现今,国内外研究辛硫磷对水生生物,尤其是对在我国广泛养殖的鲫的影响的研究十分不足。
细胞色素P450是1958年被发现的,它是一类以还原态与CO结合后在波长450 nm处有吸收峰的含血红素的单链蛋白质。目前,已知的CYP450酶系主要由血红素蛋白(P450、b5)、黄素蛋白(NADPH-P450还原酶、NADPH-b5还原酶)和磷脂(主要是磷脂酰胆碱)三种成分组成,共同构成一个电子传递体系[4]。细胞色素P450在同一动物的许多不同组织中都存在。对于脊椎动物,CYP450酶含量最丰富的器官一般为肝脏,在肾、皮肤、小肠、肺、脑、消化道、骨髓等组织器官也有分布[5]。CYP3A是CYP450家族中主要的一个亚族,在肝脏CYP450的含量为30%~40%,占据第一位,目前已发现越来越多的药物由CYP3A催化代谢,且CYP3A还与许多前致癌物和前毒物的代谢活化有关[6]。CYP3A在鱼类研究中应用广泛,其作为一种生物标志物,应用于环境生态学和毒理学。目前,已有毒性物质,例如咪唑类离子液体[7]、多溴联苯醚[8]、铜镉重金属[9]等对鱼类CYP3A活性以及基因表达方面的研究,但是有关广泛使用的农药辛硫磷对其活性以及更深层次的转录水平和蛋白水平的研究还存在很大的不足。本研究旨在从酶活性、转录及翻译水平研究辛硫磷对鲫肝微粒体中CYP3A的影响以及其效应相互关联性做初步的探索,为后期更深入探究有机磷农药对水生生物的代谢调控机理奠定基础。
1 材料和方法
1.1 实验动物
实验所用鲫购自武汉鲫养殖场。平均重量为(107±14.2)g。实验前,将鲫养殖于(50 cm×30 cm×20 cm)的玻璃水箱内,养殖用水为充分曝气除氯后的自来水,驯养一周至稳定。增氧机连续增氧,每日换水一次并清理缸内杂物,温度控制在(24±2)℃。
1.2 试剂及仪器
99%的辛硫磷分析标准品和红霉素(E105345)购自上海阿拉丁生化科技股份有限公司; 还原型辅酶NADPH-Na4(>98%)购自北京索莱宝科技有限公司;动物组织/细胞总RNA提取试剂盒、第一链反转录试剂盒和2×SYBR qPCR Mix(荧光定量)均购自北京庄盟国际生物基因科技有限公司;兔多抗CYP3A4(18227-1-AP)购于武汉三鹰生物技术有限公司;兔多抗GAPDH(AB-P-R 001)购于杭州贤至生物有限公司;HRP标记羊抗兔二抗(BA1054)购于武汉博士德生物工程有限公司;其他化学试剂均为国产分析纯。
1.3 引物合成
参照文献[10]由武汉百捷智生物科技有限公司合成鲫CYP3A引物:F1(5′-CGA CCT TCG CCC TCC ACA G-3′)和 R1(5′-ACC TCA TCC CGA TGC AGT TCC-3′)以及β-actin内参基因引物:F2(5′-TCT TTT CCAGCC ATCCTT CCT A-3′)和R2(5′-GGT CAG CAA TGC CAG GGT A -3′)。
1.4 实验设计
根据文献[11],选取0.082 5、0.165、0.330 mg/L(1/40、1/20、1/10的96 h LC50)分别作为实验组的低、中、高浓度值。对照组为丙酮助溶剂组。因辛硫磷见光易分解,整个实验过程避光进行,持续充氧,不喂食,采用半静态染毒法。分别在染毒24、48、72和96 h后,迅速取出鲫肝脏,一部分用于提取RNA,一部分用于提取肝微粒体,提取后立即放入-80 ℃贮存。
1.5 肝微粒体的制备
采用差速离心法制备鲫肝微粒体,方法参照文献[12],稍作改动。迅速敲击鲫头部,昏迷后测体长、鱼重,解剖,立即取出肝脏,用0.1 mol/L,pH 7.4的PBS缓冲溶液反复漂洗去除红细胞,滤纸上除去多余液体后称重,转入手持式匀浆器,按1∶4(W/V)的比例加入匀浆缓冲液,置冰浴中制成匀浆。将匀浆液转入预冷离心管中,4 ℃条件下,12 000g离心20 min,弃去上层漂浮乳白色脂质,取出其余上清液转移至超高速离心管中,4 ℃条件下,15 000g离心60 min,弃上清液,底部粉红色沉淀即为微粒体组分。按照每克肝加悬浮缓冲液1 mL震荡混合后,分装于管中,-80 ℃冰箱贮藏备用。
1.6 蛋白含量的测定
采用BCA法测定肝微粒体蛋白总含量。配制BCA 工作溶液,牛血清白蛋白(BSA)标准溶液,制备标准曲线,依据标曲,计算样品蛋白含量。
1.7 鲫肝微粒体中CYP3A酶活性的测定
通过测定红霉素-N-脱甲基酶(ERND)活性反映CYP3A酶活性,具体方法参照文献[13]。酶活性以pmol甲醛/(min·mg)蛋白表示。
1.8 CYP3A mRNA相对表达水平的检测
利用动物组织/细胞总RNA提取试剂盒迅速提取鲫肝脏中的RNA,用紫外分光光度计测OD260/OD280比值检验RNA产量和纯度,采用1%琼脂糖凝胶电泳检测RNA完整性。按cDNA第一链合成试剂盒说明书合成cDNA,-20 ℃保存备用。qRT-PCR反应采用Qtower 2.2(Analytik Jena AG,German),具体操作参照2×SYBR qPCR Mix试剂盒操作说明进行。反应条件:95 ℃预变性5 min,95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸20 s,循环次数40次,温度以1 ℃/10 s的速率从65 ℃缓慢递增到95 ℃,连续测定样品的荧光强度以获取熔解曲线。利用2-ΔΔCt法计算基因的相对表达量(ΔCt=目的基因Ct平均值-内参Ct平均值;ΔΔCt=实验组ΔCt-对照组ΔCt)。
1.9 CYP3A蛋白相对表达水平的检测
利用差速离心法制备的肝微粒体蛋白经SDS-PAGE进行初步分离,切下目的条带,通过电转移到PVDF膜上(转膜条件:GAPDH: 200 mA,90 min;CYP3A4:200 mA,120 min),用含5% 脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h,用封闭液稀释相应的一抗,使PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜(GAPDH:1∶1 000;CYP3A4:1∶1 000),TBST充分洗涤PVDF膜5~6次,5 min/次,用封闭液稀释相应的HRP标记二抗(1∶50 000稀释),使PVDF膜浸泡于二抗孵育液中,37 ℃摇床孵育2 h,TBST充分洗涤PVDF膜5~6次,5 min/次,将ECL试剂中增强液与稳定的过氧化物酶溶液按1∶1比例混匀,滴加工作液于PVDF膜上,反应数分钟待荧光带明显后,用滤纸吸去多余的底物液,覆上保鲜膜,X光胶片压片后依次放入显影液显影、定影液定影,冲洗胶片。晾干胶片,扫描胶片,用BandScan分析胶片灰度值。
1.10 数据分析
以上结果以平均值±标准差(mean±SD)表示。采用SPSS 22.0软件进行多组间均数比较,采用单因素方差分析,当P<0.05时表示实验组与对照组有显著性差异,则进一步采用Duncans test 进行检验比较,当P<0.01时表示实验组与对照组有极显著性差异。图形处理使用GraphPad Prism 5.0软件。
2 结果与分析
2.1 辛硫磷对鲫肝微粒体中CYP3A酶活性的影响
辛硫磷对鲫肝微粒体中的CYP3A酶活性影响见图1,结果显示,辛硫磷对CYP3A酶活性整体上呈现较为明显的抑制作用。染毒后24 h和72 h呈现明显的剂量效应关系,随染毒浓度的增加,活性抑制作用愈加明显,与对照组相比,染毒后24 h,高浓度组的酶活性降低了29.6%,差异极显著;染毒后72 h,中、高浓度组酶活性分别降低了25.8%和38.6%,差异极显著。染毒后48 h,相比对照组,CYP3A酶活性表现为在低浓度时受到显著抑制,而在中、高浓度组间无显著差异;染毒后96 h无显著剂量效应,低、中浓度组相比对照组无显著差异,但在高浓度组间抑制作用明显,酶活性降低了52.6%。

图1 辛硫磷对鲫肝微粒体中CYP3A酶活性的影响(n=3)Fig.1 Effect of phoxim on CYP3A activity in liver microsomes of C.auratus gibebio(n=3)“*”表示与同一天的对照组(0 mg/L)相比差异显著(P<0.05);“**”表示与同一天的对照组(0 mg/L)相比差异极显著(P<0.01)。图2、图3同。
2.2 辛硫磷对鲫肝微粒体中CYP3A mRNA相对表达的影响
辛硫磷对鲫肝微粒体中的CYP3A mRNA相对表达的影响见图2,结果显示,辛硫磷能降低鲫肝微粒体中的CYP3A mRNA的表达量。整体上,均不存在明显的剂量效应关系,染毒后24 h,相比对照组,低、高浓度组CYP3A mRNA的下调作用极显著,分别下调了35.9%和65.5%,而在中浓度组染毒时无显著差异。染毒后48 h仅在低浓度组时相较对照组存在极显著差异,中、高浓度组无显著差异。辛硫磷染毒后72 h及96 h,相比各对照组,各浓度组间都存在极显著差异,72 h后,低、中、高浓度组CYP3A mRNA表达分别下调了81.7%、56.2%、89.4%;96 h后,低、中、高浓度组CYP3A mRNA表达分别下调了66.1%、77.2%、73.4%。
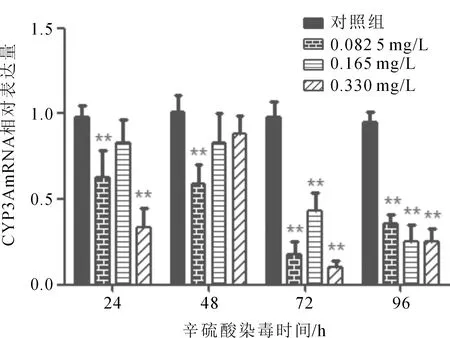
图2 辛硫磷对鲫肝微粒体中CYP3A mRNA相对表达的影响(n=3)Fig.2 Effect of phoxim on CYP3A mRNA expression in liver microsomes of C.auratus gibebio(n=3)
2.3 辛硫磷对鲫肝微粒体中蛋白相对表达的影响
辛硫磷对鲫肝微粒体中的CYP3A蛋白表达量的影响见图3、图4,结果显示,辛硫磷能降低鲫肝微粒体中的CYP3A蛋白的表达量,并且在各染毒时间组中皆呈现明显的剂量效应关系,辛硫磷浓度越高,表达量越低。相较其他时间组,染毒后24 h,CYP3A蛋白表达量的抑制作用更显著,低、中、高浓度组的表达量分别下降了21.8%、42.5%、62.3%;48 h后,相比对照组,低、中浓度组的蛋白表达量无显著差异,但高浓度组存在显著抑制的现象,表达量降低了48.9%;染毒后72 h和96 h的情况类似,CYP3A蛋白的表达量都在中、高浓度组表现为显著差异,在低浓度染毒时不存在显著差异。

图3 辛硫磷对鲫肝微粒体中CYP3A蛋白相对表达的影响(n=3)Fig.3 Effect of phoxim on CYP3A protein expression in liver microsomes of C.auratus gibebio(n=3)
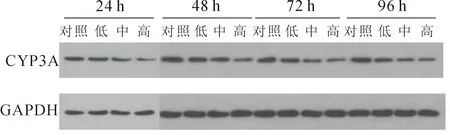
图4 辛硫磷暴露下鲫肝微粒体CYP3A及GAPDH的western blot结果Fig.4 Western blot results of CYP3A and GAPDH in livermicrosomes of C.auratus gibebio exposed to phoxim
3 讨论
CYP3A作为占据CYP450酶含量最多的一类重要亚型,参与众多内、外源性物质的代谢和调控作用,调节机体的生理功能。辛硫磷作为一种在渔业生产中被广泛使用的农药,主要用来杀灭渔业害虫和鱼类寄生虫,对高等动物低毒,但对鱼类具有一定的毒性[14]。现阶段研究主要集中于辛硫磷对动物机体造成的神经毒性和生殖毒性上。研究显示不同浓度的辛硫磷会对中华稻蝗的乙酰胆碱酯酶(AChE)、酯酶(EST)活性及抗氧化系统产生影响,氧自由基的形成可能是辛硫磷毒性的一个因素[15];孟顺龙等[16]研究表明辛硫磷对罗非鱼的超氧化物歧化酶活性有显著抑制效应。
本研究显示,辛硫磷能够抑制鲫肝微粒体中CYP3A的酶活性、mRNA和蛋白的表达量,其对活性的抑制作用与CYP3A mRNA和蛋白的表达量减少存在一定的关联。不同时间的辛硫磷染毒对CYP3A酶活性的抑制程度不同,但在整体上无明显的时间效应关系。
就CYP3A mRNA的表达水平与酶活性关系而言,染毒后48 h的不同浓度组间,24 h和72 h时的中、高浓度组间,CYP3A的转录水平及酶活性变化表现为很强的一致性,说明辛硫磷可通过影响CYP3A的mRNA转录从而导致相应蛋白表达量的减少,最终使得CYP3A的酶活性受到抑制,这与黄连素对鲫[10]及诺氟沙星对剑尾鱼[17]CYP3A mRNA转录和酶活性的抑制关系影响类似。辛硫磷对鲫肝脏CYP3A转录水平的影响可能涉及对动物CYP3A转录调控PXR(孕烷X受体)代谢途径的参与。PXR能够结合并激活来自多个物种的CYP3A基因启动子中的特异性反应元件的转录[18]。研究表明核受体蛋白PXR会介导小鼠脑微血管内皮细胞[19]、食蚊鱼肝脏[20]、海鲷肝细胞[21]CYP3A基因的转录。Ding等[22]研究发现炎症反应期间肝细胞PXR介导的CYP3A的调节机制可能是通过改变一种或多种PXR蛋白共因子复合物的磷酸化状态,从而激活蛋白激酶C(PKC)信号通路进而抑制PXR的活性。但就本实验结果而言,也存在其他时间浓度组间mRNA表达量与酶活性变化不完全同步的现象,这可能是由于鲫体内存在其他转录水平上的调节作用,诸如过氧化物酶体增殖物激活受体(PPARA)、维生素D结合受体(VDR)、组成型雄烷受体(CAR)等参与动物肝脏CYP3A的转录调节[23]。
就CYP3A mRNA的表达水平与其蛋白表达量关系而言,基本不存在相一致的对应关系,这可能是因为特定基因的mRNA丰度不一定与其翻译产物蛋白质的表达量呈线性关系,基因表达的调控除了转录水平的调控,还存在转录后调控和翻译,过程中的mRNA的降解、蛋白的降解等因素都可能导致mRNA丰度与蛋白表达水平不一致[24]。CYP3A蛋白的表达水平基本呈现较强的剂量与时间效应,并且CYP3A蛋白的表达量在24、72和96 h染毒后与其酶活性的影响基本一致,这说明辛硫磷对CYP3A酶活性的影响与其最终的蛋白表达量有关,但在48 h后两者存在负相关的现象,这可能是由于在此期间存在蛋白质的翻译后修饰的作用。诸如磷酸化、硝基化、泛素化等蛋白质翻译修饰作用都会对CYP450酶的活性产生影响[25]。关于辛硫磷对鲫肝脏CYP3A表达中可能涉及到转录因子介导的代谢通路的变化及蛋白质翻译后修饰作用的影响有待后续深入研究。

