大鲵源致病性弗氏柠檬酸杆菌的分离、鉴定和药物敏感性
苏 英,吴荣华,申君宇,李伟平,何 滔,李 云,丁诗华
(西南大学动物科技学院,重庆生态渔业产业技术研究院,淡水鱼类资源与生殖发育教育部重点实验室,重庆 400715)
大鲵(Andriasdavidianus)俗名“娃娃鱼”,隶属于两栖纲有尾目隐鳃鲵科,为国家二级水生野生保护动物,具有很高的营养、药用及观赏价值[1]。弗氏柠檬酸杆菌(Citrobacterfreundii)属于肠杆菌科(Enterobacteriaceae)柠檬酸杆菌属(Citrobacter),普遍存在于土壤、酸性温泉、放射性废物、水和地壳深处,可在植物和动物的活体中生长[2],可感染人和动物,引起腹泻、食物中毒和继发感染[3],是一种典型的人-兽-鱼共患病条件性致病菌[4]。弗氏柠檬酸杆菌对水生动物的致病性报道较多。1982年,Sato等[5]从皮肤腐烂、出血的翻车鲀(Molamola)体内分离到弗氏柠檬酸杆菌。随后,又有关于弗氏柠檬杆菌引起鲟(Acipenserschrenckii)、花鳗鲡(Anguillamarmorata)等发病死亡的报道[6-7]。2001年,李华等[8]首次报道了弗氏柠檬酸杆菌可引起河蟹(EriocheirsinensisH.)败血症,也可引起红螯螯虾(Cheraxquadricarinatus)、中华鳖(Trionyxsinensis)、克氏原螯虾(Procambarusclarkii)等患病[9-11]。由于该菌对抗生素的敏感性因宿主来源而异[6-11],因此有必要对其进行药物敏感性分析,以期为疾病治疗提供科学参考依据。
本研究从患病大鲵内脏器官分离得到一株优势病原菌,对分离菌株采用形态学观察、生理生化特性测定和16S rRNA、aspC管家基因测定进行鉴定,确定其为弗氏柠檬酸杆菌。人工感染发现分离菌株对健康大鲵具有很强的致病性,胞外酶分析发现其致病性可能跟其产生卵磷脂酶相关。同时,对分离菌株开展了药物敏感性试验,以期为大鲵细菌性疾病的防治提供一定的理论参考。
1 材料与方法
1.1 试验材料
1.1.1 生物材料
重庆梁平某大鲵养殖场,2017年5月开始陆续有大鲵死亡,死亡的大鲵为2龄成体鱼,体重在500 g左右,损失较大。发病水温一般在21 ℃,温度越高,发病率越高,温度低于21℃也发病,但发病率较低。病鲵外部症状主要表现为腹部肿大、食欲不振、四肢充血溃烂和口腔发炎充血,剖检可见胃、肠道充血。144尾(500±40)g健康大鲵与发病大鲵是同一个品系,购买自武隆某大鲵养殖场,避光暂养于水温25 ℃的流水养殖系统,暂养一周后无异常症状,用于后续感染实验。
1.1.2 试剂
细菌微量生化反应管和药敏纸片购于杭州微生物试剂有限公司。细菌基因组DNA 提取试剂盒购于天根生化科技(北京)有限公司。2×Taq MasterMix购于索莱宝生物科技有限公司。
1.2 方法
1.2.1 病原菌的分离与纯化
在超净工作台中,用酒精棉擦拭病鲵体表,无菌解剖,接种环蘸取胃、肠、肝、肾、脾组织,划线接种于普通营养琼脂(NA)培养基,28 ℃培养24 h后,挑取形态特征一致的菌落进行划线纯化,获得纯培养。分离菌株接种于脑心浸液培养基(BHI)28 ℃培养24 h,与40%无菌甘油等体积均匀混合,置于-80 ℃ 保存备用。
1.2.2 细菌鉴定
1.2.2.1 形态学观察
将菌株int1705接种于NA培养基上,28 ℃培养24 h后,记录其菌落形态特征,并进行革兰氏染色观察。
1.2.2.2 生理生化特性测定
将-80 ℃ 保存的纯化菌株接种于BHI液体培养基,28 ℃,180 r/min振荡培养18 h,接种细菌微量生化反应管,28 ℃培养24~48 h,参照《伯杰细菌鉴定手册》进行细菌鉴定。胞外酶活性(溶血活性、酯酶、脲酶、淀粉酶、卵磷脂酶、明胶酶)检测根据陈言峰等[12]和Rozhavin等[13]的方法进行。
1.2.2.3 16S rRNA和aspC基因的序列分析
根据DNA提取试剂盒说明书提取菌株基因组DNA,以分离菌株基因组DNA做为模板,用细菌16S rRNA 通用引物(正向引物5′→3′:AGAGTTTGATCCTGGCTCAG;反向引物5′→3′:GGTTACCTTGTTACGACTT)、aspC管家基因引物(正向引物5′→3′:GTTTCGTGCCGATGAACGTC;反向引物5′→3′:AAACCCTGGTAAGCGAAGTC)分别进行PCR 扩增。反应体系为50 μL:2×Taq MasterMix 25 μL,DNA 模板(100 ng/μL)4 μL,上、下游引物(10 μmol/mL)各2 μL,加入ddH2O 至总容量为50 μL。PCR 反应条件:94 ℃变性3 min;94 ℃ 变性1 min,55 ℃/56 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR结束后,产物在1%琼脂糖凝胶中进行电泳检测,凝胶成像仪中进行产物分析并拍照,然后回收产物,送至北京六合华大基因进行测序分析。
将分离菌株的16S rRNA 及aspC管家基因序列通过美国国立生物技术信息中心(NCBI )中BLAST检索系统进行序列同源性分析,并进行比对。使用软件MEGA5.1中邻接法(NJ,Neighbour-joining)构建系统发育树,步展值(Bootstrap value)设为1 000进行置信度检测。
1.2.3 人工感染试验
将分离菌株int1705接种于BHI液体培养基中,28 ℃,180 r/min振荡培养18 h,4 000g离心10 min,用无菌PBS缓冲液洗涤沉淀3次,麦氏比浊法测定细菌浓度。调整菌液浓度为五个梯度。暂养后的健康大鲵随机平均地分为5个实验组和1个对照组,每组各8尾。5个实验组分别腹腔注射1 mL浓度为1×109、1×108、1×107、1×106和1×105CFU/mL的菌液,对照组注射同体积的0.01 mol/L无菌磷酸盐缓冲液(PBS),实验组和对照组都设置三个平行。实验期间保持水温25 ℃,溶氧充足。每天观察大鲵活动情况,记录各组实验动物死亡情况,对濒死大鲵进行解剖观察,从肝脏、脾脏、肾脏、肠道、胃分离纯化致病菌菌株。对实验动物的半致死浓度(LD50)采用累计法(Reed-Muench)计算。
1.2.4 药敏试验
采用纸片扩散法(KB,kirby-baner法)对分离菌株进行药敏试验。通过麦氏比浊法,调整菌液浓度为0.5麦氏标准(1.5×108cfu/mL),无菌条件下使用无菌棉棒均匀涂布于MH琼脂培养基平板。用无菌镊子取待测药敏纸片,贴于MH培养基表面,37 ℃培养16~18 h,记录各药敏纸片的抑菌圈直径。根据杭州微生物试剂有限公司说明书标准,判断药物的敏感程度。
2 结果
2.1 病原菌分离纯化
从大鲵胃、肠、肝脏、肾脏、脾脏取样于NA培养基上划线,经28 ℃恒温培养24 h,从胃、肠、脾脏均获得一株优势细菌,编号int1705。分离菌株在普通营养琼脂平板上生长良好。
2.2 人工感染试验
int1705菌株对每尾大鲵LD50为3.16×106CFU/mL。注射组大鲵出现不同程度的死亡情况,注射PBS的对照组未出现死亡(如图1所示)。发病大鲵主要症状为口腔发炎溃烂、后肢充血溃烂、肠胃出血和胆囊肿大等症状(图2)。从发病大鲵的肠道、胃部、脾脏充血处分离得到优势菌株,表明菌株int1705是大鲵此疾病的病原菌。
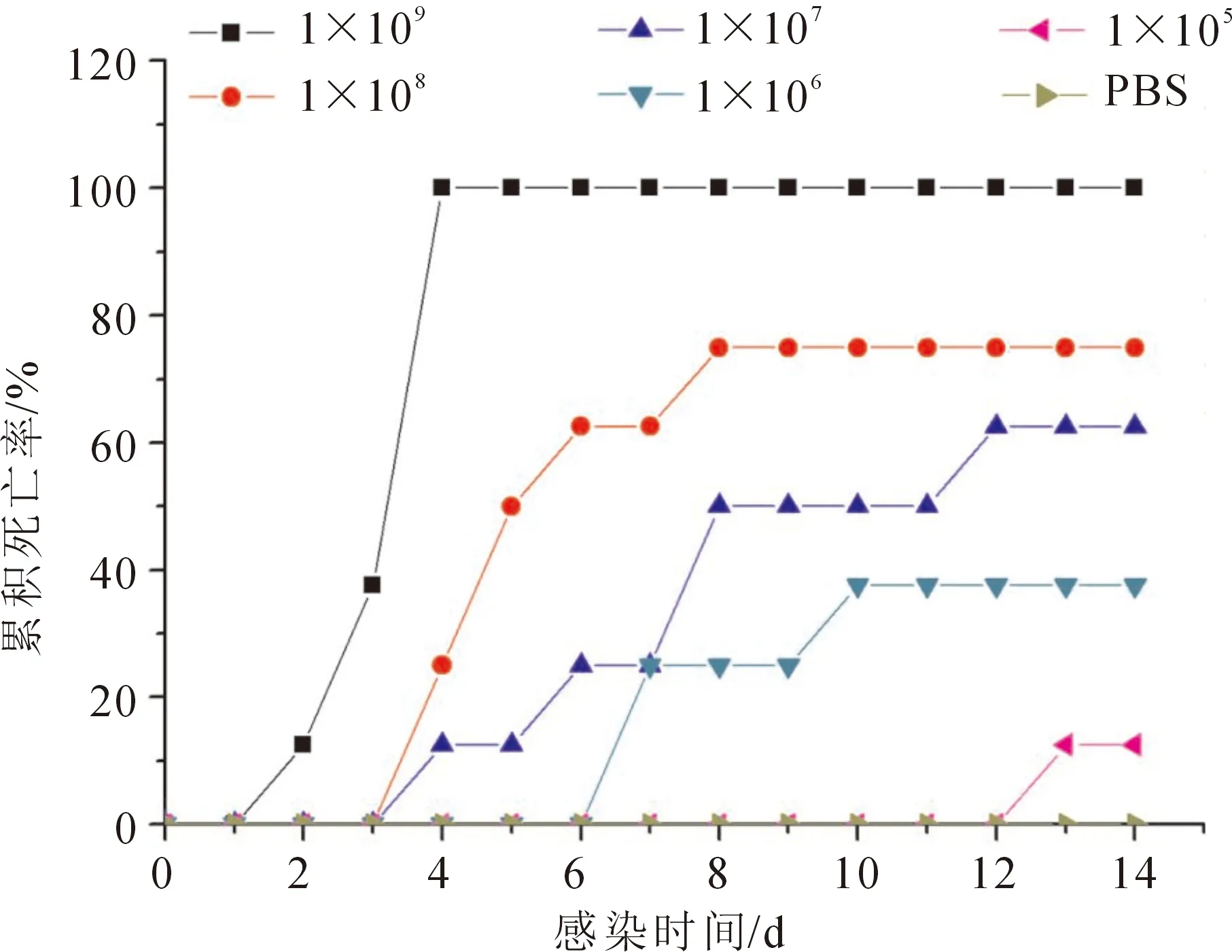
图1 大鲵注射不同浓度int1705菌株的累积死亡率Fig.1 Cumulative mortality of A.davidianus challenged with different doses of int1705 via intraperitoneal injection

图2 大鲵发病症状Fig.2 The symptoms of hemorrhagic tissues A:口腔溃烂出血;B: 充血溃烂的后肢;C:胃肠充血
2.3 细菌鉴定
2.3.1 形态特征
菌株int1705在NA培养基上培养,菌落形态呈圆形,边缘整齐,表面光滑,中央稍微凸起,为乳白色,菌落直径2~4 mm。革兰氏染色为阴性,镜检观察其为两端钝圆,长2~6 μm,直径1 μm的短杆菌(图3)。

图3 int1705菌株的革兰染色Fig.3 Gram staining of the int1705 strain
2.3.2 生理生化特性
菌株int1705生理生化特性见表1。参照《伯杰氏系统细菌学手册》,菌株int1705的生理生化特性符合弗氏柠檬酸杆菌特征。
对菌株int1705溶血酶、脂酶、脲酶、淀粉酶、明胶酶的检测,结果均为阴性,卵磷脂酶的检测结果为阳性。

表1 int1705菌株的生理生化特性
2.3.3 16S rRNA基因和aspC管家基因序列分析
菌株int1705的16S rRNA、aspC基因经PCR 扩增后进行1%琼脂糖凝胶电泳检测,结果如图4(泳道3和泳道4)所示,序列长度分别为1 442 bp和502 bp,与预期产物大小一致,阴性对照(泳道1和2)无条带出现。

图4 分离株int1705的16S rRNA及aspC基因序列的PCR扩增产物电泳图Fig.4 The electrophoresis results of 16S rRNA and aspC gene fragments from int1705泳道M:DNA 分子质量标准(DL2000);泳道1-2:aspC和16S rRNA基因序列PCR阴性对照。泳道3-4:aspC和16S rRNA基因PCR扩增产物。
将获得的序列在NCBI的BLAST系统中进行序列同源性分析,结果表明分离株int1705的16S rRNA 基因与弗氏柠檬酸杆菌(Citrobacterfreundii,登录号为KC210829.1)的同源性达99%,系统进化树结果(见图5)显示,分离株int1705与弗氏柠檬酸杆菌处于同一分支。aspC 管家基因序列分析结果显示与弗氏柠檬酸杆菌(Citrobacterfreundii,登录号为HQ111096.1)的同源性达99%,系统进化树结果(见图6)亦显示与弗氏柠檬酸杆菌处于同一分支。

图5 int1705菌株16S rRNA 基因序列与部分相关菌株的系统发育树Fig.5 Phylogenetic tree based on 16S rRNA sequences of int1705 and related strains

图6 int1705菌株aspC 序列与相关菌株的系统发育树Fig.6 Phylogenetic tree based on aspC sequences of int1705 and related strains
2.4 药物敏感性
菌株int1705对多粘菌素B、丁胺卡那、羧苄西林、哌拉西林、头孢哌酮、头孢曲松、头孢他啶、诺氟沙星、氧氟沙星、复方新诺明等10种药物敏感,对庆大霉素、卡那霉素、四环素、米诺环素和多西环素等5种药物中度敏感,对苯唑西林、头孢氨苄、头孢拉定、克林霉素、麦迪霉素、新霉素、青霉素等7种抗菌药物存在不同程度的耐药性,详细药敏试验结果见表2。

表2 分离株的药物敏感性
注:S:敏感;I:中度敏感;R:耐药。
3 讨论
过去认为弗氏柠檬酸杆菌是肠道致病菌,但近年来发现,临床上毒力较强的菌株可能穿过肠道黏膜,进而在全身扩散传播,引起机体系统感染,而不仅仅局限于肠道感染[4]。张冬星等[14]的研究中,发现弗氏柠檬酸杆菌可引起团头鲂(Megalobramaamblycephala)肛门红肿,腹腔积液,鱼鳔和肝严重出血,肾、脾肿大等病理性变化。卢君辉等[15]从乌翅真鲨(Carcharhinusmelanopterus)病鱼肝脏、腹腔及肠道中分离得到弗氏柠檬酸杆菌。其他研究表明弗氏柠檬酸杆菌可导致锦鲤(CyprinuscarpioL.)、鲫(Carassiusauratus)发病[16-17],病鱼主要表现竖鳞、皮肤腐烂、腹腔积液和肛门红肿等症状。本试验从患病大鲵体内分离的int1705,经过16S rRNA和aspC保守序列测序及系统发育学分析,发现该菌株与弗氏柠檬酸杆菌的同源性高达99%,结合形态特征、生理生化特性将该菌株鉴定为弗氏柠檬酸杆菌。菌株经回归感染试验发现可使健康大鲵患病,感染器官组织与其他宿主较为一致,都有皮肤腐烂,腹腔积液,组织充血的病理性特征。从回归感染的患病大鲵分离的病原菌的生理生化特性和16S rRNA保守序列与分离株int1705一致,因此确认该菌株为导致大鲵出现腹腔肿胀、皮肤溃烂症状的病原菌。回归感染试验测得该菌对大鲵的半致死浓度(LD50)为3.16×106CFU/mL。通过选择培养基检测弗氏柠檬酸杆菌可能产生的外毒素,结果显示,菌株int1705不产生溶血素、酯酶、脲酶、淀粉酶、溶胶酶,产生卵磷脂酶,能造成细胞膜损伤,导致其出现充血溃烂等症状[18]。其致病机制尚有待进一步研究。
弗氏柠檬酸杆菌对抗生素的敏感性因宿主来源和环境而异。从印度病人肠道分离和引起东北虎出血性腹泻的弗氏柠檬酸杆菌具有不同的耐药性[19,20]。而在水生动物中,不同鱼类来源的弗氏柠檬酸杆菌的耐药情况也有所不同。大鲵源的int1705与施氏鲟[6]、河蟹[8]、红螯螯虾[9]来源的致病性弗氏柠檬酸杆菌药敏结果存在差异:int1705对新霉素耐药,对多粘菌素B敏感,而来源于施氏鲟的弗氏柠檬酸杆菌对新霉素敏感,对多粘菌素B耐药;来源于河蟹的菌株对四环素耐药,来源于红螯螯虾的菌株对四环素敏感,而int1705对四环素中度敏感。因此在养殖过程中如发生细菌性病害应及时进行病原分离和药敏试验,以筛选出敏感药物有针对性地进行治疗。

