血管生成素2及CD105在急性心肌梗死大鼠中的表达及与梗死面积的关系探讨
临床研究发现,部分心肌梗死病人冠状动脉造影结果不存在明显狭窄(狭窄程度<70%),据此提出冠状动脉微循环障碍是导致心肌缺血、引发心绞痛甚至心肌梗死的重要原因[1]。通过治疗血管新生改善冠状动脉微循环已成为血运重建及药物治疗外的新靶点。相关研究证明,血管生成素(angiopoietin,Ang)家族,尤其血管生成素2(Ang2)、血管生成素1(Ang1)在调节血管成熟稳定与新生方面发挥重要作用[2]。Orlic等[3]通过大鼠实验证明,重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)可动员造血干细胞入血并归巢到梗死区,进而分化为血管内皮细胞等,促进梗死区血管新生,缩小梗死范围,改善梗死后心功能[4],但其促进血管新生机制未明确。本研究通过建立急性心肌梗死大鼠模型,观察急性心肌梗死大鼠梗死边缘区心肌Ang2基因水平变化及新生血管标志物内皮糖蛋白抗体(CD105)基因水平变化,探讨其与急性心肌梗死大鼠梗死面积的关系。
1 材料与方法
1.1 实验动物 健康清洁级 SD大鼠 60只,雄性,体重(220±20)g,6~8周龄。由北京兴旺动物养殖场提供,本实验设计的动物方案经山西医科大学实验动物伦理委员会审核批准。
1.2 实验试剂 rhG-CSF(山东齐鲁制药),10%水合氯醛(山西医科大学第二医院制剂科),氯化三苯基四氮唑(Triphenyltetrazolium chloride,TTC)(SIGMA公司,美国),0.1 mol/L磷酸缓冲盐溶液(山西医科大学第一医院病理科),DEPC、Trizol、Buffer RDD、洗液 DW(生工生物工程,上海)。
1.3 实验分组与处理 将SD大鼠60只随机分为假手术组、急性心肌梗死组(AMI组)和rhG-CSF组,每组20只。rhG-CSF组:结扎左前降支(left anterior descending artery,LAD)建立大鼠AMI模型,造模24 h后,持续5 d给予rhG-CSF腹腔注射[10 μg/(kg·d)];AMI组:开胸结扎LAD建立大鼠AMI模型,造模24 h后,持续5 d给予等量0.9%氯化钠注射液腹腔注射;假手术组:开胸在LAD穿线,但不结扎,术后24 h,持续5 d给予等量 0.9%氯化钠注射液腹腔注射。每组大鼠术后连续3 d给予腹腔注射青霉素1×105U/d。之后每组大鼠再分为7 d组、14 d组,每组10只,分别于术后第7天、第14天麻醉后取心脏,以待检测。
1.3.1 大鼠AMI模型建立 将大鼠采用10%水合氯醛根据3 mL/kg给药麻醉后,仰卧位固定于手术台上,连接生物信号记录系统,记录术前Ⅱ导联心电图。手术部位备皮、消毒、铺无菌洞巾。切开颈部正中皮肤,依次钝性分离筋膜、肌肉,暴露气管环,分离气管环下组织并穿线, 气管3~4环间行气管切开插管,连接动物呼吸机,设定频率 60次/min,吸呼比1∶2,潮气量3 mL/100 g,以大鼠胸廓随呼吸机频率起伏判断气管插管成功。之后于胸骨旁第3~4肋间行2~3 cm纵向切口,依次分离组织,破坏胸膜暴露肺脏后,使用开脸器撑开肋间,以润湿的纱布小心覆盖心脏周围肺组织,小心撕开心包膜,用6-0无损伤缝合线于左心耳与肺动脉圆锥间、距离左心耳尖端2 mm处穿线,进针深度0.5~1 mm并结扎。观察到结扎线下心肌变白,运动减低。心电图Ⅱ导显示J点抬高、QRS波波幅增高,提示模型制作成功。仔细观察无出血后关胸。用2-0缝合线间断缝合肋骨,暂不打为实结,以5 mL注射器抽吸胸腔内空气,胸腔恢复负压后打成实结。之后依次间断缝合肌肉、皮肤,待大鼠出现吞咽动作后,拔除气管插管,使用注射器吸除气管内积血和分泌物,用6-0无损伤缝合线缝合气管,依次缝合肌肉、皮肤。由动物房正常饲养,术毕腹腔注射青霉素1×105U/d,持续3 d[5-7]。
1.3.2 TTC染色法评估心肌梗死面积 于AMI后第7天、第14天水合氯醛麻醉后处死大鼠,取心脏,0.9%氯化钠注射液冲洗干净后于-20 ℃环境中快速冰冻20 min,之后取出心脏,切除心房及右心室后,垂直于心脏长轴,自心尖向心底将心脏切成厚度相近(1~2 mm)的 4~5片。于避光环境下,将切片置于1%的TTC磷酸缓冲液(pH7.4)中,放于 37 ℃恒温水浴箱孵育 30 min。取出标本后观察可见非梗死区心肌呈砖红色,梗死区心肌呈苍白色。计算梗死面积[8-9]。
1.3.3 提取心脏组织 分别于AMI后第7天、第14天将各组大鼠以水合氯醛麻醉后处死,迅速摘取大鼠心脏,并在0 ℃无菌生理盐水内洗去心脏表面和心室内残血,剪取心肌梗死及边缘区心肌组织,并用0 ℃无菌生理盐水反复冲洗。留取梗死及边缘区约5 mm×5 mm×2 mm心肌组织,清晰标记后置于液氮中保存。所有操作在1 min内完成,尽可能减少操作时间对心肌的影响。
1.3.4 逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)法检测Ang2与CD105的表达 -70 ℃冰箱中取出梗死心肌组织,利用Trizol提取总RNA,制成 RNA样品溶液。使用紫外光分光光度仪测定OD260/OD280值。按照第一链 cDNA合成试剂盒(Thermo ScientificTM→EP0733,上海生工)提供的程序步骤合成cDNA,以cDNA为模板,加入底物和设计好的引物进行扩增,最终得到所需目的基因的表达量。Ang2引物序列:5′-TCGGACTCTGTCACAAGCAA-3′/5′-ACAAGACGGAACAACGAACTG-3′;CD105引物序列:5′-ACAGTGACGGTAACGGTGAAA-3′/5′-TCGATGAGCCAGGAGACGTA-3′,以β-actin作为内参,其引物序列:5′-CGTAAAGACCTCTATGCCAACA-3′/5′-AGCCACCAATCCACACAGAG-3′。最后处理数据获得Ang2、CD105的 Ct值,采用2-ΔΔCt表示各样本mRNA的平均水平。

2 结 果
2.1 大鼠AMI前后心电图改变 大鼠动作电位缺乏平台期,因此一般无法观察到明显的S-T段,仅以J点替代S-T段。AMI前 QRS波较窄,J点位于基线位置。结扎LAD后可见Ⅱ导联 QRS波增宽,J点抬高,甚至与 R波融合。详见图1、图2。
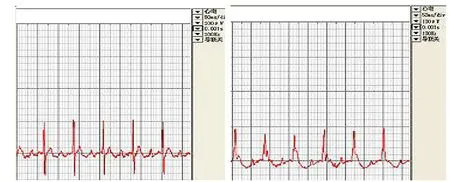
图1 大鼠AMI前心电图 图2 大鼠AMI后心电图
2.2 AMI后心脏形态学改变 观察可见梗死区室壁变薄,局部塌陷,颜色较周边区域相对浅白。经TTC染色后,可见梗死区颜色变白,非缺血区呈砖红色。详见图3。
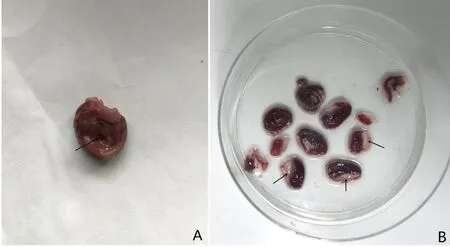
A图箭头所指区域室壁塌陷;B图箭头所指区域为梗死区呈苍白色,非梗死区呈现砖红色
2.3 RNA纯度、浓度及溶解曲线分析 采用紫外分光光度计对 RNA样品纯度进行检测,计算OD260/OD280为1.8~2.0,证明RNA纯度较好并计算得出 RNA浓度,并观察可见其溶解曲线仅有一个高峰,再次证明扩增产物具有较高的特异性。
2.4 各组大鼠心肌Ang2 mRNA表达水平比较 rhG-CSF组和AMI组Ang2基因表达水平心肌梗死后呈逐渐升高趋势,第7天、第14天rhG-CSF组Ang2基因表达水平较同时间AMI组升高(P<0.01),且第14天基因表达水平高于第7天(P<0.01);第7天、第14天rhG-CSF组和AMI组Ang2基因表达水平较假手术组同时间显著升高(P<0.05)。详见图4。
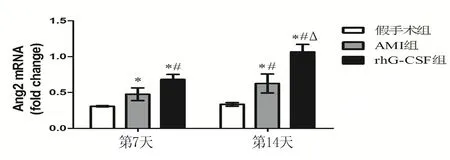
与假手术组比较,*P<0.05;与AMI组同时间比较,#P<0.01;与同组第7天比较,ΔP<0.01
图4各组大鼠心肌Ang2mRNA表达水平比较
2.5 各组大鼠心肌CD105mRNA表达水平比较 第7天、第14天rhG-CSF组 CD105mRNA表达水平较AMI组升高(P<0.01);第7天、第14天rhG-CSF组和AMI组CD105mRNA表达水平较假手术组同时间显著升高(P<0.01)。详见图5。

与假手术组同时间比较,*P<0.01;与AMI组同时间比较,#P<0.01
图5各组大鼠心肌Ang2mRNA表达水平比较
2.6 两组大鼠心肌梗死面积比较 通过TTC染色法评估大鼠心肌梗死面积,与AMI组比较,第7天和第14天rhG-CSF组心肌梗死面积均明显缩小,差异均有统计学意义(P<0.01)。详见图6。
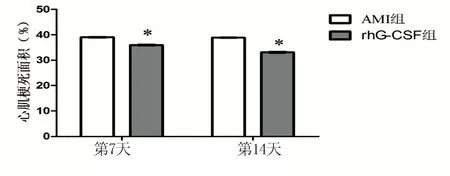
与AMI组同时间比较,*P<0.05
图6两组大鼠心肌梗死面积比较
3 讨 论
近年来人们提出治疗性血管新生概念,即通过外源性给予生长因子、基因转染或干细胞移植等方法促进血管新生,改善心肌微循环。血管生成素家族Ang2在心血管疾病中的作用机制尚不明确。有研究发现,Ang2转基因后观察可见肿瘤组织血管密度增加[10];另有学者利用Ang2抗体有效阻断Ang2与Tie-2的相互作用,导致肿瘤微血管密度减小,肿瘤血管生长受到抑制[11-12]。近期研究表明,Ang2与糖尿病合并大血管病变、冠心病病人侧支循环分级等均有相关性[13-14],外源性给予他汀类药物诱导Ang2过表达后,大鼠新生血管增多[15]。Theelen等[16]发现外源性给予Ang2抗体后可抑制血管新生从而稳定动脉粥样硬化斑块。提示Ang2在心肌微血管的形成中发挥重要作用。
本研究结果显示,与假手术组比较,Ang2 mRNA表达明显升高,说明Ang2与大鼠AMI有关;且第14天基因表达水平高于第7天,说明Ang2表达水平随时间增加而增加,这与Shyu等[17]发现相似。由于本实验仅设置两个时间点,因此不能确定Ang2 mRNA表达的高峰时间及随时间的变化。
相关研究发现,利用 rhG-CSF动员干祖细胞,可使大量干祖细胞入血,并向梗死区归巢,从而分化为心肌样细胞和血管内皮细胞, 改善心功能,促进血管新生,减少心脏重塑[18-19]。本研究发现外源性给予rhG-CSF后Ang2 mRNA表达较同时间AMI组明显升高,而梗死面积较同时间AMI组缩小,进一步说明Ang2与大鼠AMI后梗死面积减小有关。
相较于CD34等传统的泛血管标记物,CD105仅与处于增殖状态的内皮细胞结合,而与非新生血管内皮不结合,因此能较好地区分新生血管与非新生血管,具有较高的特异性[20]。本研究结果发现,心肌梗死后CD105mRNA表达较假手术组明显增加,说明CD105与大鼠AMI有关。外源性给予rhG-CSF后CD105mRNA较同时间AMI组明显增加,梗死面积进一步减小,提示血管新生可能参与梗死面积减小的过程。Ang2与CD105在心肌梗死中的相关性有待于深入研究证实,而CD105mRNA与Ang2 mRNA表达的非线性关系说明血管新生是一个复杂过程,并非 Ang 2独立作用结果,提示今后的血管新生研究中将多个因子结合。

