人防御素HD-5在胃癌发生发展中的作用研究
尚晓宇 顾国威 柳国权 齐靖 解强 李坤
2018年中国胃癌新发病例45.6万人,占所有新发肿瘤病例的10.6%,仅次于肺癌,排名第2位[1,2]。目前针对胃癌治疗仍然缺少有效手段,其5年生存率不足50%,严重威胁我国人民的健康[1-3]。
防御素是普遍存在的一类带有正电荷的小分子多肽,具有抗菌、抗病毒、免疫调节的作用[4]。在哺乳动物细胞中主要由特定的白细胞和上皮细胞表达分泌。人防御素根据结构和分泌细胞的不同分为α和β两个家族,其中α-防御素包括人中性粒细胞防御肽1-4(Human neutrophil peptide,HNP1-4),人防御素5和6(humandefensin5and6,HD-5,HD-6),β-防御素(human β defensin,HBD)包括HBD1-6[5-7]。在不同的肿瘤组织中已经观察到防御素的异常表达,例如HNP1-3在包括肺癌、肾癌、膀胱癌、T细胞淋巴瘤等不同的肿瘤组织中高表达;HD-6 在结肠癌组织中高表达[8,9]。而HBD-1在包括前列腺癌、肾癌、结肠癌在内的多种肿瘤组织中低表达,在肿瘤发生过程中行使肿瘤抑制因子功能[9]。此外,防御素的异常表达与肿瘤免疫密切相关。研究发现,在某些类型的肿瘤中,防御素表达缺失与肿瘤浸润减少具有相关性,表达HBD2的溶瘤病毒能够募集更多的免疫细胞到肿瘤部位,从而增强肿瘤抑制效果[10]。笔者前期检索The Cancer Genome Atlas(TCGA)数据库发现 α-防御素家族成员HD-5在胃癌中表达量较癌旁组织显著降低。目前其低表达与免疫细胞的浸润减少存在相关性,且防御素在胃癌发生发展中的作用研究较少。因此本研究通过免疫组化、实时荧光定量PCR、细胞迁移、裸鼠成瘤等手段初步探讨HD-5的表达与胃癌发生发展的关系,以期为胃癌的治疗提供分子生物学依据,并指导胃癌治疗的预后。
1 材料与方法
1.1 材料与试剂
人胚肾细胞HEK293T和人胃腺癌细胞AGS购自中国协和医科大学细胞资源中心。DMEM培养基(Gibco,C11965500BT)、RPMI1640培养基(货号:C11875500BT)、胎牛血清(货号:10099-141)、青链霉素(货号:15070063)、谷氨酰胺(货号:15140-122)、CCK8细胞增殖检测试剂盒(货号:C35006)、RIPA裂解液(货号:R0278)、抗HA抗体(货号:26183)、Trizol(货号:15596018)、逆转录试剂盒(货号:K1651)均购自美国Thermofisher公司。Transwell小室(货号:3422)购自美国康宁公司。抗β-actin(货号:A1978)抗体购自美国Sigma公司。SPF级BALB/c裸鼠(雌性,6-8周龄)购自北京维通利华实验动物技术有限公司。
1.2 人肿瘤样品的采集
筛选广州市番禺区中心医院接受手术切除治疗的胃腺癌患者24例,手术切除胃癌组织样本和距离癌组织3~5厘米处的癌旁组织,立即放于组织冻存液中,液氮速冻后置于-80℃条件下存储。本研究肿瘤样本的使用已得到医院人类研究伦理委员会(番医伦审批[2019]36号)批准,所有参与者均知情并同意。
1.3 荧光定量PCR
Trizol法提取癌组织和癌旁组织中的总RNA,用逆转录试剂盒将mRNA反转录合成cDNA。PCR 引物序列如下:GAPDH:正义,5′-ACCCAGAAGACTGTGGATGG-3′;反 义 ,5′-TCAGCTCAGGGATGACCTTG-3′;HD5:正义,5′-CCTCAGGTTCTCAGGCAAGA-3′;反义,5′-GGCCACTGATTTCACACACC-3′。PCR反应条件为:94℃预变性 3 min,94℃变性 30 s,60℃退火 20 s,72℃延伸20 s,共40个循环;72℃终延伸5 min,进行熔解曲线分析以确认产物的特异性,4℃维持至结束。GAPDH作为正常化的内部对照,用2ΔΔCt法计算分析基因的相对表达水平。
1.4 免疫组化
石蜡包埋组织标本经常规脱蜡及梯度酒精水处理。利用罗氏Ventana自动免疫组化仪进行抗原修复、HD-5抗体标记及DAB染色。经脱水、透明、封片后,镜检观察。
1.5 细胞培养
HEK293T在DMEM培养基中培养,AGS在RPMI 1640培养基中培养。所有培养基均补充有10%胎牛血清,1%青霉素-链霉素,将细胞培养在有5%CO2的37℃培养箱中。
1.6 HD-5稳定表达细胞系的构建及检测
克隆人HD-5的蛋白质编码序列到慢病毒载体PCDH上,将上述构建好的慢病毒载体连同包装质粒(psPAX和PMD2.G)共转染HEK293T细胞系。转染48 h后收集细胞培养上清液过滤后侵染AGS细胞,48 h后加入嘌呤霉素筛选得到HD-5稳定表达细胞系。收集细胞,用免疫印迹法检测外源蛋白表达。
1.7 CCK8检测细胞增殖能力
取对数生长期且稳定表达HA-Vec和HA-HD-5的AGS细胞接种于96孔板中,每孔接种5 000个细胞,将96孔板在培养箱中培养过夜,每组设置5个平行。分别于1、2、3、4 d后于每孔中加入CCK8溶液(每孔100 μL加入10 μL)。以加入相应量的细胞培养物和CCK8,但未加入细胞的孔作为空白对照。在37度孵育1 h后,用酶标仪测定450 nm处的吸光值(OD)。
1.8 Transwell细胞迁移实验
将Transwell小室置于24孔板中,下室加入500 μL含10%胎牛血清的RPMI 1640高糖培养基。将稳定表达HA-vec和HA-HD-5的AGS细胞以每孔1×105个接种于Transwell小室的上室。培养24 h后,取出各组小室,用棉签沾取PBS后轻轻擦拭小室膜的上层以去除未穿膜的细胞,用4%多聚甲醛固定及0.1%结晶紫染色,于100倍正置显微镜下随机选取5个视野拍照计数。
1.9 裸鼠成瘤实验
将无血清培养基混悬的肿瘤细胞悬液0.1 mL(含细胞数1.0×107,50%Matrigel)注射于每只小鼠左右两侧腋下皮下部位。肿瘤细胞接种后,以游标卡尺测量肿瘤长径L和短径W,计算肿瘤体积(Tumor Volume,TV),计算公式为:TV=0.5×L×W2。实验结束时,分离肿瘤组织并用数码相机进行拍照。
1.10 统计学分析
本研究采用SPSS 15.0软件对各比较组进行T检验统计学分析,数据结果以均数±标准差()表示。*P<0.05差异时有统计学意义。
2 结果
2.1 qPCR检测胃癌组织中HD-5表达
使用实时荧光定量PCR对手术切除的胃癌组织和癌旁组织样本进行检测,结果显示,与癌旁组织相比,胃癌组织中HD-5蛋白的表达水平显著降低,平均含量仅为癌旁组织的50%(癌组织:1.583+0.176 6,N=24,癌旁组织:3.613+0.184 8,N=24),差异有统计学意义(P<0.05)。
2.2 免疫组化检测胃癌组织中的HD-5蛋白表达
通过免疫组化技术检测手术切除的胃癌组织和癌旁组织中HD-5蛋白的表达变化,检测结果显示HD-5蛋白在癌组织中的表达显著低于癌旁组织(P<0.05)。见图1。
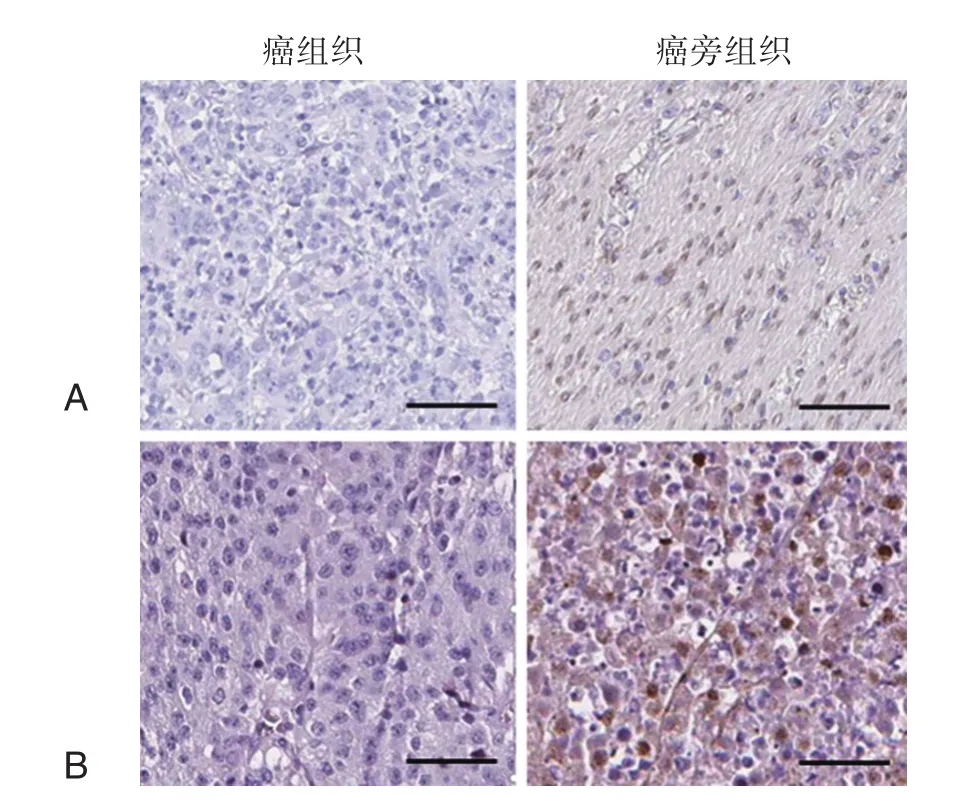
图1 免疫组化检测HD-5在癌组织和癌旁组织中的表达Figure1 Immunohistochemical detection of HD-5 in cancerous and adjacent tissue
2.3 HD-5过表达对胃癌细胞系构建
在胃癌细胞系AGS中通过转染技术过表达HD-5构建稳定高表达细胞系,免疫印迹检测确定外源转染的HD-5基因在AGS细胞中稳定高表达。见图2。
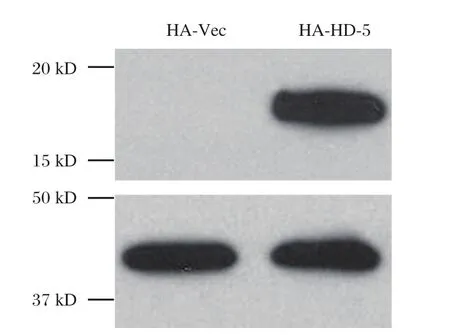
图2 免疫印迹检测在AGS细胞中过表达的外源HD-5Figure2 Western blot detection of exogenous HD-5 expression
2.4 HD-5过表达抑制胃癌细胞增殖
采用CCK8方法检测细胞增殖能力,结果显示HD-5过表达能够抑制胃癌细胞AGS的增殖能力,差异具有统计学意义(P<0.05)。见图3。
2.5 HD-5过表达抑制胃癌细胞迁移
HD-5过表达能够抑制AGS细胞系的迁移能力,HD-5过表达组平均每个视野迁移细胞数目比对照组少约30个细胞,差异具有统计学意义(P<0.05)。见图4。
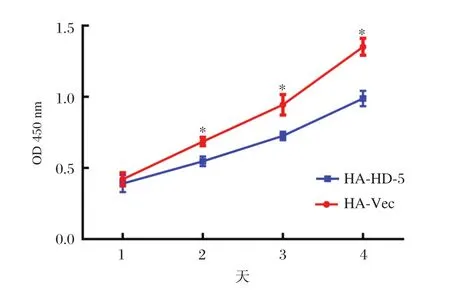
图3 CCK8检测高表达HD-5的AGS细胞的增殖能力Figure3 CCK8 detection of HD-5 overexpressed AGS cell proliferation
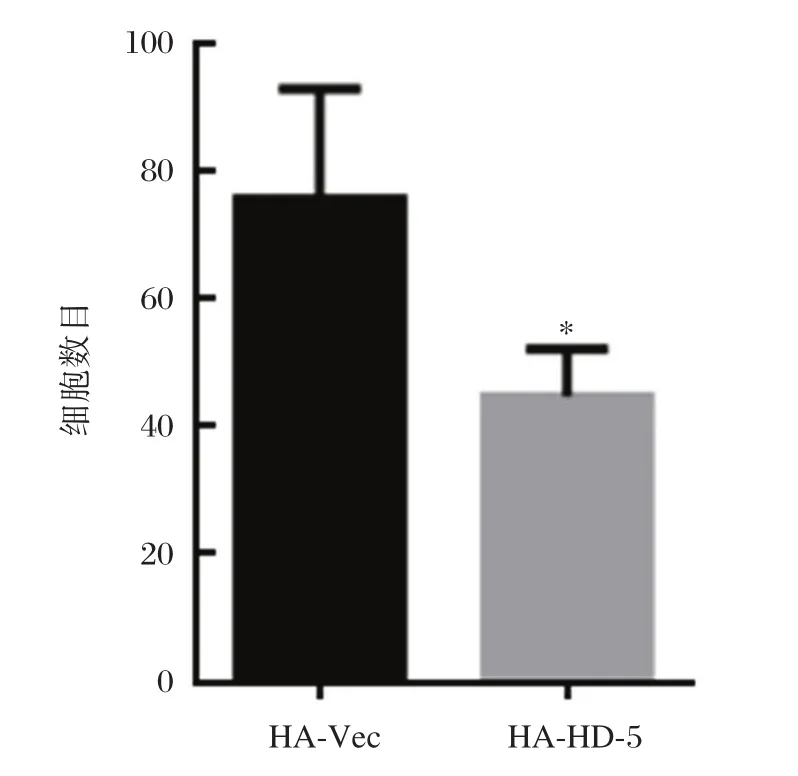
图4 对照细胞和HD-5高表达AGS细胞的迁移能力比较Figure4 Comparison of cell migration between control and HD-5 overexpressed AGS cell
2.6 HD-5对裸鼠成瘤的影响
实验结果显示,与对照细胞相比,HD-5高表达的AGS细胞在裸鼠体内生长速度明显变慢,第20天肿瘤体积约为500 mm3,仅为对照组体积的四分之一,差异具有统计学意义(P<0.05),见图5。
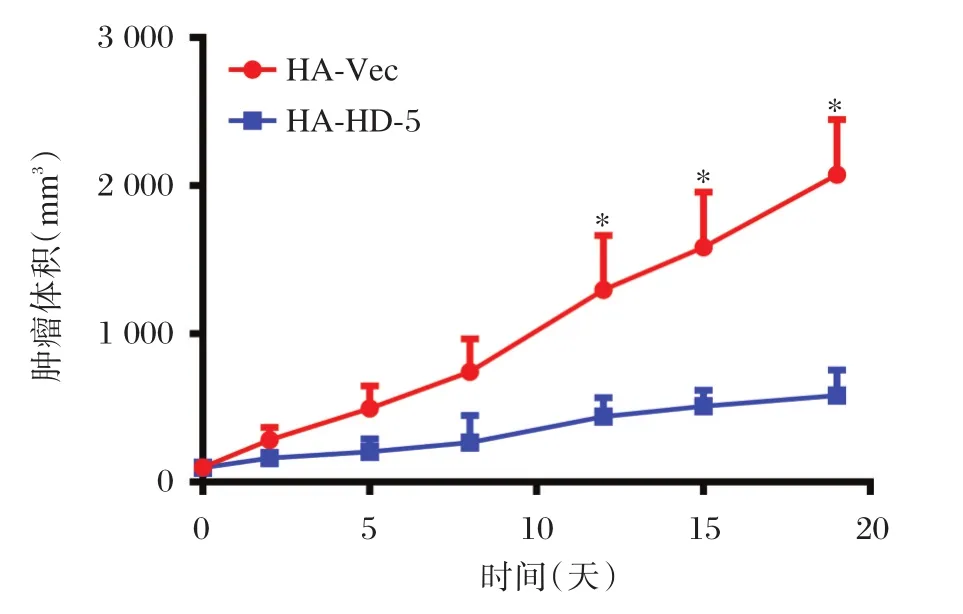
图5 HD-5过表达抑制AGS细胞在裸鼠皮下的生长速度(*P<0.05)Figure5 Comparison of tumor growth by xenograft model(*P<0.05)
3 讨论
近年来肿瘤的治疗进展迅速,但针对胃癌靶向治疗药物的研发进程缓慢,其主要原因为胃癌的发生发展机制不明确。目前临床主要采用手术切除结合放化疗的标准疗法[3,11]。防御素作为广泛参与生物体的先天免疫和获得性免疫的关键分子,与肿瘤的发生发展以及肿瘤免疫密切相关[6]。2001年,刘文超等人研究发现,中性粒细胞中提取的防御素对胃癌细胞具有良好的杀伤作用,但该研究并未明确防御素的种类[14]。2005年,Nomura等首次发现HD-5在部分胃癌细胞中表达缺失,提示其可能与胃癌的发生有关系[12]。2013年,Inada等首次报道了HD-5有可能通过下调E-cadherin表达抑制食管鳞癌细胞的生长,明确HD-5可能行使类似肿瘤抑制因子的功能[13]。笔者通过肿瘤样本的公开测序数据库挖掘分析也发现,HD-5在胃癌组织中表达缺失,这与2005年Nomura等发现一致。基于此,笔者设计一系列体内外实验,以深入研究HD-5在胃癌发生发展中的可能机制。
本研究中首次在临床样本中比较了人防御素HD-5在胃癌组织和癌旁组织中的表达差异,证实了HD-5在癌组织中低表达,对胃癌细胞的增殖、迁移、体内裸鼠成瘤有抑制作用,是一个潜在的肿瘤抑制因子,其缺失与胃癌的发生发展密切相关。
以往研究发现,防御素可通过其细胞毒作用直接接触破坏细胞膜结构,或者通过与细胞骨架蛋白结合诱导细胞发生凋亡[6,7]。此外,防御素除直接抑制肿瘤的细胞增殖外,还能通过募集免疫细胞改变肿瘤的免疫微环境,进而抑制肿瘤的生长,例如树突状细胞(Dendritic cells,DC)等[6,14]。HD-5在胃癌组织中缺失很有可能导致抑制性肿瘤免疫微环境的改变,进而导致肿瘤的快速增殖。已有报道证实,防御肽肿瘤中的高表达能够促进肿瘤内部免疫细胞浸润和肿瘤免疫治疗的活性。因此,HD-5对胃癌的抑制作用,一方面可能通过细胞毒类效果抑制细胞增殖和迁移,另一方面也可能是通过改变肿瘤免疫微环境实现。本研究进行的采用免疫缺陷小鼠观察到的肿瘤抑制效果也从体内裸鼠成瘤实验侧面印证了HD-5的细胞毒类作用机制。本研究对HD-5在肿瘤免疫微环境中的调节作用并未探讨,未来研究中拟采用正常小鼠建立鼠源肿瘤模型,进一步验证HD-5在肿瘤免疫中的作用,尤其是与现有的免疫检查点抑制剂类药物(如PD-1/PD-L1抗体药物)、自然杀伤细胞(naturalkillercell,NK)和 CAR-T(Chimeric Antigen Receptor T-cell Immunotherapy)等新型治疗方法的相互作用机制。防御素能否增强这类药物治疗效果将是下一步研究重点。综上,本研究首次证实了HD-5在胃癌发生发展中的作用,为防御素参与肿瘤调控提供了初步证据,为改善胃癌的治疗以及提高肿瘤免疫疗法效果提供了依据。

