核桃茎段器官离体再生培养
陈晓明,韦璐阳,蔡 玲,梁文汇,贺佳君,陈代喜
(1.广西壮族自治区林业科学研究院 国家林业和草原局中南速生材繁育实验室 广西优良用材林资源培育重点实验室,南宁 530002;2.广西亚热带作物研究所,南宁530001;3.广西凤山县水果生产管理局,凤山 547600)
中国是核桃(Juglans regia)栽培起源地之一,在我国已有2000多年的人工栽培历史。虽然核桃起源于北温带地区,但对气候适应性强,在我国亚热带和热带地区的27个省、市、自治区均有广泛分布和大面积栽培,是我国重要的阔叶经济木本树种之一[1-2]。核桃营养丰富,富含人体所需的18种氨基酸、有益脂肪酸、多种矿质营养、维生素和丰富的卵磷脂[3]。当前,全国各地大力发展核桃产业,然而大规模栽培核桃,培养大量具有优良性状的种苗是前提。在长期栽培和人为选择过程中,我们获得了很多核桃优良品种和类型,但是不完善的繁殖技术阻碍了核桃优良品种的推广。传统的核桃苗木繁殖,一般采用嫁接的方法,存在繁殖系数低、速度慢、成活率不稳定、受穗条数量限制等不利因素[4]。应用组织培养技术,核桃组培苗遗传稳定性好,生产周期大大缩短,为核桃的良种苗木规模化生产提供巨大的潜力。近年来,虽然有用核桃茎段进行离体快繁技术的研究,但不同的核桃品种需要的营养和植物激素的浓度均有较大差异[5-10]。本研究通过对核桃组培系列技术中的营养元素与植物生长激素的调节,建立本地核桃优良品种“凤优1号”高效、可靠的核桃茎段离体快繁体系,为大规模良种繁殖奠定基础。
1 材料与方法
1.1 材料
2013年9月在广西河池凤山县金牙乡坡茶村“凤优1号”10~15年生的核桃林中进行优株选择,选择年均产干果5 kg以上的健康成年树为优良单株,11月对优良单株进行肥水管理,每株施氮磷钾含量各为15%的复合肥1 kg,促进树体生长。枝条在翌年的2月份开始萌动生长。分别在3月、4月和5月采集优株树冠中上部外围健壮的当年生枝条,枝条采集后放保温箱冷冻保鲜、保湿,带回实验室备用。
1.2 外植体灭菌
用50%多菌灵可湿性粉剂1 000倍浸泡茎段2 h,初步灭菌,然后用10%(V/V)表面活性剂吐温-80浸泡30 min,用无菌蒸馏水洗涤,再用0.1%(W/V)氯化汞溶液处理8~13 min,最后用无菌蒸馏水洗涤5次,用无菌滤纸吸干水分后,接种到DKW+0.5 g/L硫代硫酸钠培养基中。每个处理接种60个外植体,培养15 d后观察无菌活体得率。
1.3 初代培养
以DKW为基本培养基,细胞分裂素6-BA的浓度分别为0.5、1和2 mg/L,各处理均添加0.05 mg/L IBA、3%蔗糖和4.5 g/L琼脂,选取灭菌14 d后无菌活体接种到以上各处理中,每处理接种10瓶,每瓶1个茎段,3次重复。于1 500 lx光照下培养,肉眼观察到分化生长的芽时定为外植体始芽萌动,30 d进行诱导率的统计。
1.4 增殖培养
选择6-BA、IBA和基本培养基为试验因素,试验用L9(34)正交表试验设计,6-BA的试验水平为0.2、0.5、1.0 mg/L;IBA的试验水平为0.05、0.1、0.2 mg/L;基本培养基的3个试验水平为MS、DKW、SH。共设计9个处理,每处理接种无菌芽5颗,3次重复,于2 000 lx光照下培养,30 d统计各处理的增殖率,以有一片展开小叶的小芽为统计对象。芽增殖系数=增殖后芽总数/接种芽数。
1.5 离体生根
以1/2 SH+2%蔗糖+5.0 g/L琼脂+0~10mg/L IBA为生根培养基,每处理接种10瓶,每瓶3个单芽,共进行3次重复。先在室内自然光照条件下培养7 d,然后在室内2 000 lx的光照条件下培养28 d。
1.6 培养条件
所有培养基均添加0.5 g/L硫代硫酸钠,以减轻褐化对核桃生长的影响。除了初代培养和生根培养前7 d外,其余的均在16/8 h(光/暗)光周期、光照强度2 000 lx(LED光源)、室温(25±2)℃的环境条件下进行培养。
1.7 统计分析
定期记录芽再生率、芽增殖率、茎长和生根情况,数据处理和图表制作采用Excel 2007完成,用DPS软件进行方差分析。
2 结果与分析
2.1 采集和消毒时间对外植体灭菌效果的影响
采用0.1%HgCl2分别对3、4和5月份采集的外植体进行表面灭菌处理,3个月份的外植体均随着处理时间的延长,污染率呈下降的趋势(表1)。从无菌褐死数来看,延长消毒时间虽然污染率降低,但无菌褐死数增加。因此,外植体的灭菌效果需要综合考虑污染率和无菌褐死数,污染率低、无菌褐死数也低才为最佳的消毒方案。3月和4月份采集的外植体,当0.1%HgCl2处理时间为10 min时灭菌效果最佳,无菌活体得率分别为36.0%和34.0%,显著高于其它2个灭菌时间的处理。5月份采集的外植体灭菌时间在10 min和13 min的效果差异不显著,无菌活体得率均为28.33%。从同一灭菌时间看,不同月份外植体的污染率和无菌褐死数均不同,随着采集月份的增加,灭菌效果变差,但无菌褐死数降低。
2.2 细胞分裂素6-BA对外植体始芽诱导的影响
细胞分裂素6-BA对茎段初始芽的诱导有显著的作用[7,9]。细胞分裂素6-BA对核桃腋芽诱导有较大影响,3月份采集的外植体当6-BA浓度增加到1.0 mg/L时,腋芽诱导率为40.21%(表2)。4月和5月份采集的外植体,6-BA浓度为0.5 mg/L时,诱导率分别为40.12%、50.33%;6-BA浓度增加到1.0 mg/L时,诱导率与6-BA浓度为2.0 mg/L时的差异不显著;诱导的腋芽在含6-BA 1.0 mg/L的诱导培养基中生长健壮、叶色浓绿,没有出现玻璃化现象,6-BA浓度为2.0 mg/L时,腋芽相对于1.0 mg/L表现出芽段粗,一半腋芽呈玻璃化状态。3月份采集的外植体在2.0 mg/L的浓度时同样出现玻璃化现象。由此可知,核桃茎段外植体始芽诱导需要一定浓度的6-BA诱导才能获得理想的腋芽。本试验条件下的6-BA浓度为1.0 mg/L时,可得到较高质量的始芽进行下一步的继代培养。
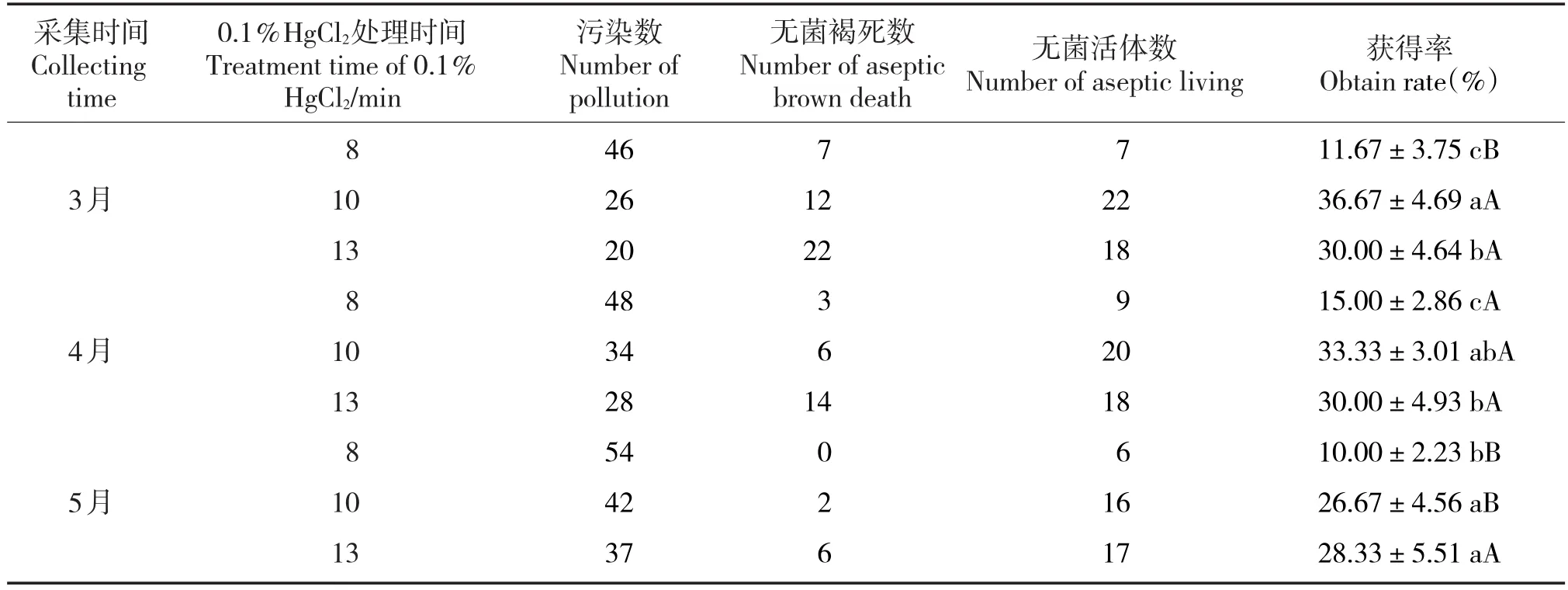
表1 外植体表面灭菌效果Tab.1 Effects of surface sterilization of explants

表2 细胞分裂素6-BA对外植体初始不定芽诱导和生长的影响Tab.2 Effects of 6-BA on induction and growth of initial adventitious shoots in explants
2.3 基本培养基和激素配比对核桃不定芽增殖的影响
以3种不同基本培养基与不同浓度细胞分裂素6-BA和生长素IBA配合使用,研究核桃丛生芽诱导的最佳配方。通过对正交设计的直观分析发现,不同的基本培养基和不同的植物生长调节和浓度影响核桃增殖的主次不一。根据极差的数值可知(表4),影响核桃不定芽增殖的主要因素是基本培养基,其次是细胞分裂素6-BA,生长素IBA的影响最小。通过对比T值的大小,可得到各因素的较优水平,在基本培养基中以SH为较优水平,6-BA浓度的较优水平为0.5 mg/L,IBA的较优水平是0.1 mg/L。因此,核桃增殖培养的最佳培养基为SH+6-BA 0.5 mg/L+IBA 0.1 mg/L。表中处理5正好出现了这一组合,其增殖系数为4.32,显著高于其它处理。
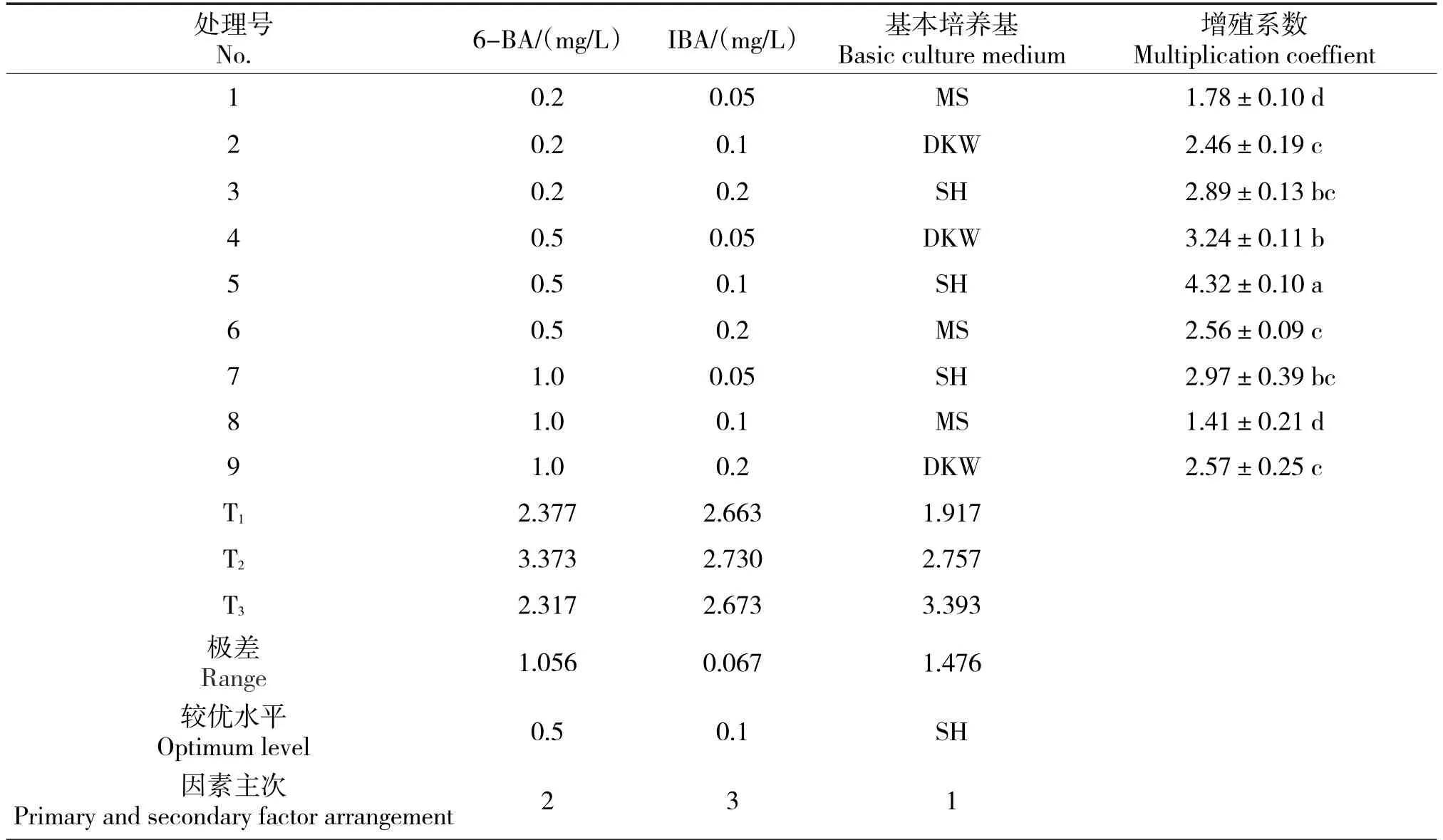
表3 正交L9(34)试验安排及结果分析表Tab.3 Orthogonal L9 (34) experimental arrangement and results analysis
2.4 IBA对核桃不定根诱导的影响
生根试验以1/2 SH为基本培养基,研究不同浓度IBA对核桃组培苗生根的影响(表4)。没有IBA或低水平的IBA浓度(2 mg/L)均不能诱导生根,当IBA的浓度增加为5.0 mg/L时,12 d后开始观察到少部分芽基部露出白色根点,但生根率较低,只有23.57%,且生根的植株一般只有一条根,根较细长,无愈伤组织出现。当IBA浓度增加到8.0 mg/L时,生根率增加到63.18%,每株小苗长2~3条根,根较5.0 mg/L的粗大,开始有少量愈伤组织。IBA浓度加大到10.0 mg/L时,生根率为65.24%,与8.0 mg/L的没有明显差异,生根率并没有随着生长素浓度加大而明显增加,而且基部长满愈伤组织。以上分析表明,在1/2 SH培养基中添加8.0 mg/LIBA,生根效果最佳。

表4 不同浓度IBA对核桃不定根诱导的影响Tab.4 Effects of different concentrations of IBA on adventitious root induction of Juglans regia
3 结论与讨论
外植体灭菌是植物组织培养的关键环节,无菌活体的得率直接影响到离体培养的进程,高比例无菌活体的获得主要取决于较低污染率和褐死率。因此,合适的灭菌时间是高无菌活体获得率的关键条件。本研究对3个月份采集的外植体进行灭菌处理,获得的最佳的灭菌时间为10 min。刘昊等[6]用0.1%升汞处理“强旱”核桃茎段的最佳灭菌时间为10 min,污染率与本试验相当。不同木质化程度的茎段材料,其萌芽率和褐化率均有差异,在广西的气候条件下,4—5月份的当年生嫩枝已经出现了半木质化,试验结果表明,半木质化茎段的外植体萌芽率和褐化率均优于3月份未木质化外植体,张小红等[11]和牛青等[12]也认为半木质化茎段其褐化率和萌发率均优于未木质化嫩茎,与本研究结论一致。本研究用同样的灭菌方法,半木质化茎段的灭菌效果显著低于未木质化嫩茎,这是由于半木质化茎段在野外生长时间相对较长,附着在表面的污染物相对较多造成。为了降低污染率,有学者提出将所需品种进行嫁接后,移入温室培养相对干净的枝条,当达到半木质化程度后取茎段进行灭菌处理[13]。应用此方法是否能有效控制外植体污染,有待下一步的验证。同时,核桃茎段富含酚类物质,对外植体进行切割时从伤口分泌出的酚类物质氧化成醌,使培养物褐化,进而破坏培养物的正常分化和生长[14],有研究表明0.5~1.0 g/L硫代硫酸钠对抑制茎段外植体褐化效果最好[5,10]。因此本研究所有培养基均添加0.5 g/L硫代硫酸钠以减轻褐化对核桃生长的影响。大多数核桃组培研究的结果表明,DKW是最适合核桃组培的基本培养基[6,9,15-16],本研究的结果显示,SH在凤优1号的表现优于DKW或MS。牛青等[12]用MS为基本培养基在金薄香核桃茎段培养中效果最佳,李建军等[17]也认为MS基本培养基适合用于美国黑核桃的组培培养。表明不同的核桃品种其营养需求有较大差异。细胞分裂素激活外植体节部的腋芽,当6-BA浓度为1.0 mg/L时,可得到较高质量的始芽进行下一步的继代培养。这可能是适宜的6-BA浓度提高了某些转化酶(如SOD、POD、CAT等)的活性,从而促进培养物的生长[7]。本研究还试验了不同6-BA浓度对芽增殖的影响,在一定浓度范围内,节间分生组织的芽增殖系数随细胞分裂素浓度的增加而增加。很多核桃在芽增殖过程中对6-BA表现出良好的反应。刘昊等[6]用6-BA 1.0 mg/L取得较好增殖效果,苗玉青等[9]用6-BA 1.0 mg/L配合1.0 mg/L IBA,增殖倍数达到4.4倍,且苗木生长状况良好。本研究以SH为基本培养基,0.5 mg/L 6-BA配合0.1 mg/L IBA,增殖倍数也能达到4.32倍。
核桃是一种难生根植物[18],除了奇异核桃的生根率较高外,其他种类的核桃生根率一直较低而且不稳定[8]。苗玉青等[9]的“温18”薄皮核桃品种的生根试验表明,生根效果最优的是1/2 DKW添加5.0 mg/L IBA,生根率虽然可高达73.3%,但根系愈伤化严重且畸形,这种生根苗移栽基本不能成活。裴东等[19]认为IBA是较适合诱导核桃组培苗生根的生长素,外源IBA均可诱导核桃嫩茎的内源IAA和ABA升高,从而改变嫩茎内源激素平衡状况,进而促进不定根的发生。本研究中诱导生根最佳的IBA浓度为8.0 mg/L,生根率为63%以上,每株小苗能长2~3条根。

