Wnt/β-catenin与BMP-2/Smads信号通路及其相互作用对骨质疏松疾病的影响
浙江中医药大学第三临床医学院 杭 州 3 10053
骨质疏松症(osteoporosis,OP)随着人口老龄化而增加,其特征是骨量减少和骨组织的微结构恶化,导致骨骼脆性和骨折[1]。当骨形成和骨吸收之间存在不平衡时,骨代谢疾病就会发生。当今,OP已成为全球范围内的严重问题。在中国,老年人OP的平均患病率约为15.7%,并且OP人数随着总人口增加和人口老龄化而逐渐增加[2]。正因为如此,中国OP的人口将从1997年的8390万急剧增加到2050年的2.12亿[3]。因此,寻求一种有效的OP治疗方式已迫在眉睫。相关研究表明,Wnt/β-连环蛋白信号通路在器官和组织的早期发育中起中心作用,在生理和病理条件下都具有骨重建的潜在作用[4]。骨形态发生蛋白(bone morphogenetic protein,BMP)/Smads信号通路在骨骼发育和修复过程中至关重要,并且BMPs的异位给药被用于增强人类局部骨再生[5]。Wnt/β-catenin与BMP-2/Smads可共同调节成骨,也可以在路径激活到生物学效应的不同阶段相互调节。针对两条信号通路的骨质疏松药物的研究也取得了一定进展。本文将简要总结Wnt/β-catenin与BMP-2/Smads信号通路各位点及其相互作用对OP疾病影响的研究进展,旨在为临床治疗OP提供新思路。
1 Wnt/β-catenin信号通路与骨质疏松相关疾病
1.1Wnt/β-catenin信号传导通路 在细胞水平上,Wnt激活几个信号级联反应,包括最常研究的经典路径,即Wnt/β-catenin信号通路[6]。当Wnt蛋白结合受体复合物时,该途径被激活,该受体复合物包括细胞膜受体卷曲蛋白(Frizzled,Frz)家族的7个跨膜受体和低密度脂蛋白受体相关蛋白5/6(low-density lipoprotein receptor related protein 5/6,LRP5/6)[7]。该复合体将糖原合成激酶-3β(glycogen synthase kinase 3β,GSK3β)和酪蛋白激酶(casein kinase 1,CK1)动员到膜上,在那里它们使Lrp5/6上的丝氨酸磷酸化,促进信号体的形成,并且招募蓬乱蛋白(dishevelled,Dvl),支架蛋白(axisinhibition,Axin)和腺瘤息肉蛋白(adenomatous polyposis Coli,APC)[8]。这将导致 β-连环蛋白(β-catenin)释放,增加其水平,激活的β-catenin转移到核内,从而使胞内的β-catenin浓度升高,进入细胞核内与T细胞因子(T cell factor,TCF)/淋巴样增强因子(lymphoid enhancer,LEF)相互作用(见图1A)。在没有上游Wnt信号的情况下,GSK3β磷酸化β-catenin氨基末端附近的残基,靶向β-catenin,用于泛素化途径水解,使胞质和胞核中的β-catenin维持在较低水平[9](见图1B)。Dkk1是一种特性良好的分泌型Wnt抑制剂,在许多组织中都具有活性[10]。临床及实验数据表明,Dkk1抑制Wnt信号传导进而抑制骨形成[11]。Dkk1一方面可竞争性抑制Wnt配体和LRP5/6受体,另一方面Dkk1能与LRP5/6、Kremen1/2形成三聚体,通过诱导快速的细胞内吞,从而减少细胞膜上的LRP5/6,以此阻断Wnt信号向胞内传递[12](见图1C)。
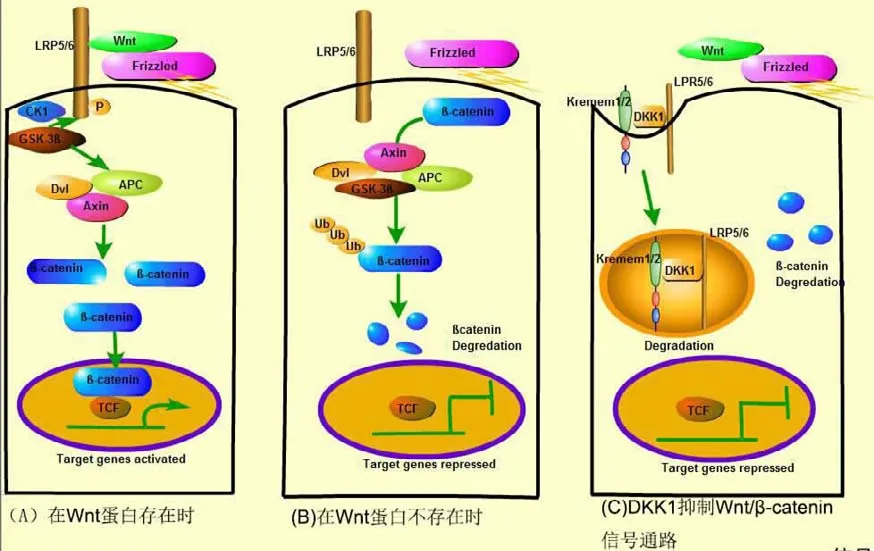
图1 经典Wnt信号通路模型示意图
1.2Wnt/β-catenin经典信号通路与骨质疏松相关疾病的关系 Wnt信号通路因其在骨骼发育、骨量维持和再生医学治疗潜力等方面的重要性而成为骨生物学实验室研究的热点[11]。在骨骼发育过程中,Wnt信号参与近端-远端生长和背腹侧肢体模式,随后参与软骨、成骨、肌肉和脂肪形成,在MSC谱系承诺和进展中起着关键作用,Wnt信号因此影响骨骼发育的各个方面,包括颅面、肢体和关节的形成[4]。例如,Lrp5和Lrp6在复合突变小鼠中的表达减少,导致肢体缺损[4]。成骨成熟阶段开始清除Wnt蛋白分泌所需的一种伴侣蛋白wntless,可导致由骨形成受损和骨吸收增加引起的严重骨质疏松症小鼠,且这种骨质疏松表型非常严重[4]。β-catenin是由细胞质和核蛋白编码的Ctnnb1基因,它是Wnt/β-catenin信号级联中的关键环节。高水平的持续活跃的β-catenin抑制成熟破骨细胞和骨吸收,导致骨硬化病[13]。同时,阻断Wnt/βcatenin信号途径触发成脂分化的启动[14]。因此,Wnt/β-catenin信号通路的激发可以促进成骨分化并抑制成脂分化,上述机制共同导致成骨的增加。
Wnt/β-catenin信号通路中的关键信号分子对骨质疏松症有不同程度的影响。研究报告称,LRP5基因敲除小鼠脊柱小梁骨的骨密度降低、骨质疏松导致胫骨骨折[15]。然而,由β-catenin基因敲除引起的Wnt信号通路的抑制将影响骨形成,并导致严重的骨量丢失[11]。Hill等[16]研究表明,通过条件性地敲除肢体和头部中间体中的β-catenin,显示成骨细胞谱系分化需要β-catenin,缺乏β-catenin的成骨细胞前体在分化中被阻断并发育成软骨细胞。Hill等[16]通过体内和体外损失和功能获得分析表明,β-catenin活性是必要的,足以抑制间充质细胞分化为Runx2和Sox9阳性骨骼前体。因此,经典的Wnt/β-catenin信号传导对于骨骼谱系分化至关重要,可防止成骨细胞转分化为软骨细胞。
Dkk1是Wnt/β-catenin信号通路中的关键信号分子特异性抑制剂,对骨质疏松症有很强的治疗作用。研究表明,针对性的Dkk1疗法可以增加绝经后或老年骨质疏松症、骨发育不良或癌症引起的骨量流失[17],Dkk1反义寡核苷酸可以增加去卵巢大鼠的成骨细胞数量,减少核因子RANKL的表达,减少破骨细胞的出现,股骨的骨矿物质含量和骨密度得到提高[18]。在研究Dkk1转基因的小鼠中,发现Dkk1的高表达会导致严重的OP,并且降低成骨细胞的数量。相反,相比之下,Dkk1敲除小鼠显示增加骨量和骨质量[18]。这些结果表明Wnt/β-catenin信号通路中的负调控信号分子可能是治疗OP的药物靶点,并成为药物治疗OP的手段之一。
2 BMP-2/Smads信号通路与骨质疏松相关疾病
2.1BMP-2/Smads信号传导通路 BMPs是一种多功能生长因子,是转化生长因子-β(transforming growth factor-β,TGF-β)超家族中最大的一族[19-20],是目前公认最强且唯一能够诱导异位成骨的细胞因子[21-22]。近年来,BMPs在胚胎发育和成年动物细胞功能中的作用得到了广泛的研究。BMP I型和II型受体在信号转导中都是必不可少的。BMPs功能十分广泛,其中BMP-2是促进骨形成和诱导成骨细胞分化最重要的细胞外信号分子之一。信号转导研究发现Smads 1、5、8是BMP受体的直接下游分子,在BMP信号转导中起中心作用。其具体机制为细胞外BMP-2配体可以与BMPRⅡ型受体结合,进而磷酸化BMPRⅠ型受体,活化的BMPRⅠ型受体通过磷酸化BMP特异性R-Smads 1、5和8来传递BMP信号[23],这些R-Smads与Smad 4复合,进入细胞核并作为靶基因转录的激活因子和抑制因子起作用[24](见图2A)。BMPs受多种细胞因子的调节,研究证实Noggin是BMPs信号的直接拮抗剂。Noggin是一种分泌的多肽,可结合BMP-2、4和7并使其失效。Noggin和BMP-7的共晶结构表明,Noggin通过阻断I型和II型结合表位的分子界面来抑制BMP信号[25],并拮抗BMPs的功能[26](见图2B)。
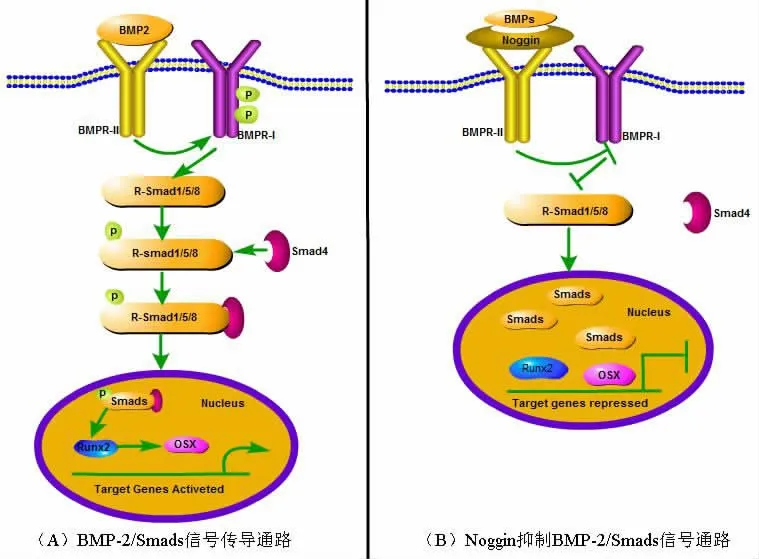
图2 BMP-2/Smads信号通路模型示意图
2.2BMP-2/Smads信号传导通路与骨质疏松相关疾病的关系 BMP-2/Smads信号通路在骨骼发生和骨形成过程中至关重要。BMPs是骨形成和其他细胞功能的强有力的刺激物,活化BMP-2信号通路能上调多种成骨细胞标志物的表达,缺乏BMP-2、BMP-4的小鼠不能存活。BMP-2纯合子突变胚胎,胚胎平均存活时间为7.5~10.5天,并存在心脏发育缺陷,表现为体腔外心脏发育异常,缺乏BMP-2和BMP-4的小鼠不能存活[27]。小鼠的遗传实验表明,BMP-2,BMP-4和BMP-7在肢体和颅面骨骼的图案化和发展中发挥主要作用[28]。对缺乏BMP-2表达的小鼠的骨祖细胞检测显示,它们在增殖能力和分化成具有骨再生能力的全功能成骨细胞方面存在严重缺陷[29]。这些结果表明,BMP-2的缺乏阻碍了骨祖细胞向骨细胞的发展。在临床应用中,BMP-2已被批准用于由于退行性椎间盘疾病的脊柱融合和用于治疗子宫内膜异位骨折[30]。在成骨细胞中特异性删除Smads 1基因(使用Col1-Cre小鼠)可导致骨量减少,说明内源性BMPs通过Smads 1信号通路调节骨量[31]。有研究发现,在前成骨细胞分化后期,Noggin具有抑制成骨细胞分化的功能,可对已分化的成骨细胞标志物骨涎蛋白和骨钙素形成完全抑制[32]。Noggin基因突变和缺失会导致多种关节异常疾病,如近端脚趾关节融合和多发骨性联合综合症,所有这些都是由Noggin突变引起的常染色体显性遗传病[33]。所以,抑制Noggin基因的过表达不仅可增加体外培养成骨细胞的成骨作用,还能增加骨量,减少骨折的发生率。但随着BMP-2临床应用范围的扩大,对其功效、浓度和并发症的担忧也随之出现[34-35],特别是脊髓手术后的各种并发症[36],包括椎间盘退行性骨质溶解[37]、软组织炎症[38]、根性关节炎[39]、咽后间隙肿瘤[39]、异位骨化、神经压迫[41]和逆行性射精[42],提示BMP-2/Smads信号通路中的分子可用于骨质疏松靶标的治疗,但其应用时间、浓度也应再继续深入研究,以期达到更好的治疗骨质疏松的效果。
3 Wnt/β-catenin与BMP-2/Smads之间的调节作用
Wnt/β-catenin和BMP-2/Smads信号通路在许多生物学行为中相互重叠、互补或抑制。有研究显示:BMP-2对成骨细胞胞外基质矿化的影响部分是通过诱导Wnt自分泌/旁分泌环介导的[43],Wnt抑制剂Dkk1是成骨细胞中IA型受体(type IA receptor,BMPR1A)BMPR1A信号传导的下游靶点,成骨细胞中BMPR1A的丢失通过上调Wnt/β-catenin信号传导增加骨量[44],提示两种信号途径之间存在着复杂的交联关系。第一种方式是两者共同作用于相同的靶基因,从而表现出叠加效应或协同作用。在细胞内,Smads被发现与Wnt信号通路相关分子形成复合物,如Dvl、GSK3β、Axin和β-catenin,这些复合物调节Smads和β-catenin磷酸化和活动[45-46]。Bain等[47]研究显示,与用BMP-2蛋白处理相似,C3H10T1/2细胞中稳定的β-catenin的异位表达或用LiCl激活内源性β-catenin信号传导诱导碱性磷酸酶mRNA和蛋白质的表达,而碱性磷酸酶mRNA和蛋白质是早期成骨细胞分化的确定标志物,与BMP2蛋白不同,稳定的βcatenin不诱导骨钙蛋白基因表达,这是晚期成骨细胞分化的标志物,BMP2诱导的分化还导致内源性β-catenin信号传导的激活,因此暗示β-catenin在BMP2介导的成骨细胞分化的早期步骤中。β-catenin和BMP2对C3H10T1/2分化的影响并不完全重叠,这意味着BMP2诱导的分化的某些方面可能是由βcatenin信号传导介导,而β-catenin也可能参与非BMP2依赖的分化过程。其他研究显示,经典Wnt信号通路增加了成骨诱导因子如BMP2的敏感性,并且能够增强它们促进成骨矿化和新骨形成的能力[48]。由以上研究可知,Wnt/β-catenin与BMP-2/Smads信号通路可相互促进,应进一步加强两者在骨质疏松之中相互作用的研究,在单一用药时效果不显著或副作用较大时,可考虑联合用药。
第二种方式是两者在生物体发育过程中存在负性调节关系。Hill等[49-50]研究表明,当干细胞发展成成骨细胞前体细胞,最后一定会分化成成骨细胞。在这个阶段,Wnt/β-catenin信号通路主要促进成骨细胞增殖并保持其前体细胞状态,防止进一步分化。而BMPs信号通路可以刺激成骨细胞前体细胞分化成为成熟的成骨细胞。因此,Wnt/β-catenin和BMP-2/Smads信号通路对成骨细胞前体细胞有相反的作用。最近的研究表明,BMPRIA成骨细胞靶向条件性敲除导致胚胎发育期间骨量增加,作为BMPRIA的下游效应物Dkk1表达减少导致Wnt/β-catenin信号传导增加[51]。高浓度的BMP-2能够增加DKK1蛋白的表达,进而对Wnt/β-catenin信号通路进行负性调节[52]。由以上研究结果可知,Wnt/β-catenin与 BMP-2/Smads信号通路存在一种负性调节作用,应进一步加强双信号通路在临床用药方面的研究,在药物机理、浓度、时间等方面进行进一步深入探讨,以期更好的靶向用药。
4 展望
OP的形成是一个极其复杂的生物学过程,涉及多个基因与因素。Wnt/β-catenin与BMP-2/Smads信号通路在骨形成和破坏的调节中起着重要作用,这些通路中涉及的信号因子可以作为治疗OP的药物靶点,用于进一步的深入研究。然而,随着这些药物的发展,还需要解决与作用模式相关的潜在问题,如骨形成过度导致的闭塞孔或通路减压导致的假定致癌性。目前的研究表明,Wnt信号通路的非选择性激活可能会导致副作用,甚至肿瘤的发生,例如大肠癌患者Dkk1表达显著降低,这表明Wnt信号通路的激活可能与大肠癌有关,高浓度BMP2可能会增加骨膜衍生细胞中的细胞凋亡并减少细胞增殖[53],因此靶向刺激Wnt/β-catenin与BMP-2/Smads信号通路进行定位、定量、定时的骨质疏松靶标治疗仍需进一步研究。继续探索信号通路的Wnt/β-catenin和BMP-2/Smad之间的相互作用机制,并制定有效的特异性靶向激活剂或拮抗剂,这对OP药物开发将会是一个显著的影响,有望为OP治疗开辟新的前景。

