氯喹对三阴乳腺癌MDA-MB-231细胞增殖的影响及其机制
蒲 倩*,吴成林*,陈秀秀,3,王欲晓,周丽君,3
(1.南方医科大学第二临床医学院,广东广州510000;2.中国人民解放军海军总医院中心实验科,北京100048;3.安徽医科大学海军临床学院,安徽合肥230032)
三阴乳腺癌是一种雌激素受体、孕激素受体和人表皮生长因子受体2 表达均为阴性的乳腺癌亚型,约占乳腺癌的10%~20%,具有侵袭性强、进展快和预后差等临床特点,且内分泌治疗和靶向治疗一般无效[1]。化疗和放疗是目前三阴乳腺癌的常规治疗手段,但经过标准治疗后其预后依然很差,无复发生存和总生存率较低[2]。因而迫切需要针对三阴乳腺癌开发新的治疗药物,改进治疗策略。
氯喹(chloroquine)是一个经典的抗疟疾药物,在肿瘤的治疗过程中也发挥重要作用,能通过诱导细胞凋亡有效抑制包括黑色素瘤、淋巴瘤和膀胱癌在内的多种肿瘤细胞增殖[3-5],对非肿瘤性上皮细胞基本不产生毒性作用[6]。同时有报道,氯喹可增加胆囊癌、宫颈癌和肝癌细胞对氟尿嘧啶、喜树碱和肝动脉插管化疗栓塞等的敏感性[7-9],以及增强乳腺癌对放疗的敏感性[10]。已有研究表明,氯喹可通过诱导细胞凋亡抑制小鼠体内乳腺癌细胞生长,其机制可能是与刺激免疫系统有关[11]。目前尚无有关氯喹对人三阴乳腺癌细胞具体作用机制的研究报道。本研究观察氯喹对人三阴乳腺癌MDA-MB-231细胞增殖的影响,并探究其作用机制,以期为三阴乳腺癌的临床治疗提供新的线索。
1 材料与方法
1.1 药物、细胞、主要试剂和仪器
氯喹购自美国Sigma 公司。人三阴乳腺癌细胞MDA-MB-231 购自美国菌种保藏中心(ATCC)。DMEM培养基购自中科迈晨公司;胎牛血清购自墨西哥MP Biomedicals 公司;CCK-8 试剂盒购自日本株式会社同仁化学研究所;二甲亚砜购自上海拜力生物科技有限公司;胰蛋白酶购自碧云天生物技术研究所;细胞凋亡检测试剂盒购自德国美天旎公司;细胞周期检测试剂盒购自西班牙Cytognos 公司;甲紫(结晶紫)购自北京索来宝科技有限公司;兔抗人自噬微管相关蛋白轻链3B(microtubule-associated protein1 light chain 3,LC3B)、细胞周期蛋白依赖性激酶2(cyclin-dependent kinase-2,CDK2)、CDK4、胱天蛋白酶3(caspase 3)、聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase,PARP)、活化的胱天蛋白酶3(cleaved caspase 3)、活化的PARP 及小鼠抗人细胞周期蛋白D3(Cyclin D3)单抗均购自美国Cell Signaling Technology 公司;小鼠抗人自噬底物SQSTM1 单抗购自美国Santa Cruz 公司;小鼠抗人β 肌动蛋白单抗购自美国proteintech 公司;辣根过氧化酶标记的羊抗兔和羊抗小鼠IgG抗体(二抗)购自北京华兴博创生物技术中心。细胞培养箱购自美国Thermo公司;Bio-Rad imark全自动酶标仪购自美国伯乐公司;FACS Calibur流式细胞仪购自美国BD 公司;OLYMPUS CK2 光学显微镜购自日本奥林巴斯株式会社。
1.2 细胞培养
三阴乳腺癌MDA-MB-231 细胞用含10%胎牛血清的DMEM 培养基,在37℃,5% CO2饱和湿度培养箱中培养,取对数生长期细胞用于后续实验。
1.3 CCK-8法检测细胞存活率
将MDA-MB-231细胞消化计数后,以每孔5×103细胞(100 μL悬液)接种于96孔板中,37℃,5%CO2下培养24 h。待细胞贴壁后,吸弃培养液,分别加氯喹1.25,2.5,5,10,20,40,80和160 μmol·L-1,同时设空白对照和细胞对照孔,每组设4 复孔,继续培养24 和48 h。吸弃培养液,每孔加100 μL 稀释的CCK-8溶液(无血清DMEM∶CCK-8原液=9∶1),继续培养3 h后取出,用酶标仪在450 nm波长下测定各孔吸光度(A450nm)。实验重复3 次。细胞存活率(%)=(实验组A450nm-空白对照组A450nm)/(细胞对照组A450nm-空白对照组A450nm)×100%。选择存活率在20%~80%之间的氯喹浓度进行后续实验。
1.4 细胞克隆形成实验检测细胞克隆形成能力
取对数生长期MDA-MB-231 细胞,消化计数后,以每孔500细胞密度接种于6孔板中,每孔体积为2 mL,培养过夜。待细胞贴壁后,吸弃培养液,加氯喹终浓度为0,20,40和80 μmol·L-1培养3 d;然后换液继续培养5 d 后取出,移除培养液并用预冷1×PBS 小心清洗2 次,加4%多聚甲醛固定20 min。去除固定液后加甲紫室温染色30 min。弃染色液,用流水缓慢清洗干净,置空气中干燥,拍照。用image J 计数克隆数,>50 个细胞为1 个克隆。
1.5 流式细胞术检测细胞周期
取对数生长期MDA-MB-231细胞,用胰蛋白酶消化计数后,按每孔1×105细胞接种于6 孔板中。第2天待细胞贴壁后,吸弃培养液,加氯喹终浓度为0,20,40 和80 μmol·L-1进行处理,每组设3 复孔。作用24 h后消化收集细胞,800×g离心5 min,弃上清,用1×PBS洗涤2次后,加预冷70%乙醇500 μL,轻吹混匀,4℃固定过夜。次日800×g 离心5 min,吸去乙醇,加1×PBS 1 mL重悬细胞,用200目尼龙膜过滤细胞悬液;800×g 离心5 min,弃上清,加碘化丙啶500 μL 混匀,避光染色15 min 后于流式细胞仪测定细胞周期。实验重复3次。
1.6 流式细胞术检测细胞凋亡
细胞处理同1.5,分别作用24和48 h后消化收集细胞,800×g离心5 min,弃上清。加1×结合缓冲液1 mL,800×g离心5 min,弃上清。加1×结合缓冲液100 μL 重悬细胞,重悬液中加Annexin V-FITC 10 μL 混匀,避光孵育15 min。然后加1×结合缓冲液1 mL清洗1次,弃上清,加1×结合缓冲液500 μL重悬细胞,最后加碘化丙啶5 μL后,立即上机检测。
1.7 Western 印迹法检测细胞周期和细胞凋亡相关蛋白及自噬标志蛋白的表达
氯喹0,20,40和80 μmol·L-1分别处理细胞24和48 h 后,用RIPA 裂解液裂解细胞,12 000×g 离心10 min,取上清液,以4∶1 体积比加5×上样缓冲液混合,煮沸5 min。提取的蛋白质进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转至PVDF 膜,5%脱脂奶粉室温封闭2 h。分别加小鼠抗人细胞周期蛋白D3单抗(1∶1000)、兔抗人CDK2单抗(1∶1000)、兔抗人CDK4 单抗(1∶1000)、兔抗人胱天蛋白酶3单抗(1∶1000)、兔抗人PARP 单抗(1∶1000)、兔抗人活化胱天蛋白酶3 单抗(1∶1000)、兔抗人活化PARP 单 抗(1∶1000)、兔 抗 人LC3B 单 抗(1∶1000)、小鼠抗人SQSTM1单抗(1∶2000)或小鼠抗人β肌动蛋白单抗(1∶20000)4℃孵育过夜。TBS-T清洗3 次,每次5 min。随后加HRP 标记羊抗小鼠或羊抗兔IgG 二抗(1∶5000),室温孵育1 h,TBS-T清洗3次后发光,显影,扫描后分析蛋白条带积分吸光度(integrated absorbance,IA),待测蛋白表达水平用待测蛋白IA与β肌动蛋白IA比值表示。
1.8 统计学分析
2 结果
2.1 氯喹对MDA-MB-231细胞存活的影响
CCK-8 实验结果(图1)所示,与细胞对照组相比,氯喹5~160 μmol·L-1分别作用24和48 h后,均能明显抑制MDA-MB-231细胞增殖(P<0.01),半数抑制浓度(IC50)分别为56.15和28.82 μmol·L-1,表明氯喹对MDA-MB-231细胞增殖具有抑制作用。后续实验选取氯喹20,40 和80 μmol·L-1处理MDA-MB-231细胞。
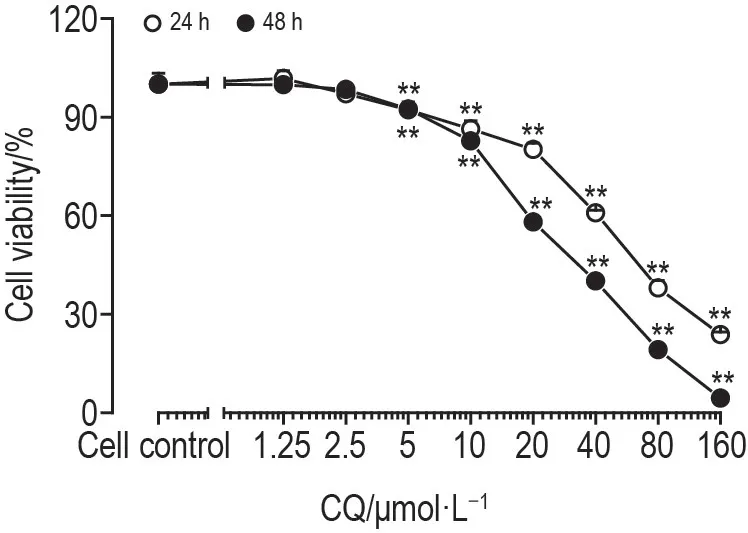
Fig.1 Effect of chloroquine(CQ)on viability of MDAMB-231 cells by CCK-8 assay. The cells were treated with CQ 1.25,2.5,5,10,20,40,80 and 160 μmol·L-1 for 24 and 48 h,respectively.,n=4.**P<0.01,compared with cell control group.
2.2 氯喹对MDA-MB-231细胞克隆形成的影响
细胞克隆形成实验结果(图2)所示,与细胞对照组相比,氯喹用药3组细胞克隆明显减少(P<0.01);且随着氯喹浓度的增加,细胞克隆形成逐渐减少(P<0.01)。由此表明,氯喹可抑制MDA-MB-231细胞的克隆形成能力。
2.3 氯喹对MDA-MB-231细胞周期的影响
流式细胞术检测结果(图3)所示,与细胞对照组相比,氯喹20 和40 μmol·L-1处理MDA-MB-231细胞24 h后,G0/G1期百分比显著升高(P<0.01),G2/M期比百分比显著降低(P<0.01)。氯喹80 μmol·L-1处理细胞24 h后,G0/G1期百分比下降(P<0.01),G2/M期百分比升高(P<0.01)。由此提示,较低浓度氯喹处理24 h 后,MDA-MB-231 细胞被阻滞在G0/G1期,较高浓度阻滞在G2/M期。
2.4 氯喹对MDA-MB-231细胞凋亡的影响
流式细胞术检测结果(图4)所示,与细胞对照组相比,氯喹20和40 μmol·L-1处理细胞24 h后细胞凋亡率无明显变化,80 μmol·L-1组细胞凋亡率升高(P<0.05);处理48 h后,3组细胞凋亡率均显著升高(P<0.05)。由此表明,氯喹促进MDA-MB-231 细胞凋亡,并具有浓度依赖性(P<0.05)。

Fig.2 Effect of chloroquine on colony formation capacity of MDA-MB-231 cells. The cells were treated with CQ 20,40 and 80 μmol·L-1 for 3 d. B was the result of count analysis of A. ,n=3.**P<0.01,compared with cell control(0 μmol·L-1)group;##P<0.01,compared with CQ 20 μmol·L-1 group;△△P<0.01,compared with CQ 40 μmol·L-1 group.

Fig.3 Effect of chloroquine on cell cycle of MDA-MB-231 cells detected by flow cytometry. The cells were treated with CQ 20,40 and 80 μmol·L-1 for 24 h. B was the semi-quantitative result of A.,n=3.**P<0.01,compared with cell control group.
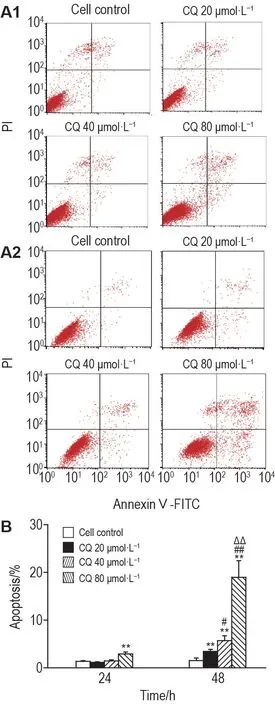
Fig.4 Effect of chloroquine on apoptosis of MDA-MB-231 cells detected by flow cytometry. The cells were treated with CQ 20,40 and 80 μmol·L-1 for 24(A1)and 48 h(A2),respectively. B was the quantitative result of A.n=3. **P<0.01,compared with cell control(0 μmol·L- 1)group;#P<0.05,##P<0.01,compared with CQ 20 μmol·L-1 group;△△P<0.01,compared with CQ 40 μmol·L-1 group.
2.5 氯喹对MDA-MB-231 细胞周期相关和凋亡相关蛋白表达水平的影响
Western 印迹实验结果(图5)表明,与细胞对照组相比,氯喹处理MDA-MB-231 细胞24 h 后,细胞周期蛋白D3,CDK4和CDK2蛋白表达水平随氯喹浓度增加逐渐降低(图5A 和5C,P<0.01);氯喹处理MDA-MB-231 细胞48 h 后,胱天蛋白酶3 和PARP 表达水平降低;活化的胱天蛋白酶3 和活化PARP表达水平随氯喹浓度的增加逐渐升高(图5B和5D,P<0.01)。
2.6 氯喹对MDA-MB-231 细胞自噬标志蛋白表达水平的影响
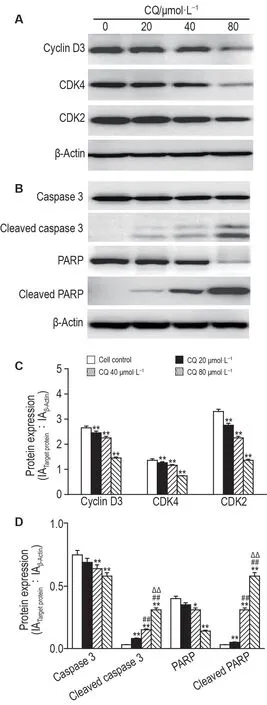
Fig.5 Effect of chloroquine on expression of cell cycle and apoptosis-related proteins of MDA-MB-231 cells detected by Western blotting. A:the expression of cyclin D3,cyclin-dependent kinase 2(CDK2)and CDK4 in the cells treated with CQ 20,40 and 80 μmol·L-1 for 24 h;B:the expression of caspase 3,cleaved caspase 3,poly-ADP-ribose polymerase(PARP)and cleaved PARP in the cells treated with CQ 20,40 and 80 μmol·L-1 for 48 h;C:the quantitative result of A;D:the quantitative result of B.,n=3.*P<0.05,**P<0.01,compared with cell control(0 μmol·L-1)group;##P<0.01,compared with CQ 20 μmol·L-1 group;△△P<0.01,compared with CQ 40 μmol·L-1 group.
Western 印迹检测结果(图6)所示,与细胞对照组相比,氯喹3 组处理MDA-MB-231 细胞48 h后,自噬标志蛋白LC3B和SQSTM1表达水平明显升高(P<0.01),表明氯喹可有效抑制MDA-MB-231细胞自噬溶酶体内蛋白降解,导致LC3B和SQSTM1聚集,提示氯喹抑制MDA-MB-231细胞自噬。
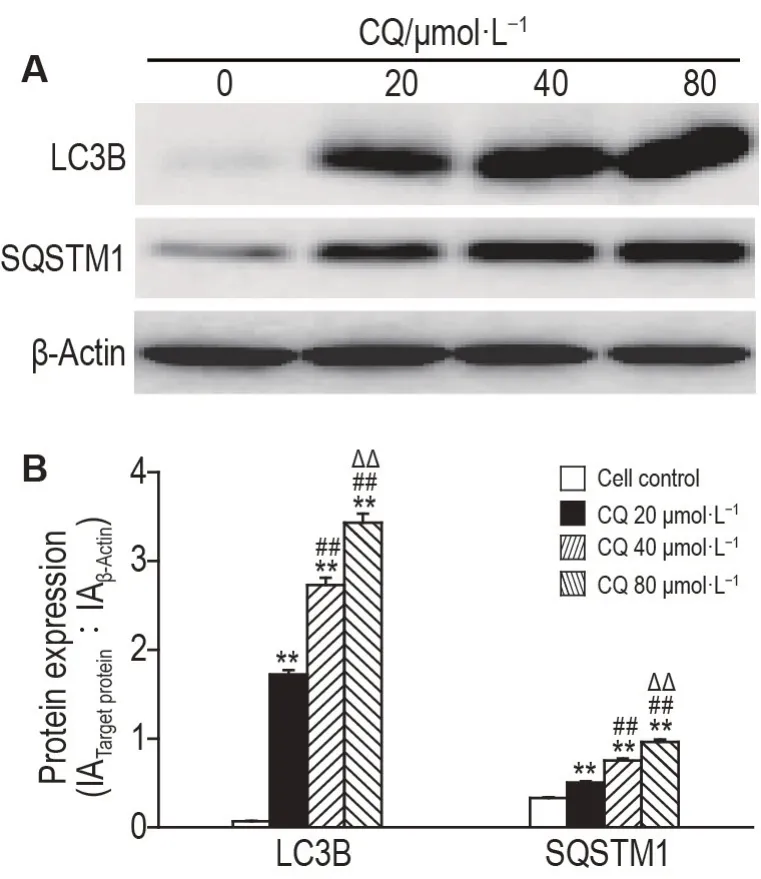
Fig.6 Effect of chloroquine on expression of autophagyrelated markers in MDA-MB-231 cells detected by Western blotting. See Fig.5B for the cell treatment. B was the quantitative result of A. LC3B:microtubule-associated protein1 light chain 3B.,n=3. **P<0.01,compared with cell control(0 μmol·L-1)group;##P<0.01,compared with CQ 20 μmol·L-1 group;△△P<0.01,compared with CQ 40 μmol·L-1 group.
3 讨论
自噬是细胞通过溶酶体降解内源性底物的重要过程,常在营养缺乏、低氧应激和药物诱导时发生,是维持细胞内环境稳定和应对环境刺激的重要反应[12]。一般认为,正常细胞可以通过自噬的自净作用维持稳态,防止癌变的发生。近年来也有大量研究表明,高水平的自噬可促进肿瘤的进展,突变的肿瘤细胞能在恶劣条件下利用自噬提供的能源和材料维持生存[13]。另外,自噬也与肿瘤细胞耐药性的形成有关[14],如Zhu 等[15]报道,抑制自噬显著增加塞来昔布(celecoxib)对前列腺癌细胞PC3 的凋亡,提示自噬对PC3细胞是一种保护性作用。氯喹是一种常用的自噬抑制剂,它通过抑制自噬体与溶酶体的融合进而影响自噬包裹物的降解[16]。近年来研究发现,氯喹对多种肿瘤细胞的生长均有抑制作用[17],如Fan 等[18]报道,氯喹在低浓度(0.25~32 μmol·L-1)时即可抑制肺癌A549细胞生长,在高浓度(64~128 μmol·L-1)则诱导A549细胞凋亡;Hu等[19]也报道,氯喹可触发肝癌HepG2和Huh7细胞G0/G1期阻滞,诱导DNA损伤及细胞凋亡,作用呈浓度和时间依赖性。同时,氯喹可作为传统化疗药物如奥沙利铂和顺铂的增敏剂[20-21],提高靶向药物如索拉非尼[[22]及放疗[23]的抗癌效果。
自噬涉及众多的自噬相关蛋白的参与,其中LC3B是目前最明确贯穿整个自噬过程并能出现在晚期自噬溶酶体中的自噬相关蛋白,参与了自噬体膜的形成[24];SQSTM1是最为广泛的自噬降低底物之一,可连接LC3 和泛素化的底物,在自噬溶酶体中被降解[25];这2 个蛋白常被用来作为自噬水平变化的指征。Beclin1 是自噬起始的一个关键调控分子[26],我们前期研究发现,在MDA-MB-231 细胞中通过CRISPR/Cas9(clustered regularly interspaced short palindromic repeats/Cas9)技术完全敲除自噬相关基因Beclin1 可诱导G0/G1期细胞周期阻滞并抑制细胞增殖[27]。本研究发现,氯喹作用三阴乳腺癌MDA-MB-231 细胞后,自噬体标志物LC3B 和自噬底物SQSTM1聚集增多,表明自噬溶酶体内蛋白降解过程被阻断,细胞自噬和细胞增殖被抑制,细胞周期进程被阻滞,细胞凋亡增加,提示自噬在维持三阴乳腺癌MDA-MB-231细胞周期进程和存活、促进细胞增殖中发挥巨大作用,是“保护性自噬”。
肿瘤细胞的异常增殖通常与细胞周期和凋亡的变化有关。细胞周期是一个高度有序的运转过程,在不同时相的多个调控点上受到调节。与正常细胞不同,肿瘤细胞中周期检查点反应缺陷,导致其异常增殖[28]。本研究发现,在MDA-MB-231细胞中,氯喹20 和40 μmol·L-1处理24 h 能将细胞阻滞在G0/G1期;且氯喹80 μmol·L-1处理短时间(6,12和18 h)细胞也被阻滞在G0/G1期(数据略);氯喹80 μmol·L-1处理24 h后,细胞被阻滞在G2/M期,同时细胞开始出现凋亡。为进一步验证氯喹对MDAMB-231细胞周期的作用机制,本研究应用Western印迹法检测氯喹处理后细胞中的周期相关蛋白表达的变化。结果显示,细胞周期蛋白D3、CDK4 和CDK2 呈现不同程度的下降。正常细胞中,细胞周期蛋白D 可与CDK4/6 结合,驱动细胞周期通过调控点,是细胞周期调控中的重要靶点。然而肿瘤细胞中细胞周期蛋白D 过度表达,使细胞G1期缩短,进而导致细胞G1期调控异常,从而引起肿瘤细胞的异常增殖[29]。Jia 等[30]已在相关研究中证实,口腔鳞癌细胞SCC25 和CAL27 中细胞周期蛋白D1 的过表达,与肿瘤大小、淋巴结转移、肿瘤分化程度、临床分期及患者的总生存率减少密切相关。Patel等[31]发现,抑制CDK4 和CDK2 能影响乳腺癌细胞的增殖和耐药,提高临床用药效果。因此,本研究结果提示,氯喹可通过抑制细胞周期蛋白D3、CDK4和CDK2的表达,在低浓度(20和40 μmol·L-1)时可将细胞阻滞在G0/G1期,高浓度(80 μmol·L-1)时阻滞细胞在G2/M期,具体机制有待深入研究。
凋亡在维持内环境的稳定以及多个系统正常发育中起重要作用,凋亡过程的紊乱与多种疾病相关,而肿瘤细胞通常是抗凋亡的,正常的清除监视被破坏[32]。本研究也发现,不同浓度氯喹处理MDA-MB-231 细胞48 h 后,凋亡率逐渐递增,表明氯喹能诱导明显的细胞凋亡。胱天蛋白酶3是细胞凋亡的终末剪切酶,是凋亡通路中的关键蛋白。在细胞凋亡启动时,胱天蛋白酶3 会被剪切成活化胱天蛋白酶3 形式,活化胱天蛋白酶3 将底物PARP剪切成2 个片段,细胞质活化胱天蛋白酶3 和活化PARP 显著增加,从而导致细胞凋亡[33]。本研究发现,氯喹处理后,MDA-MB-231细胞中胱天蛋白酶3和凋亡底物PARP 减少,而活化胱天蛋白酶3 和活化PARP 的表达升高,提示氯喹可以激活胱天蛋白酶依赖性的细胞凋亡。
综上所述,氯喹可通过抑制细胞自噬、阻滞周期进程和促进细胞凋亡以抑制三阴乳腺癌MDAMB-231 细胞增殖,其作用可能与其调控细胞周期蛋白和激活胱天蛋白酶依赖性的细胞凋亡有关。本研究初步探索了氯喹作用三阴乳腺癌细胞的分子机制,为三阴乳腺癌的治疗提供新思路。

