淫羊藿总黄酮改善自然衰老大鼠睾丸支持细胞分泌功能衰退的作用
陈 茜,张长城,韩贵芳,马 娜,袁 丁,赵海霞
(1.三峡大学医学院,湖北宜昌443002;2.三峡大学仁和医院,湖北宜昌443001)
随着社会发展,受职业规划和对生活水平要求增加等因素影响,人类平均生育年龄不断增加,因此有生育需求的中老年男性亦不断增加[1-2]。临床研究发现[3-4],随着年龄的不断增长,男性睾丸生殖功能逐渐减退,精子数量与质量均显著下降,导致生育能力下降和生殖缺陷的上升[5]。睾丸支持细胞(Sertoli 细胞)是维持各级生精细胞功能的基础细胞,其在精子的形成过程中起着至关重要的作用。研究已证实[6-7],睾丸Sertoli细胞功能衰退是衰老所致生殖功能减退的重要原因。淫羊藿是小檗科植物淫羊藿属(Epimedium)干燥叶,为我国传统补益中药。现代药理学研究显示[8],淫羊藿具有抗衰老和增强雄性生殖功能等药理作用,其主要活性成分为淫羊藿总黄酮(total flavones of Epimedium,TFE)。另有研究报道,TFE能明显增加雄性老年大鼠血清中卵泡刺激素(follicle-stimulating hormone,FSH)和黄体生成素(luteinising hormone,LH)、睾酮(testosterone,T)和雌激素的含量[9],增加D-半乳糖致亚急性衰老雄性大鼠睾丸内精子数目,明显改善睾丸组织的退行性改变,减轻亚急性衰老大鼠睾丸损伤[10]。但TFE 是否能改善自然衰老大鼠睾丸Sertoli细胞分泌功能衰退进而延缓衰老所致生殖功能障碍,目前尚不明确,其机制有待进一步研究。因此,在本研究中采用自然衰老大鼠为模型,研究TFE对衰老大鼠睾丸Sertoli细胞分泌功能衰退的改善作用并探讨其机制,为阐明TFE用于临床防治中老年男性生殖功能衰退和生育障碍提供新的思路。
1 材料与方法
1.1 药物、试剂和主要仪器
TFE 购自成都仁诚生物科技有限公司,其含量为80%,用1%羧甲基纤维素钠溶液溶解并配成相应浓度的溶液。总RNA提取试剂盒、逆转录试剂盒(大连宝生物科技有限公司);PCR 引物[生工生物工程(上海)股份有限公司合成];RIPA 裂解液、苯甲基磺酰氟(phenylmethanesulfonylfluoride,PMSF)、磷酸蛋白酶抑制剂(武汉谷歌生物有限公司);BCA蛋白定量试剂盒(北京普利莱基因技术有限公司);ECL显影液(上海碧云天生物技术研究所);兔抗人β 肌动蛋白(单抗4970L)购自美国Cell Signaling Technology公司;小鼠抗人SOX9单抗(AB55350)购自美国Millipore 公司;小鼠抗人SCF 单抗(SC-13126),小鼠抗人GDNF 单抗(SC-13147)购自Santa Cruz公司;兔抗人BMP4单抗(ab39973),兔抗人p-IRE1α 单抗(ab48187),兔抗人XBP1 多抗(ab37152)购自英国Abcam公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG、HRP 标记的山羊抗兔二抗购自武汉科瑞有限公司。IX53 型倒置显微镜(日本Olympus 公司),A1R+型共聚焦激光显微镜(日本Nikon公司),StepOne Plus 型实时定量PCR 仪(美国Applied Biosysterms 公司),TYPE1500-458 型全波长酶标仪(美国Thermo公司),PowerPac200型Western Blot电泳仪(美国Bio-Rad公司),Bioshine ChemiQ4800型化学发光凝胶成像系统(上海欧翔科学仪器有限公司)。
1.2 动物和分组
SPF 级 雄 性18 月 龄SD 大 鼠36 只、2 月 龄10 只(实验动物使用许可证号SCXK[鄂]2011-0012,三峡大学医学院实验动物中心),分笼饲养于该实验动物中心SPF 级屏障系统,屏障内保持湿度55%~65%,温度(18~22)℃,控制光照,每天12 h 明暗交替,标准颗粒饲料饲养,不限摄食与饮水。将36只18月龄大鼠随机分为3组,每组12只,即自然衰老组、TFE 10和40 mg·kg-1组,10只2月龄大鼠为壮龄对照组。每天定时ig 给予1次,每5 d间隔2 d 再继续ig 给药,给药共计4 个月。每周测量一次大鼠体质量,根据体质量调整TFE的灌胃量,壮龄对照组和自然衰老组大鼠则等体积灌胃1%CMC-Na溶液。期间,自然衰老组和TFE 40 mg·kg-1组大鼠死亡各3只,TFE 10 mg·kg-1组死亡4只,壮龄对照组1只出现不明原因消瘦。给药结束时,各组大鼠存活情况为:壮龄对照组9只,自然衰老组9只,TFE 10 mg·kg-1组8只;TFE 40 mg·kg-1组9只。
1.3 计算睾丸指数
将各组大鼠分别置天平上称得体质量后麻醉大鼠,摘取左右睾丸,测量两侧睾丸的平均质量,计算睾丸指数。睾丸指数=两侧睾丸的平均质量(mg)/大鼠体质量(g)。
1.4 HE染色观察睾丸组织形态
取各组大鼠睾丸石蜡切片置染色架,60℃烘箱中置4 h 直到切片上的石蜡融化为液体,迅速放入二甲苯中开始脱蜡然后经不同浓度乙醇梯度洗脱,经苏木素-伊红(HE)染色最后置梯度乙醇及二甲苯脱水透明后封片,于光学显微镜下取图观察组织形态变化。
1.5 实时定量PCR检测Sertoli细胞GDNF,BMP4和SCF mRNA表达水平
称取约60 mg睾丸组织,加1 mL Trizol裂解液充分裂解。根据总RNA 提取试剂盒提取总RNA,核酸检测仪测定所提取的总RNA 浓度,1%琼脂糖凝胶电泳检测其完整性,经逆转录试剂盒得模板c DNA,于-20℃保存备用。扩增时使用β肌动蛋白作为内参,反应体系总体积为10 μL:SYBR Green 5 μL,模板c DNA 2 μL,无RNA 酶无菌水(RNase free water)2.4 μL,Dye 0.2 μL,分别加入0.4 μL GDNF、BMP4、SCF 和β 肌动蛋白引物(上下游各0.2 μL),引物序列见表1,敲打混匀后依次加入排管,最后每管加稀释10倍的模板c DNA 2 μL后离心,上机(ABI StepOne plus real-time PCR system)进行扩增,操作过程中注意避光。qPCR扩增参数:预变性95℃,20 s;94℃变性,退火温度60℃,共40个循环。扩增结束后读取CT值,2-ΔΔCT计算mRNA相对表达量。

Tab.1 Sequence of primers
1.6 Western 印迹法检测睾丸组织内GDNF,BMP4,SCF,p-lRE1α和XBP1蛋白表达
称取约60 mg 睾丸组织并加入300 μL 裂解液(RIPA裂解液∶PMSF∶蛋白磷酸酶抑制剂=100∶1∶1)于匀浆管中,经匀浆仪高速研磨30 s,吸取液体置于涡旋仪上充分振荡约15 s,在冰上静置5 min,重复此步骤3 次,然后4℃下13 523×g,离心10 min后取上清,根据BCA 工作液进行蛋白定量,加入上样缓冲液煮沸灭活10 min。电泳并转印至PVDF膜、封闭1 h,加入一抗〔GDNF(15 ku)1∶1000,BMP4(47 ku)1∶1000,SCF(45 ku)1∶1000,p-IRE1α(110 ku)1∶1000,XBP1(29 ku)1∶1000〕4℃过夜,洗膜,室温下二抗孵育1 h,洗膜显影。采用Image pro plus 6.0 对目的蛋白条带进行积分吸光度(integrated absorbance,IA)分析。待测蛋白相对表达水平用IA目标蛋白/IA 内参蛋白比值表示。
1.7 免疫荧光检测大鼠睾丸组织内Sertoli 细胞数量和p-lRE1α定位
将睾丸石蜡切片置60℃烘箱烘烤4 h,经二甲苯脱蜡与梯度乙醇洗脱,柠檬酸修复液进行抗原修复,5%BSA 室温封闭1 h,一抗(SOX9 小鼠单抗1∶600,p-IRE1α 兔单抗1∶200),4℃孵育过夜,荧光二抗(1∶200)室温避光孵育1 h,弃二抗,PBS 洗涤5 次,每次5 min,最后滴加DAPI 避光染色10 min,洗去DAPI 使用抗荧光淬灭封片剂进行封片,共聚焦激光显微镜下观察采集图像。每组选择3 个标本,每个标本选择3个图像视野,利用Image J软件统计各组SOX9 阳性灶点数表示Sertoli 细胞数,绿色荧光表示p-IRE1α定位。
1.8 统计学处理
2 结果
2.1 TFE 对自然衰老大鼠睾丸质量及睾丸指数的影响
与壮龄对照组比较,自然衰老组大鼠睾丸质量有所降低,但无统计学差异,睾丸指数显著降低(P<0.01)(表2);与自然衰老组比较,TFE 40 mg·kg-1组睾丸指数显著升高(P<0.05)。
2.2 TFE对自然衰老大鼠睾丸组织形态的影响
结果如图1 所示,壮龄对照组睾丸生精小管内各级生精细胞可见且结构完整,呈紧密规则分布。自然衰老组大鼠部分生精细胞从生精上皮脱落,与壮龄对照组比较,生精细胞数目明显减少,且生精小管萎缩,小管间间隙增大。而给予TFE 后,TFE用药组大鼠睾丸生精小管的形态结构均有明显改善。

Tab.2 Effect of total flavonoids of Epimedium(TFE)on testicular mass and testicular index in natural aging rats
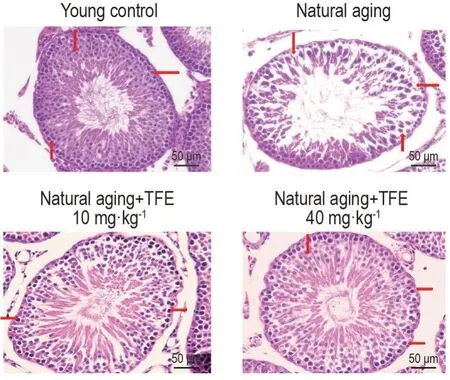
Fig.1 Effect of TFE on morphology of testis tissue in natural aging rats(HE staining). See Tab.2 for the rat teratment. Arrows show the structural disorder of spermatogenic cells at all levels,and the phenomenon of cell shedding in some spermatogenesis.
2.3 TFE对自然衰老大鼠睾丸组织内GDNF,BMP4和SCF mRNA水平的影响
与壮龄对照组相比,自然衰老组大鼠睾丸组织中分泌因子GDNF 和SCF mRNA 表达显著降低(P<0.01),与自然衰老组相比,TFE用药后GDNF,BMP4 和SCF mRNA 表达明显上调(P<0.05,P<0.01)(表3)。
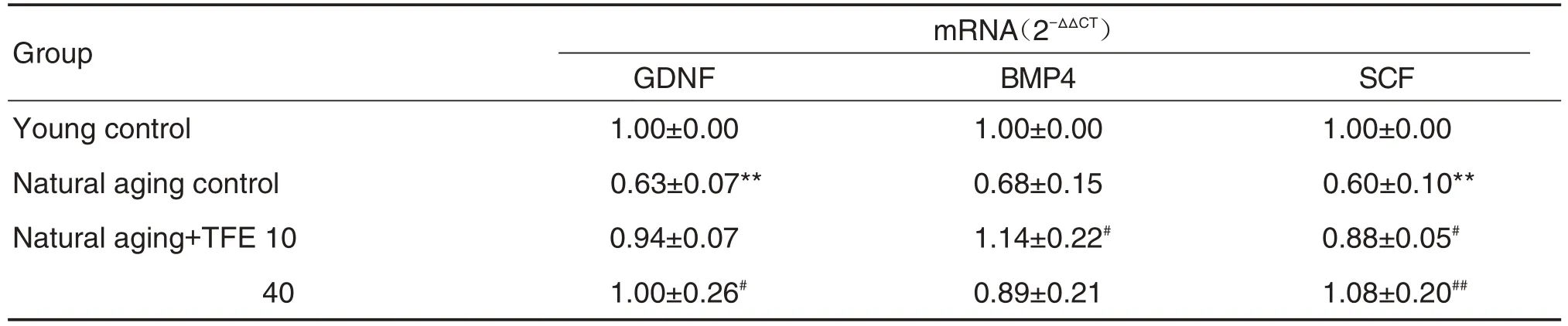
Tab.3 Effect of TFE on levels of GDNF,BMP4 and SCF mRNA in testis of natural aging rats
2.4 TFE 对自然衰老大鼠睾丸内GDNF,BMP4 和SCF蛋白表达的影响
Western 印迹结果(图2)表明,与壮龄对照组相比,自然衰老组大鼠睾丸组织中分泌因子GDNF,BMP4 和SCF 蛋白表达均显著减少(P<0.01),与自然衰老组相比,TFE组GDNF,BMP4和SCF蛋白表达显著增加(P<0.01)。
2.5 TFE对衰老大鼠睾丸组织内p-lRE1α和XBP1蛋白表达
与壮龄对照组相比,自然衰老组大鼠睾丸组织中p-IRE1α 和XBP1 蛋白表达水平均显著降低(P<0.01),给予TFE 后上述蛋白的表达显著增加(P<0.01)(图3)。
2.6 TFE对衰老大鼠睾丸组织内Sertoli细胞数量和p-lRE1α表达定位的影响
免疫荧光结果(图4)显示,SOX9(红色荧光)阳性表达位于生精小管近基底膜部位,壮龄对照组、自然衰老组和TFE处理组各组间SOX9阳性灶点数未见明显差异,且荧光强度相近,提示各组间Sertoli细胞数量无显著差异(图据未显示)。p-IRE1α(绿色荧光)在睾丸组织内各级生精细胞及支持细胞胞质中广泛定位表达,各组间表达定位无显著差异。
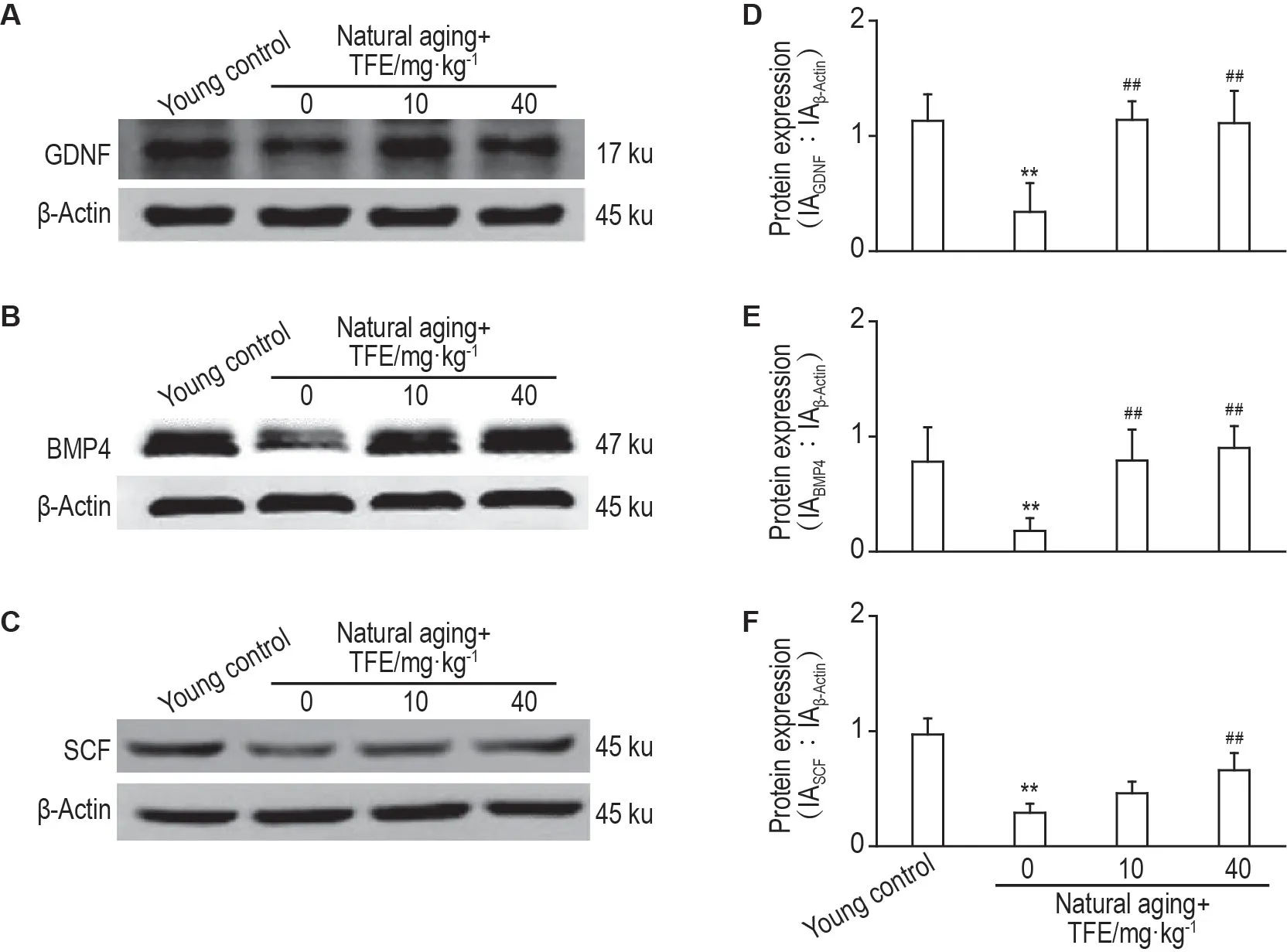
Fig.2 Effect of TFE on expression of GDNF(A,D),BMP4(B,E)and SCF(C,F)in natural aging rats by Western blotting. See Tab.2 for the rat treatment.D,E and F were the semi-quantitative results of A,B and C,respectively.x±s,n=4.**P<0.01,compared with young control group;##P<0.01,compared with natural aging control(0)group.
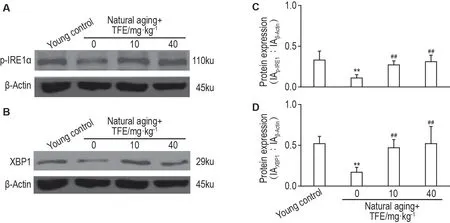
Fig.3 Effect of TFE on expression levels of inositol-requiring enzyme 1α(p-lRE1α)and X-box-binding protein 1(XBP1)in testis of natural aging rats by Western blotting. See Tab.2 for the rat treatment.C and D were the semi-quantitative results of A and B,respectively. x±s,n=4. **P<0.01,compared with young control group;##P<0.01,compared with natural aging control(0)group.

Fig.4 Effect of TFE on number of sertoli cells(A)and localization and expression of p-lRE1α protein in testis tissue(B)of natural aging rats observed by laser scanning confocal microscopy. See Tab.2 for the rat treatment. Arrows show sertoli cells(A)and p-IRE1α in spermatogenic cells and sertoli cells at all levels in the testis tissue(B).
3 讨论
本研究发现,自然衰老组大鼠睾丸指数降低,且出现生精小管萎缩,小管间间隙增大,生精上皮脱落,各级生精细胞排列紊乱的现象,而给予TFE用药后其组织形态结构明显恢复。提示TFE能改善衰老所致睾丸组织形态的退行性改变。
Sertoli 细胞是生精小管内唯一直接与生精细胞接触的体细胞,在精子生成过程中起着至关重要的作用[11]。有文献报道,SOX9 在哺乳动物睾丸Sertoli 细胞中持续表达,可作为其特异性标志物[12-13]。因此,我们利用SOX9 标记Sertoli 细胞数量,发现状龄对照组、自然衰老组和TFE 用药组中SOX9 的阳性表达差异不明显。此结果表明,各组间Sertoli 细胞数量无明显变化,提示增龄过程中Sertoli 细胞功能下降可能是引起睾丸生殖能力减退的重要原因。
在睾丸组织中,Sertoli细胞的功能主要是通过分泌GDNF,BMP4 和SCF 等多种因子来促进精原干细胞的增殖与分化,调控精子发生[14-16]。GDNF对维持精原干细胞自我更新具有非常重要的作用,而BMP4 和SCF 则是调控精原干细胞分化的关键因子。本课题组前期研究已证实,TFE能上调隐睾小鼠复位固定后睾丸内Sertoli 细胞分泌因子GDNF和SCF等表达[17]。本研究结果也显示,TFE能上调自然衰老大鼠睾丸Sertoli 细胞分泌因子GDNF,BMP4 和SCF 的mRNA 和蛋白表达水平,说明TFE 能有效改善自然衰老大鼠Sertoli 细胞的分泌功能。
有研究表明,IRE1α/XBP1 信号通路能调节参与蛋白质折叠、成熟、转运和降解等多个过程的一系列靶基因,进而维持细胞功能和延缓细胞衰老[18-20]。另有研究报道,该信号通路对睾丸生殖功能有重要的调节作用,其失活与生殖功能减退直接相关[21-22]。本研究结果显示,p-IRE1α 不仅在生精细胞胞质内广泛表达,同时在Sertoli细胞胞质内亦有表达。此外,本研究还发现与壮龄对照组相比,自然衰老大鼠睾丸组织内p-IRE1α和XBP1蛋白表达均显著减少,而TFE 能显著增加上述蛋白的表达。结果表明TFE 能增加自然衰老大鼠睾丸组织内p-IRE1α的表达。
综上所述,TFE 能改善自然衰老大鼠Sertoli 细胞分泌功能,其机制可能是通过调节IRE1α/XBP1信号通路,增强Sertoli 细胞内p-IRE1α的活性来实现的。这为后续临床研究TFE 防治衰老所致男性生殖功能障碍提供一定的实验基础。

