基于肼化学富集法分析人血浆外泌体中的N-糖基化蛋白质
白海红,王兴河,车津晶
(1.首都医科大学附属北京世纪坛医院药物Ⅰ期临床试验研究室,北京100038;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京100850)
血液是临床检验中最常用的体液样本。血液中包含了许多从组织脱离或由细胞分泌的重要物质,对于疾病的早期诊断、药物疗效评价及预后评估具有极为重要的临床意义[1-2]。其中,外泌体是一类由细胞分泌并释放入血液、尿液及唾液等体液的纳米级多囊泡体(30~100 nm),其内部包裹了大量的蛋白质、DNA 和微小(microRNA,miRNA)等活性成分[3-4]。外泌体在发现之初只被认为是细胞的“垃圾袋”,所以才被排出。但近年来的研究表明,外泌体具有重要的生物学意义,尤其外泌体携带的许多蛋白质已被证实参与到细胞通讯、神经细胞信号转导及肿瘤等重要疾病的发生发展过程中。同时,外泌体蛋白质的翻译后修饰也与肿瘤等细胞的发生、生长、侵袭和转移等密切相关[5]。
N-糖基化修饰是一种重要的蛋白质翻译后修饰类型。真核生物约>50%的蛋白质都发生了N-糖基化修饰。N-糖基化修饰几乎参与了所有重要的生命进程,如蛋白折叠、免疫应答、细胞识别及相互作用等[6-7]。同时,有研究表明,多种疾病的发生发展过程中均伴随着蛋白质N-糖基化修饰组成与结构的改变,如代谢性疾病、心力衰竭及恶性肿瘤等。美国食品与药品监督管理总局批准的肿瘤标志物中有约30%为N-糖基化蛋白质。如用于卵巢癌诊断的人癌抗原125(cancer antigen 125,CA125),用于前列腺癌筛查的前列腺特异性抗原(prostate specific antigen,PSA)及用于肝癌诊断的α-甲胎蛋白(alpha fetoprotein,AFP)等[8-10]。鉴于此,规模化定性分析人血浆外泌体中N-糖基化蛋白质的表达变化不仅有利于对其结构和功能进行认知,同时也对疾病诊断、治疗及治疗靶标发现有重要的指导价值。
目前,对外泌体N-糖基化蛋白质的研究并不多见。首要的原因是蛋白质N-糖基化修饰无模板,具有微不均一性(microheterogenicity);其次,N-糖基化蛋白质基本都是低丰度表达蛋白质,外泌体中包含的大量高丰度蛋白质及肽段对其直接检测构成干扰[11-12]。基于以上原因,对人血浆外泌体中的N-糖基化蛋白质进行高效特异的分离富集是实现其通量(throughput)化检测并进一步对其结构和功能全面而整体认知的重要前提。现有的针对N-糖基化蛋白质的分离富集方法主要有凝集素亲和富集法、亲水相互作用色谱法、硼酸富集法及肼化学法等[13-16]。Sok等[17]采用超滤法提取血浆中的外泌体并对其进行亲水富集,在5 mL 人血浆中共鉴定到127 个N-糖基化蛋白质。而与亲水相互作用色谱法相比,肼化学法是通过酰肼官能团和氧化糖链的特异性反应实现N-糖基化蛋白质的高效富集,因此具有更高的特异性。但基于肼化学法的人血浆外泌体N-糖基化蛋白质鉴定研究尚未见报道。
1 材料与方法
1.1 试剂和仪器
甲酸(FA)、1,4-二硫苏糖醇(DTT)、碘乙酰胺(IAA)、尿素和商品化酰肼树脂(美国Sigma 公司);p H 7.4 PBS 缓冲液(美国Life Technologies公司);测序级胰蛋白酶(美国Promega 公司);PNGase F糖苷酶(美国NEB公司);乙腈(ACN)和碳酸氢铵(NH4HCO3)(北京化学试剂公司);H218O(上海生工生物工程股份有限公司);所有实验用水由Milli-Q纯水系统制备(美国Millipore 公司);健康人血浆样品为首都医科大学附属北京世纪坛医院药物Ⅰ期临床试验研究室的工作人员捐献。
真空冰冻干燥机SC100A Speedvac Plus(美国Thermo Savant 公司);Sartorius BP211d 分析天平(德国Sartorius公司);Optima™XPN超速离心机(德国Beckman公司);3K30型高速离心机(美国Sigma 公司);NanoDrop 2000c超微量分光光度计(美国Thermo Fisher Scientific 公司);Thermo Orion Model 818 型p H 计(美国Thermo 公司);日立H-7650 投射电子显微镜(日本日立公司);Q-Exactive 质谱仪和Easy-nano LC 1000 液相色谱系统(美国Thermo Fisher公司)。
1.2 超速离心法提取人血浆外泌体及血浆外泌体蛋白的酶解
取1 mL 健康人血浆,加等体积PBS(p H=7.4),于4oC离心2次(分别为2000×g,30 min,12 000×g 45 min),去除沉淀。将上清转移到超速离心管中,于4℃110 000×g 离心60 min。小心去除上清液,用10 mL PBS 稀释沉淀。再将所得溶液于4℃110 000×g 离心70 min,小心去除上清液。最后所得即血浆外泌体,用0.1 mL NH4HCO30.05 mol·L-1溶液(含尿素8 mol·L-1)溶解沉淀,400 W超声90 s释放外泌体中蛋白质。BCA法对蛋白进行定量。
在上述提取的血浆外泌体蛋白溶液中加入终浓度为0.01 mol·L-1DTT后,于37℃水浴还原变性4 h,冷却后,加终浓度为0.05 mol·L-1IAA,避光放置1 h,0.7 NH4HCO30.05 mol·L-1溶液8 倍稀释,按每0.1 mg 蛋白质加1 μg 胰蛋白酶,于37℃水浴进行酶解。
1.3 血浆外泌体N-糖基化蛋白质的富集和LC-MS/MS质谱鉴定
采用张慧等[18-19]报道的肼化学法进行血浆外泌体N-糖基化蛋白质的富集。将酶解后的血浆外泌
体蛋白质肽段进行C18脱盐处理,加入终浓度为10 mmol·L-1高碘酸钠溶液,于4℃避光氧化30 min;随后,将氧化后的肽段第二次C18脱盐处理,加0.2 mL 商品化酰肼树脂,室温孵育过夜。次日将上述体系10 000×g 离心10 min,弃上清。用洗涤溶液(含二甲基甲酰胺1 mL、尿素8 mol·L-1、氯化钠1.5 mol·L-1和NH4HCO30.05 mol·L-1)洗涤2 次去除非糖肽[19]。最后,将富集有N-糖基化蛋白质的酰肼树脂混悬于0.1 mL NH4HCO30.05 mol·L-1溶液(H218O)中,按酶和蛋白质量比1 U∶10 μg 加PNGase F 酶,于37℃孵育过夜,将释放的N-糖肽脱盐,取2 μg进行质谱鉴定。
高效液相色谱仪型号为Easy-nLC 1000,配自动进样器,上样体积为20 μL。液相色谱条件:流动相由A:0.1% FA 水溶液和B:0.1% FA-100%ACN 溶液组成。洗脱条件:0~16 min,6% B-10%B;16~51 min,10% B-22% B;51~71 min,22% B-30%B;71~72 min,30%B-95%B。流动相的流速为600 nL·min-1。质谱采集条件:源温为320℃;喷雾电压为2.0 kV;一级质谱的分辨率为70 000 且AGC为3e6,最大注入时间为20 ms;二级质谱分辨率为17 500 且AGC 为1e6,最大注入时间为60 ms;质谱扫描范围设置为m/z 300.0~1400.0;肽段碎裂方式为高能诱导裂解(higher energy collision induced dissociation,HCD)且氮气为裂解气;平均碎裂能量为27%;MS/MS 谱图数据检索用Maxquant 1.5.2.8 软件(美国Thermo 公司)进行分析。搜库条件如下:胰蛋白酶酶解;允许有2个漏切位点;一级质谱的误差为20 ppm;脲甲基化修饰为固定化修饰;氧化、脱氨基和乙酰化为可变修饰;肽段假阳性率设置为1%;N-糖肽是通过N-X-S/T(X是除脯氨酸外的任意氨基酸)2.988 u质量迁移鉴定的。
1.4 基因本体(gene ontology,GO)分析
在线https://david.ncifcrf.gov/完成上述鉴定的人血浆外泌体N-糖基化蛋白的分子功能、生物学过程及细胞组成等。
2 结果
2.1 人血浆外泌体的提取及蛋白酶解
外泌体外观形态透射电镜观察结果(图1)显示,获得的外泌体具有外泌体典型的茶托样双层膜结构,且形态完整,大小均匀,直径约100 nm。蛋白定量结果表明,1 mL 人血浆含外泌体蛋白约0.228 mg。

Fig.1 Morphology of human plasma exosomes by transmission electron microscope. The arrow indicated human plasma exosome.
2.2 人血浆外泌体N-糖基化蛋白质的富集及质谱鉴定
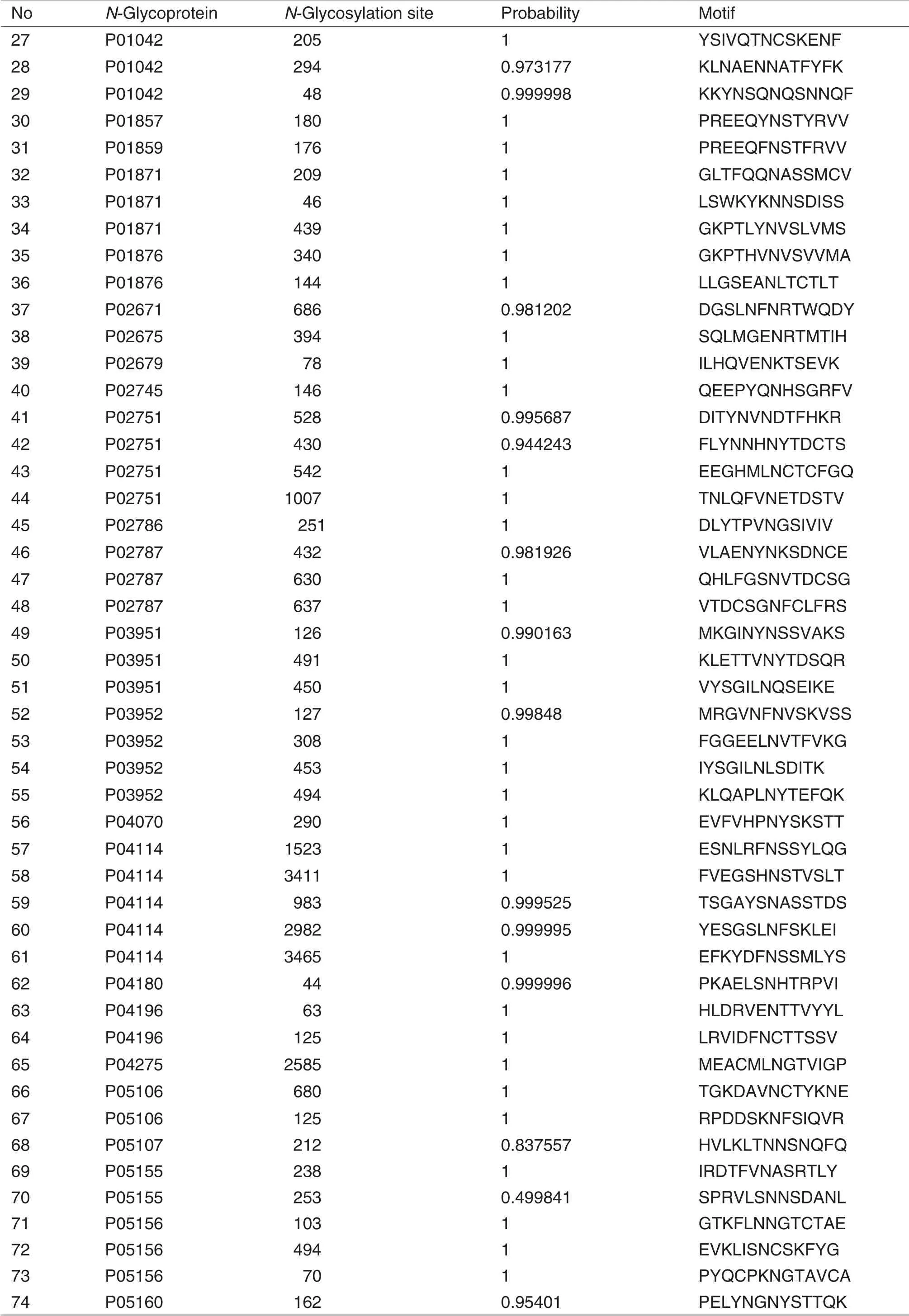
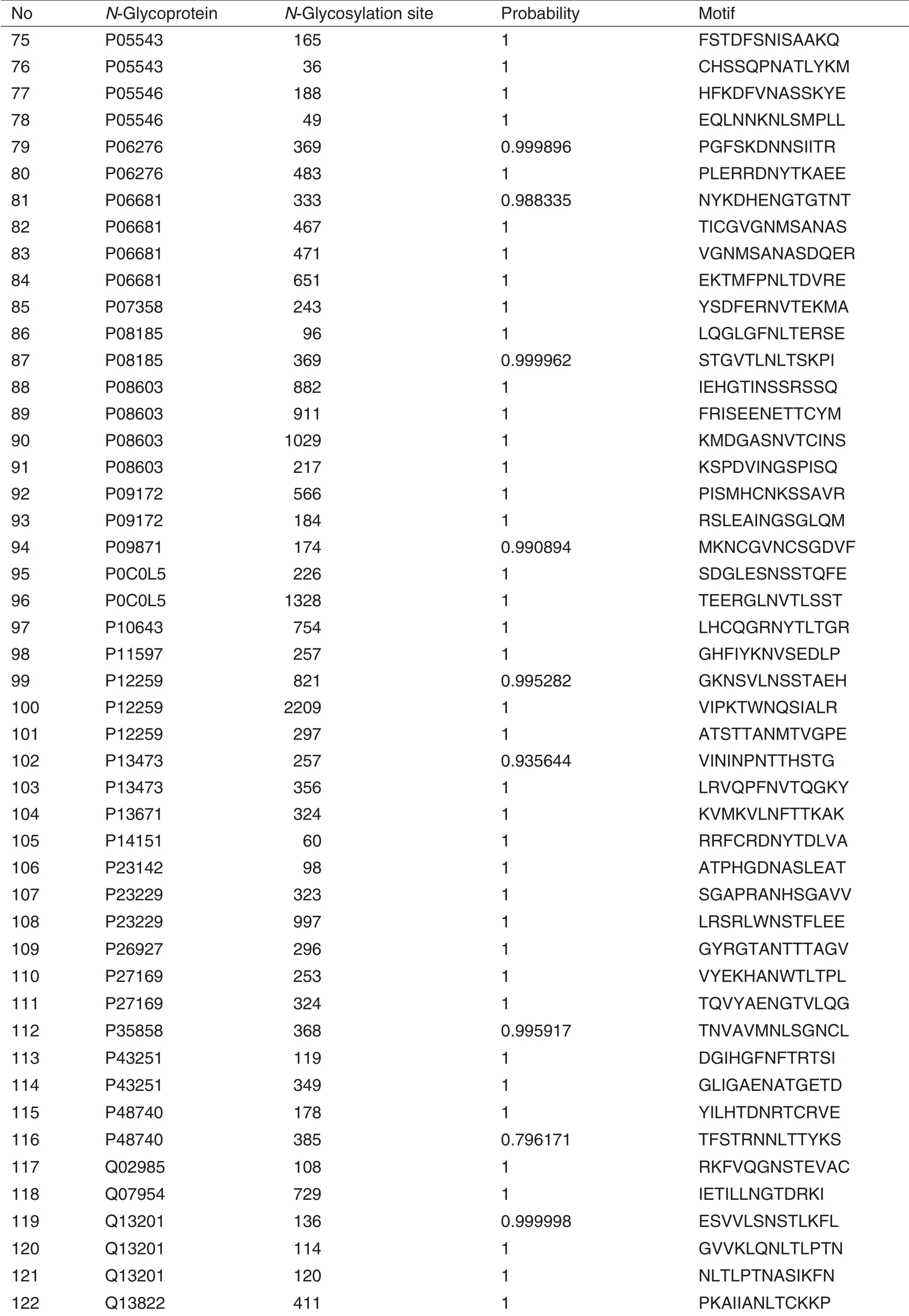
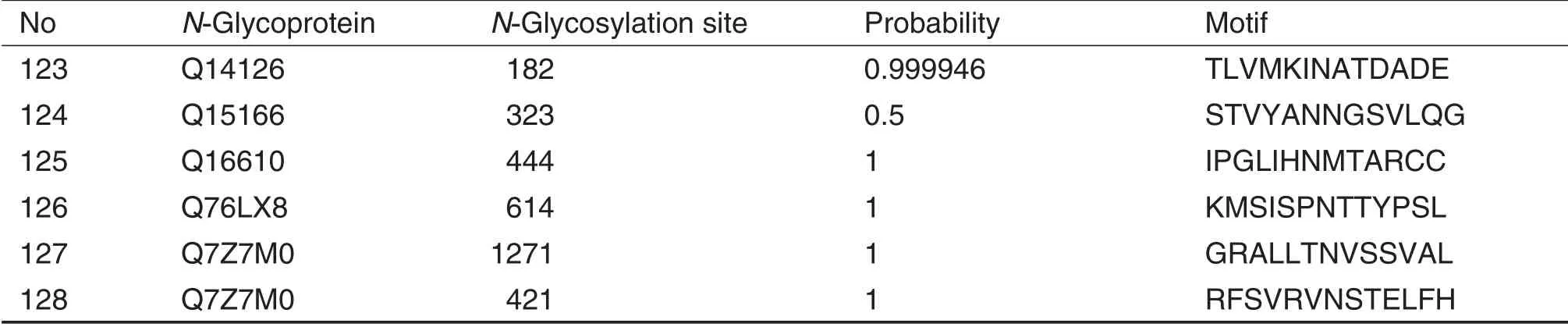
高通量质谱鉴定结果显示,1 mL人血浆样品中共鉴定到252个N-糖基化修饰位点,鉴定到155个蛋白质,其中131 个为N-糖基化蛋白质,对N-糖基化蛋白质的富集特异性为84.5%。对131 个N-糖基化蛋白质在Nextprot 数据库中进行分析,发现67 个N-糖基化蛋白质(128 个N-糖基化修饰位点)与疾病的发生发展密切相关(表1)。
2.3 人血浆外泌体N-糖基化蛋白质的GO分析
N-糖基化蛋白质的GO 分析结果(图2)显示,本研究鉴定的N-糖基化蛋白质79.4%位于外泌体,提示获得的外泌体纯度较好(图2A);分子功能分析结果(图2B)显示,这些蛋白质主要与血小板颗粒释放、蛋白质酶解及内肽酶活性负调节等生物功能相关;生物学过程分析结果(图2C)显示,这些蛋白质主要与丝氨酸型内肽酶活性、丝氨酸型内肽酶活性抑制及钙离子结合等生物学过程相关。

Tab.1 N-Glycoproteins and N-glycosylation sites of human plasma exosome enriched by hydrazide chemistry based method identified by mass spectrometry and their relations probability with diseases
续表1
续表1
续表1
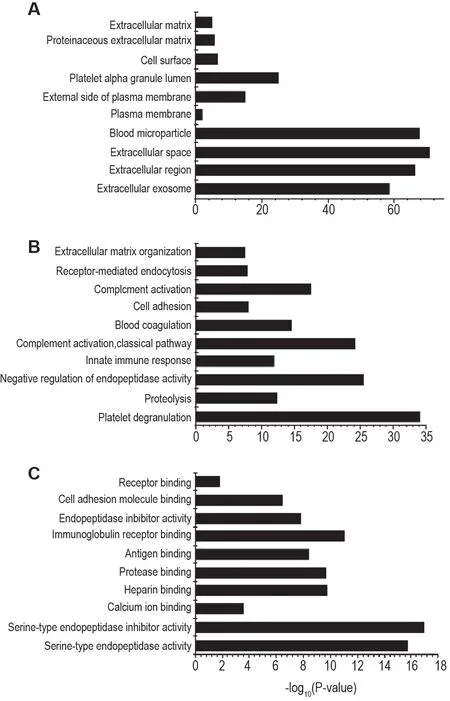
Fig.2 GO analysis of N-glycoproteins from human plasma exosomes. Top 10 significantly enriched GO categories were indicated. A:cellular component;B:molecular function;C:biological process.
3 讨论
人血浆外泌体中包含了大量从组织脱离或由细胞分泌的N-糖基化蛋白质。系统分析人血浆外泌体中N-糖基化蛋白质的组成和功能对疾病诊断、治疗及治疗靶标发现都具有重要意义。
高纯度外泌体的获得对后续研究工作至关重要。本研究采用低温条件下对样品进行反复的低速及高速离心,分离得到囊泡沉淀。该沉淀具有外泌体典型的茶托样双层膜结构且颗粒直径分布约在100 nm。
本研究在1 mL人血浆样品中共鉴定到252个N-糖基化修饰位点,归属于131 个N-糖基化蛋白质。高于文献报道的采用5 mL人血浆进行亲水富集的N-糖基化蛋白质鉴定数量(127个N-糖基化蛋白质[17]。由于人血浆外泌体中N-糖基化蛋白质基本是低丰度表达蛋白,大量高峰度表达蛋白及肽段对其检测造成干扰。N-糖基化蛋白质高效、特异的分离和富集是实现对其高通量检测的重要前提,也是进一步对其进行结构和功能全面认知的重要前提。肼化学法是基于糖基化蛋白N-糖链中的顺式邻二羟基可被高碘酸或高碘酸钠等强氧化剂氧化为醛基并进一步通过酰肼和醛基共价连接形成腙的反应特异性地将N-糖基化蛋白/糖肽从复杂的生物体系中分离出来。与其他几种基于物理吸附的富集方法相比,选择性较强。该方法由Zhang等[18-19]开发,利用酰肼官能团和氧化糖链的特异性反应实现N-糖基化蛋白质的高效富集。将肼化学法、同位素标记技术与质谱检测技术相结合,该研究小组在人血清中共富集鉴定得到145条N-糖肽,归属于57 个N-糖基化蛋白质;而在前列腺癌上皮细胞系的膜蛋白中鉴定得到104条N-糖肽,归属于64 个N-糖基化蛋白质[18]。Zhu 等[20]利用肼化学法富集人肝组织中N-糖基化蛋白质,富集效率高达90%,将其和亲水富集法相结合共鉴定到2210 个N-糖基化蛋白质和4783 个N-糖基化位点。因此,选择肼化学法富集可增大人血浆外泌体蛋白中的N-糖基化蛋白质的鉴定规模。
在本研究中,通过对鉴定的131 个N-糖基化蛋白质在Nextprot 数据库中进行分析,发现67 个N-糖基化蛋白质与疾病的发生和发展密切相关。其中41 个与心血管疾病相关,如动脉粥样硬化等;39个与肿瘤相关,例如乳腺癌等;38个与代谢性疾病相关,如糖尿病等。通过功能分析,发现鉴定的N-糖基化蛋白质主要参与酶活性调节、信号传导及免疫反应等重要的生物过程。在人血浆外泌体高通量鉴定的基础上,了解其在细胞成分、分子功能及分子过程等中的重要作用对疾病早期诊断、疾病监测及新药靶标发现等具有重要的指导意义。

