植物多功能调控因子SnRK2研究进展
苗丽丽,刘秀林,张宏纪,毛新国,景蕊莲
(1.黑龙江省农业科学院博士后科研工作站,黑龙江哈尔滨 150086; 2.黑龙江省农业科学院作物资源研究所,黑龙江哈尔滨150086; 3.黑龙江省农业科学院大豆研究所,黑龙江哈尔滨 150086; 4.中国农业科学院作物科学研究所,北京 100081)
干旱、高盐、极端温度等非生物逆境极大地限制了植物生长,严重影响农作物生产。为了适应不利环境,植物在长期进化过程中形成了复杂的应对保护机制,如调控抗逆相关基因表达,以维持细胞结构和功能的完整性。蛋白激酶和蛋白磷酸酶共同参与的蛋白质可逆磷酸化是植物在逆境条件下调节体内能量代谢和信号转导的重要方式。目前植物逆境胁迫应答过程中研究最多、涉及生理代谢与基因调控最广的蛋白激酶家族主要有钙依赖蛋白激酶CDPK、MAPK蛋白激酶和蔗糖非发酵相关蛋白激酶SnRK(sucrose non-fermenting 1-related protein kinase)[1]。SnRK属于Ser/Thr蛋白激酶,是植物生长发育和胁迫应答调控网络的枢纽[2]。根据其结构和功能不同,分为SnRK1、SnRK2、SnRK3三个亚家族。SnRK1主要参与碳代谢,如糖和淀粉的生物合成、碳水化合物在器官中的分配[3-4]。植物SnRK1与酵母SNF1(sucrose non-fermenting 1)和哺乳动物AMPK(腺苷酸活化蛋白激酶,AMP-activated protein kinase)在结构和功能上高度相似,被认为是真核生物的能量传感器。SnRK2和SnRK3是植物特有的蛋白激酶亚家族,主要参与对渗透胁迫和逆境信号分子ABA(abscisic acid)的应答。
目前SnRK2的功能及其作用机理尚未完全解析。为了促进植物SnRK2基因家族的研究和利用,结合笔者所在课题组多年来对小麦SnRK2基因家族的研究结果,本文对SnRK2结构和分类、调控机制和生物学功能进行了综述。
1 SnRK2的结构和分类
SnRK2是一个相对较小的蛋白激酶亚家族。在拟南芥、水稻、玉米、小麦和大豆等多种植物中均发现了SnRK2基因家族成员,不同物种中SnRK2成员数量不同(表1)。
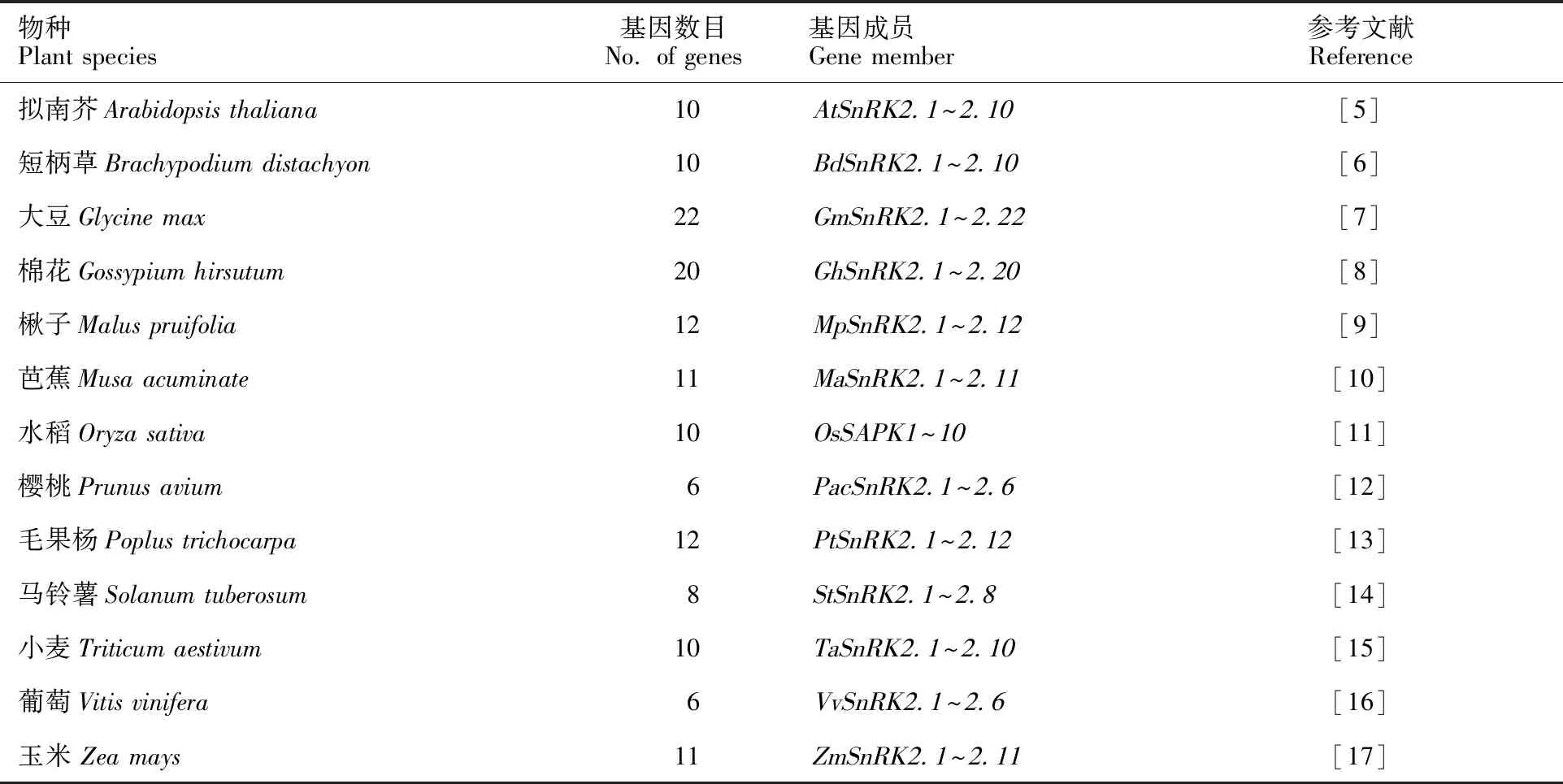
表1 不同植物中 SnRK2基因数目Table 1 The members of SnRK2 genes in different plant species
SnRK2蛋白分子量约为40 kD,含有两个结构域: N端激酶结构域和C端调节结构域[18]。N端结构域异常保守,与AMPK和SNF1的激酶结构域高度同源,相似性达42%~46%; C端结构域又分为2个亚结构域Domain I 和Domain II。 Domain I由靠近N端激酶结构域后的30个氨基酸组成,存在于所有SnRK2成员中,主要受逆境胁迫激活,但不依赖ABA。Domain II由靠近C端的40个氨基酸组成,为ABA依赖型SnRK2所特有,是响应ABA应答的必须结构(图1)。研究发现,SnRK2的C端结构域与酶激活性、ABA信号转导及蛋白间互作有关[11]。

图1 SnRK2的结构域[19]
目前有两种分类方法,一种是根据C端酸性氨基酸不同,将SnRK2分为SnRK2a和SnRK2b,其中SnRK2a富含天冬氨酸,SnRK2b富含谷氨酸;另一种分类方法较为常用,依据是否受ABA诱导,将SnRK2分为3个群:GroupⅠ、Group Ⅱ和Group Ⅲ,其中GroupⅠ不受ABA诱导,Group Ⅱ受ABA微弱诱导,而Group Ⅲ受ABA强烈诱导。拟南芥10个SnRK2基因成员中,AtSnRK2.1、AtSnRK2.4、AtSnRK2.5、AtSnRK2.9和AtSnRK2.10属于GroupⅠ;AtSnRK2.7和AtSnRK2.8属于Group Ⅱ;AtSnRK2.2、AtSnRK2.3和AtSnRK2.6属于Group Ⅲ[20]。而小麦的10个SnRK2基因成员与拟南芥无同源对应关系,TaSnRK2.4、TaSnRK2.5、TaSnRK2.6和TaSnRK2.7属于GroupⅠ;TaSnRK2.1、TaSnRK2.2和TaSnRK2.3属于Group Ⅱ;TaSnRK2.8、TaSnRK2.9和TaSnRK2.10属于Group Ⅲ[15]。
2 SnRK2参与调控基因表达的机制
磷酸化对于激活SnRK2有促进作用,SnRK2主要通过磷酸化修饰来调控下游基因表达和蛋白质活性。目前有多个SnRK2磷酸化位点已被鉴定,最具代表性的是AtSnRK2.6的Ser175,其磷酸化状态是激酶活性的关键,该磷酸化位点在蛋白激酶中普遍存在,如AtSnRK2.10和烟草SnRK2成员NtOSAK的Ser158是相似的磷酸化位点[21]。
SnRK2活性调控以自身磷酸化为基础。目前对ABA依赖型SnRK2的可逆磷酸化已有比较深入的研究。ABA受体PYR/PYL/RCAR的发现是ABA信号通路研究的标志性进展[22]。在ABA依赖信号通路中,SnRK2蛋白激酶Group Ⅲ 成员是信号传递的枢纽,组成了ABA-PYR-PP2C-SnRK2-转录因子相偶联的信号通路。缺乏ABA时,A类磷酸酶PP2C与SnRK2结合,此时SnRK2没有活性;ABA存在时,ABA首先与其受体PYR/PYL/RCAR家族成员结合并引起受体构象变化,异构化的受体作用于PP2C的催化位点进而抑制其催化活性。ABA受体与PP2C结合促使后者释放出SnRK2,后者通过自身磷酸化而被激活,激活后的SnRK2可以作用于下游底物,从而将ABA信号传递到不同的信号通路[23]。ABA信号传递途径中,SnRK2在去磷酸化后失活,那么必然存在SnRK2活性的负调控因子,除PP2C外,与SnRK2互作的钙离子感应因子SCS和一氧化氮(NO)等也是负调控因子[24-25]。SnRK2的下游作用底物有ABA应答元件结合因子ABF、S型阴离子通道SLAC1、K+通道KAT1、NADPH氧化酶AtrdohF等[26-29]。如拟南芥SnRK2.2、SnRK2.3和SnRK2.6通过调控下游AREB/ABF(bZIP类转录因子)参与干旱等渗透胁迫的ABA信号转导途径[30]。此外,在渗透胁迫条件下,非ABA依赖型SnRK2在未知激酶的作用下发生磷酸化,直接作用于下游基因,进而引发一系列应答反应[31]。
除磷酸化外,SnRK2还通过其他方式调控基因表达,如RNA剪接、mRNA降解、microRNA积累、DNA甲基化和组蛋白去乙酰化等[32-34]。其中RNA剪接是ABA应答反应的一种重要调控机制。基于磷酸化蛋白组学的方法,鉴定了6种与RNA剪接相关的功能蛋白,包括已经证实的RNA剪接因子BTR1L(AtSnRK2.6的底物)[32]。组蛋白去乙酰化介导的表观修饰也参与基因转录调控。SNL2是组蛋白去乙酰化复合物的重要组成成分,SnRK2可能通过磷酸化SNL2调节组蛋白去乙酰化[32]。可见,SnRK2在转录、翻译、表观修饰等多个层面参与调控基因表达。
3 SnRK2的功能
3.1 SnRK2参与响应逆境胁迫应答
SnRK2参与响应激素、盐、旱、极端温度、养分、病害等各种非生物和生物逆境胁迫。SnRK2基因启动子区通常含有与激素、逆境胁迫应答相关的顺式作用元件,如ABA应答元件ABRE、赤霉素应答元件GARE-motif、茉莉酸甲酯应答元件CGTCA-motif、热激应答元件HSE、低温胁迫应答元件LTRE、干旱应答元件DRE、逆境胁迫响应元件TC-rich repeats、MYB转录因子结合元件MBS等,这些元件可能与激素信号转导和逆境胁迫应答有关[35]。
第一个被克隆的SnRK2成员是PKABA1,它是从ABA处理后的小麦幼胚cDNA文库中分离获得[26]。PKABA1可以磷酸化底物TaABF(ABA应答元件结合因子),并受ABA、冷害、高盐、干旱等诱导表达[26]。
在拟南芥中,除AtSnRK2.9外,其余9个SnRK2成员均可被蔗糖、甘露醇、山梨醇和NaCl诱导。其中,AtSnRK2.2、AtSnRK2.3、AtSnRK2.6、AtSnRK2.7和AtSnRK2.8(Group II和III)均能够不同程度地被ABA诱导,但所有AtSnRK2成员都不受低温诱导[5]。
水稻的10个SnRK2成员均能被盐胁迫诱导,然而仅有SAPK8、SAPK9和SAPK10这3个成员可以被ABA激活[11]。玉米的11个SnRK2成员中,ZmSnRK2.2、ZmSnRK2.4、ZmSnRK2.5、ZmSnRK2.7和ZmSnRK2.10能被ABA诱导激活,ZmSnRK2.3和ZmSnRK2.6能够被盐胁迫强烈诱导,ZmSnRK2.3和ZmSnRK2.7能被低温诱导,ZmSnRK2.5、ZmSnRK2.6和ZmSnRK2.9的表达会被高温抑制[17]。
过表达玉米SAPK8的拟南芥[36]和过表达水稻SAPK4的水稻[37],耐盐性较野生型增强。NaCl溶液处理后,水稻SAPK4基因通过降低氧化损伤和调节离子平衡,细胞中积累较少的Na+和Cl-,从而提高了转基因植株的耐盐性[37]。过表达小麦TaSnRK2.4基因会诱导下游抗逆相关基因的表达,引起一系列抗逆生理变化,如组织的渗透势降低、相对含水量增加、细胞膜稳定性增强等,从而提高了转基因植株的耐盐性,还增强了其对低温、干旱的抗性[38]。
SnRK2也可以参与养分胁迫应答。莱茵衣藻中,PSR1转录因子涉及磷和硫的代谢,其中SNRK2.1和 SNRK2.2响应低硫胁迫[39]。高等植物中,在硫不足时拟南芥AtSnRK2.3调控硫酸转运蛋白SULTR2-2的表达和O-乙酰基-L-丝氨酸(硫饥饿反应推定的信号化合物)的积累[40]。小麦TaSnRK2.7-B和控制磷素高效利用的位点均位于染色体2AL[41]。利用筛选酵母文库获得小麦TaSnRK2.4候选互作蛋白TaPHR1(磷素应答蛋白),经酵母双杂、荧光素酶互补成像和荧光定量PCR技术验证,推测TaSnRK2.4可能通过磷酸化TaPHR1参与磷素的吸收利用(未发表数据)。除了非生物胁迫外,SnRK2还参与响应病原菌等引起的生物胁迫应答,在植物与病原物互作初期的信号识别与转导,以及后期的防御反应调控等阶段发挥重要作用。SnRK2还可以通过调控植物的气孔关闭来避免病菌的侵害,如拟南芥AtSnRK2.6基因可能通过调控OST1(open stomata 1)基因表达参与气孔开闭过程[42]。拟南芥受到无毒丁香假单胞番茄变种Pst DC3000/avrRpt2侵染后,叶片中SnRK2.8的转录水平明显上升,且SnRK2.8能与植物系统抗病的关键调控转录因子NPR1互作。磷酸化试验表明,SnRK2.8可以磷酸化NPR1的589位Ser和373位Thr[43]。
3.2 SnRK2参与调控植物生长发育
SnRK2调控种子休眠与萌发、性别分化、根系形态建成、开花、果实成熟、产量形成、株高等多个环节,从而影响植物的生长发育进程[32,44-50]。以下集中介绍SnRK2在调节植物根系生长、果实成熟和农艺性状发育三个方面的研究进展。
根系是植物吸收水分和养分的重要器官,在稳固植株、营养储存、繁殖、次级代谢物合成等方面具有重要作用。研究表明,拟南芥AtSnRK2.4和AtSnRK2.10分别在维持根长及侧根数量方面发挥重要作用[20],并参与调控盐胁迫下根系的生长与形态建成[51];干旱胁迫下拟南芥AtSnRK2.8(SRK2C)的突变导致了侧根数量减少、根长变短[46];AtSnRK2.2则调控根系的向水性生长[52]。小麦TaSnRK2.3、TaSnRK2.4、TaSnRK2.7和TaSnRK2.8过量表达均能促进转基因拟南芥根系的生长[38,53-55]。SnRK2参与根系生长的机理值得深入研究。
果实成熟是一个复杂的生理过程。在樱桃果实成熟过程中,PacSnRK2.1、PacSnRK2.3、PacSnRK2.4和PacSnRK2.6基因均呈现出“上调-下调-上调”的规律性表达模式[12]。苹果MdSnRK2.4/2.9可与调节乙烯合成酶ACO1表达的两个关键转录因子 MdHB1和MdHB2互作,并通过磷酸化协同调控MdHB1和MdHB2的转录活性及稳定性,从而调控乙烯合成,影响果实成熟[56]。
SnRK2参与糖代谢,影响产量。作为主要碳源,糖不仅是能量代谢的物质基础和细胞的组成成分,还是重要的渗透调节物质和信号分子。有学者推测SnRK2和SnRK3均由SnRK1复制演化而来,所以保留了SnRK1的糖代谢功能,与产量密切相关[49],如拟南芥AtSnRK2.6参与调控了蔗糖代谢和不饱和脂肪酸的合成[57]。小麦TaSnRK2.8-A与灌浆中期和成熟期的茎秆可溶性糖含量显著关联[58],不同水分条件下TaSnRK2.10-A与千粒重、单株穗数和每穗小穗数等产量性状显著关联[59]。多种环境条件下TaSnRK2.9-5A与穗粒数、千粒重显著关联,过表达TaSnRK2.9-5A能显著增加转基因水稻的穗粒数[60]。SnRK2增产的分子机理尚未阐明。
SnRK2参与调控株高。关联分析结果表明,小麦TaSnRK2.3-1B与株高、穗下节长、茎秆倒二节长和千粒重显著关联[50]。借助DH群体将TaSnRK2.3-1B定位于小麦染色体1B的标记 wmc156(2.1 cM)和P3446-183(2.9 cM)之间,在该区域内曾报道有一个控制株高的QTL[53]。对小麦极端株高品种的节间组织进行基因表达量分析的结果表明,TaSnRK2.3-1B负调控株高[61]。
综上所述,SnRK2是典型的“一因多效”基因家族,它一方面响应逆境胁迫应答,增强植物的抗逆性,一方面参与调控植物生长发育的多个方面。
4 展 望
SnRK2是植物特有的蛋白激酶,它通过磷酸化修饰调节蛋白质活性,调控下游基因表达,从而参与多种信号转导途径和代谢过程,在植物生长发育和逆境胁迫应答中发挥重要作用。
目前对SnRK2的研究主要集中在ABA依赖的信号通路,其作用机理和分子调控网络也因此被阐述得很清楚。而对SnRK2参与的非ABA依赖信号途径研究得却非常之少,其上游激活因子、下游靶标,以及其作用机理均知之甚少,因此未来应该加强对该领域的研究。
随着转基因、高通量测序和基因组编辑技术的广泛应用,基因功能解析将变得越来越容易;同时伴随着关联分析技术在复杂性状解析方面的成功应用,我们深信SnRK2的新功能将会被不断发现,尤其是其在调控主要农艺性状发育方面的作用将进一步丰富我们的认知。SnRK2功能的全面解析,将为充分利用该基因家族改良植物的抗逆性、提高产量提供理论依据和基因资源。

