棉花CML基因家族成员鉴定与功能分析
杨秀,许艳超,杨芳芳,蔡小彦,侯宇清,王玉红,王星星,王坤波,刘方,周忠丽
(棉花生物学国家重点实验室/中国农业科学院棉花研究所,河南安阳455000)
陆地棉(Gossypium hirsutumL.)是世界上重要的经济作物,为纺织品生产提供天然的纤维[1]。随着作物生产的发展和环境的变化,棉花生产正在面对土壤盐碱化、干旱和极端温度等非生物胁迫。
其中,盐碱化是全球农业面临的主要环境问题之一[2]。植物生长对盐胁迫的反应主要分为2个阶段,第1个阶段是快速的渗透阶段,能够抑制幼叶的生长,第2个是缓慢的离子毒害阶段,加速成熟叶片的衰老[3-4]。许多学者关注植物盐胁迫应答机制,提高了对植物盐胁迫响应调节机制的认识[5-7]。
钙离子(Ca2+)在植物信号转导中的重要调节作用已被充分证实。在钙离子信号转导过程中,钙离子传感器发挥重要的作用,调节各种效应蛋白的活性,以协调适当的细胞反应[8]。植物钙离子传感器主要有3类:钙调素(Calmodulin,CaM)和类钙调素(Calmodulin-like,CML)蛋白、钙调磷酸酶 B-like(Calcineurin B-like,CBL)蛋白与钙依赖性蛋白激酶(Calcium-dependent protein kinase,CDPK)[9-11]。CML 是 1 类钙结合蛋白,每个蛋白具有至少1个EF-hand保守结构域(为螺旋 -环 -螺旋结构, 只能结合 1个 Ca2+)[12-13]。CML是植物中普遍存在的钙离子结合蛋白[11,14]。例如,在拟南芥(Arabidopsis thaliana)[15]、水稻(O-ryza sativa)[16]、番茄(Solanum lycopersicum)[17]和大豆(Glycine max)[18]基因组中分别鉴定到50个、32个、52个、68个CML基因,它们广泛参与生物胁迫和非生物胁迫等生物学过程。拟南芥CML24是1种在多种器官中表达并响应多种刺激的基因,它编码1种潜在的Ca2+传感器,该传感器可能响应脱落酸(Abscisic acid,ABA)、日照时间和各种盐分[15]。 此外,CML37、CML42、CML38和CML39对很多环境胁迫也有响应,如干旱、盐与脱落酸(Abscisic acid,ABA),其中CML37 和CML42与干旱胁迫反应有关,但具有拮抗作用[19-20]。非生物胁迫和ABA也能快速诱导ATCML9在幼苗中的表达,并通过影响ABA介导的途径增强对盐和干旱胁迫的耐受性[21-22]。水稻CML基因OsMSR2也是通过ABA介导的途径应对干旱和盐胁迫[23]。
尽管前人对拟南芥和水稻、大豆中的CML基因进行了全基因组鉴定,但关于棉花中CML基因的鉴定和功能研究有限。本研究通过生物信息学方法,分别获取陆地棉(Gossypium hirsutumL.)、雷蒙德氏棉(Gossypium raimondiiUlbrich)、亚洲棉(Gossypium arboreumL.)CML基因家族成员,对其系统进化关系、编码产物的保守结构域、染色体定位、顺式作用元件以及在盐胁迫下的表达模式等进行分析,并通过病毒诱导基因沉默技术(Virus-induced gene silencing,VIGS)初步验证其功能,为棉花CML基因功能的后续深入研究提供参考。
1 材料与方法
1.1 棉花CML家族成员鉴定与理化性质分析
利用拟南芥和水稻CML家族蛋白序列,在CottonGen 数据库(https://www.cottongen.org/)中比对棉花(陆地棉、雷蒙德氏棉、亚洲棉)CML蛋白序列,人工去除冗余蛋白序列。利用SMART(http://smart.embl-heidelberg.de/)、CDD(http://www.ncbi.nlm.nih.gov/cdd)和 PFAM(http://pfam.sanger.ac.uk/)预测并分析上述候选蛋白序列的保守结构域,剔除不含完整保守结构域的序列。同时,利用 COTTON FGD(http://www.cottonfgd.org/)数据库对棉花CML基因的染色体位置及其编码产物的相对分子质量和理论等电点等基本信息进行分析。
1.2 棉花CML基因家族系统进化分析
利用Clustal X 2.0程序对获得的拟南芥、水稻、陆地棉、亚洲棉、雷蒙德氏棉的CML蛋白序列进行多序列比对,利用MEGA 6.0软件,生成.meg格式文件,然后采用Neighbor-Joining法构建系统进化树,其Bootstrap method值设为1 000,其余参数设为默认值。
1.3 陆地棉CML蛋白基序和保守结构域分析
CML蛋白序列的保守基序分析采用MEME在线软件预测,参数设置如下:“Maximum number of motifs” 为 15;“Occurrences of a single motif” 为 “zero or one per sequence”。 采 用 CDD(https://www.ncbi.nlm.nih.gov/cdd/) 数 据 库 查 找CML的保守结构域信息,利用TBtool作图工具绘制保守结构域。
1.4 陆地棉CML家族基因的顺式作用元件分析
利用棉花基因组数据库Cotton FGD(http://www.cottonfgd.org/)提取陆地棉CML基因序列转录起始位点ATG上游1 500 bp序列,然后将获得的序列提交到Plant CARE(http://www.dna.affrc.go.jp/PLACE/signalscan.html)数据库中,鉴定启动子区域可能存在的顺式作用元件。
1.5 陆地棉CML家族基因的染色体定位
应用所获得的信息,利用MapChart 2.2[24]本地软件绘制棉花CML家族基因在染色体上的位置图。
1.6 陆地棉CML家族基因表达模式分析
利用本实验室陆地棉盐胁迫(300 mmol·L-1NaCl)下根和叶的转录组数据,将CML家族基因的表达量经过标准化处理,用FPKM(Fragments per kilobase of exon per million fragments mapped)值表示,并以log2形式转化,采用MeV4软件绘制热图,进行层次聚类分析。
1.7 RNA的提取与实时荧光定量聚合酶链式反应(Quantitative real-time polymerase chain reaction,qRT-PCR)
利用天根RNA试剂盒提取总RNA,并用Promega反转录试剂盒合成第1链cDNA。使用NCBI primer-BLAST设计qRT-PCR引物(表1)。试验采用SYBR染料法,基于ABI 7500 fast平台。体系为 20 μL,包含 10 μL SYBR Green PCR mix, 上下游引物各 0.5 μL,2 μL 的稀释 cDNA模板及7 μL ddH2O。qRT-PCR反应程序为:95℃10 min;循环阶段:95℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环;熔解曲线阶段:95℃15 s,60℃1 min,95℃30 s,60℃15 s。以Actin作为内参基因,采用2-△△CT方法计算基因的相对表达量,每个基因的表达反应重复3次。

表1 qRT-PCR引物序列Table 1qRT-PCR primer sequence
1.8 陆地棉CML44-2在棉花中的功能验证
选用玛利加朗特棉85作为试验材料(由本实验室保存)。菌种:农杆菌菌株LBA4404为本实验室保存;VIGS病毒载体TRV2及包含TRV1和TRV2::CLA1载体的农杆菌菌株。为了构建GhCML44-2基 因 的 VIGS载 体(TRV2::GhCML44-2),用引物GhCML44-2-F(5'-GTGAGTAAGGTTACCGAATTCCGACTTGCGACGGATTTTCG-3')和GhCML44-2-R(5'-CGTGAGCTCGGTACCGGATCCGCCTCAATCTTGGTGCTG-TG-3')从玛利加朗特棉85中扩增GhCML44-2基因。利用滤纸发芽法处理棉花种子,3~4 d后,移入培养液中,置于光照培养箱中,培养条件为16 h光照/8 h黑暗,温度为25℃,每隔5 d换1次培养液,待2片子叶展开且真叶尚未发育时即可用于VIGS操作。在VIGS农杆菌接种后14 d,将沉默苗进行盐胁迫处理(300 mmol·L-1NaCl),并以注射空载体菌株和未注射菌株的棉苗为对照。于盐胁迫处理后48 h,采集叶片样品进行基因相对表达量、丙二醛(Malondialdehyde,MDA)含量、脯氨酸(Proline,Pro)含量和超氧化物歧化酶(Superoxide dismutase,SOD)活性测定,详细步骤按照北京索莱宝生物公司超氧化物歧化酶活性、脯氨酸含量和丙二醛含量检测试剂盒(可见分光光度法)说明书操作。
2 结果与分析
2.1 棉花CML家族成员的鉴定与理化性质
利用从TAIR数据库和水稻基因组数据库中分别下载的50个拟南芥和32个水稻CML蛋白序列作为棉花CML蛋白的查询序列,进行BLASTP和HMMER搜索获得的候选氨基酸序列用Pfam、SMART、CDD工具预测保守结构域,并剔除不含EF-hand结构域的冗余序列。在陆地棉、亚洲棉和雷蒙德氏棉中分别获得了154个、78个、74个CML基因。3个棉种CML家族成员基因组序列差异较大(200~5 000 bp);除了个别的CML蛋白外,其他的蛋白序列氨基酸残基数差异较小,一般为200个左右;CML基因编码产物的理论等电点(pI)、相对分子质量大小差异不大,表明棉花CML蛋白的理化性质差异不大。大多数CML蛋白的等电点小于7,表明CML蛋白中的氨基酸大部分为中性或酸性。
2.2 棉花CML家族基因进化分析
为了揭示棉花CML基因家族的进化关系,以拟南芥和水稻CML家族基因作为参考,构建了系统进化树(图1、图2)。根据亲缘关系将CML基因家族分为 A~H 8个亚族,A、B、E、F、H亚族都同时包含双子叶植物棉花、拟南芥和单子叶植物水稻中至少1个CML基因,而C、D、G亚族仅包含双子叶植物棉花和拟南芥的CML基因,这说明C、D、G亚族CML基因的出现时间晚于单、双子叶的分化时间。从物种CML基因数量上比较,陆地棉CML基因的数量远远高于拟南芥和水稻,表明在拟南芥和棉属分化后,CML基因在棉属中发生了倍增,说明CML基因可能在棉属适应外界环境的进化中发挥关键作用。亚洲棉和雷蒙德氏棉CML基因数量相差不大,几乎呈现一一对应关系,而在陆地棉中CML基因成员大幅扩增,这符合物种进化关系。
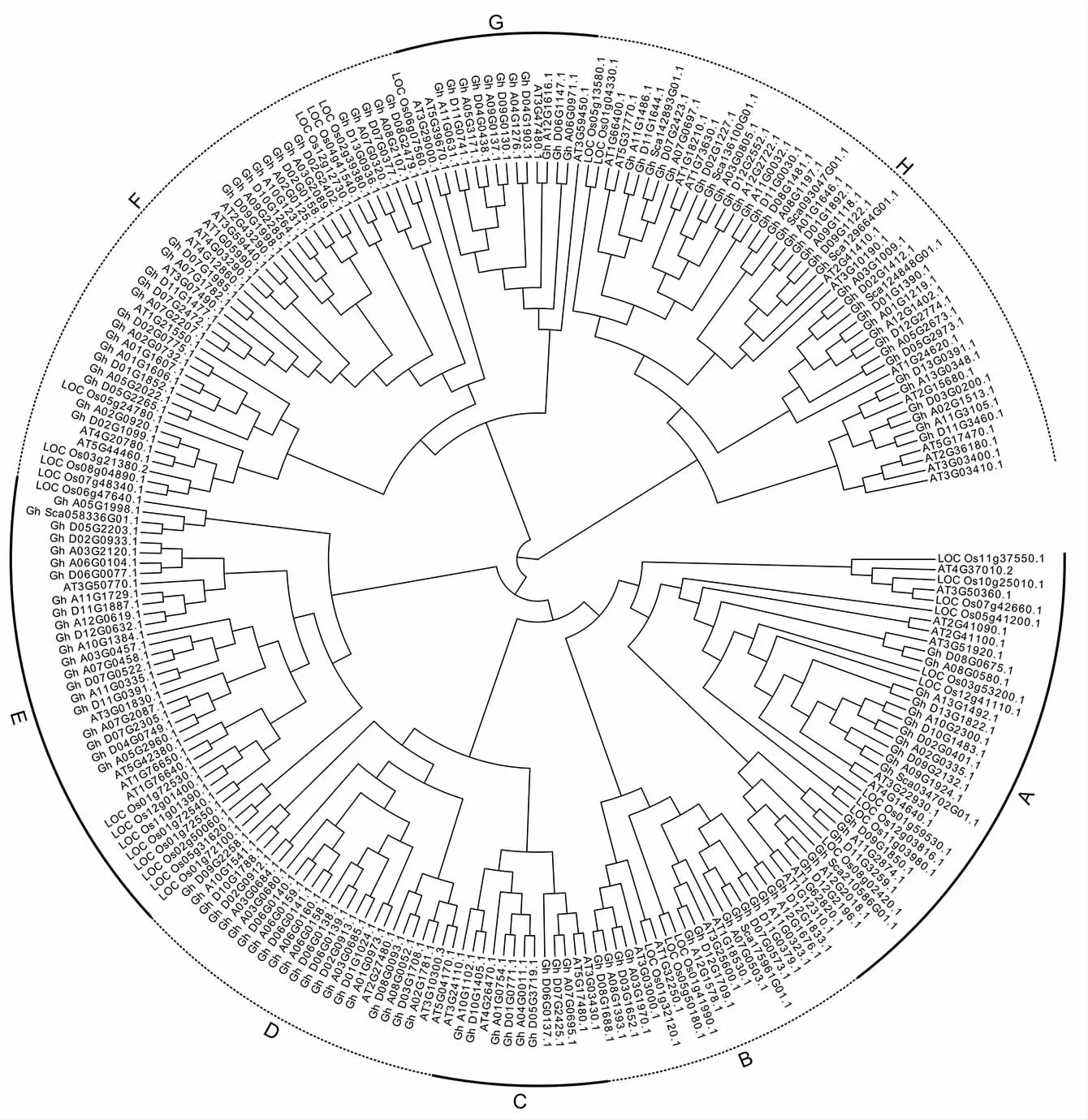
图1 拟南芥、水稻、陆地棉CML家族基因的系统进化树Fig.1 Phylogenetic tree of CML family genes in Arabidopsis thaliana , Oryza sativa L.and Gossypium hirsutum L.

图2 亚洲棉、陆地棉、雷蒙德氏棉CML家族基因系统进化树Fig.2 Phylogenetic trees of CML family genes of Gossypium hirsutum L., G.raimondii Ulbrich and G.arboreum L.
2.3 陆地棉CML家族蛋白保守结构分析
CML蛋白家族的保守结构域已在拟南芥、水稻等多个模式植物中被鉴定分析。拟南芥中的50个和水稻的32个CML家族成员都具有保守的EF-hand结构域。本研究通过CDD数据库对154个陆地棉CML家族蛋白进行保守结构查询,结果如图3所示,该家族所有蛋白都具有高度保守的EF-hand结构域,且除该结构域外,没有其他已知功能的结构域。
2.4 陆地棉CML家族基因染色体定位分析
根据棉花基因组信息,对154个陆地棉CML基因进行了染色体定位分析(图4)。结果发现有130个CML基因定位于26条染色体上,24个不能明显定位于任何染色体,而是存在于scaffold上,且基因在染色体上的分布相对不均匀,一些染色体和染色体区域,有高密度的基因分布。D02染色体有最多的基因分布。有趣的是,许多基因成簇分布,特别是在 A7、A11、D06、D11染
色体的顶部和A12、D09、D12染色体的底部。基因在染色体上的这种不平衡分布表明遗传变异存在于进化过程中。
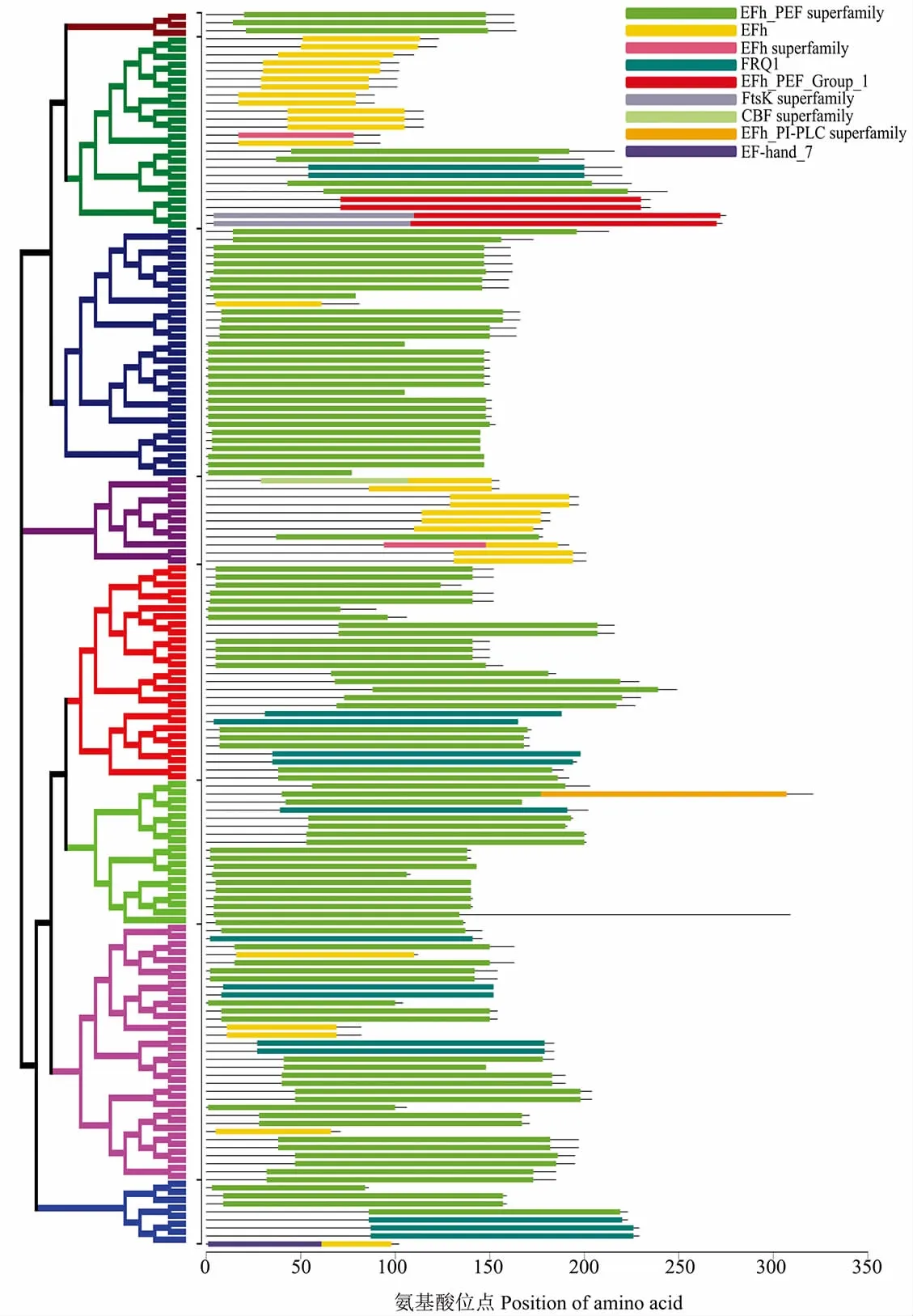
图3 陆地棉CML家族蛋白序列的保守结构域分析Fig.3 Conserved domain analysis of CML family protein sequences in upland cotton
2.5 顺式作用元件分析
利用Plant CARE软件对GhCML基因启动子区上游1 500 bp的序列进行了分析,发现的顺式作用元件包括ABA反应元件(ABRES)、低温应答元件(LTRS)、防御和应激反应元件(TC-rich repeats)、水杨酸应答元件(TCA-element)、MeJA-应 答 元 件(TGACG-motif)、MYB- 结 合 位 点(MBS)。 然而,ABRES、TCA-element和 TGACG-motif属于植物激素反应元件。在GhCML基因启动子中,ABRE是最丰富的顺式作用激素应答元件,100个CML基因成员含有ABRE。GhCML基因上游区域的其他重要顺式作用元件属于环境胁迫相关元件。主要发现3种不同类型的对外部环境胁迫做出反应的顺式作用元件,它们是低温应答型(LTR)、应激应答型(TC-rich repeats)和干旱响应型(MBS)。总共有79个CML基因成员含有 TC-rich repeats,41 个成员包含 MBS,41 个成员包含LTR。推测外源环境胁迫可通过其响应顺式作用元件诱导GhCML基因的表达,进一步提高植物对环境胁迫的抗性。
2.6 陆地棉CML基因盐胁迫表达聚类分析
利用转录组数据对盐胁迫下154个GhCML基因的表达模式进行分析(图5)。其中,只有107个基因在盐胁迫下差异表达,且在叶和根中表达情况不同。
根据转录组数据,选择14个差异表达的GhCML基因,利用qRT-PCR进行表达模式分析,结果见图6。在盐胁迫下,14个CML基因在根和叶中的表达量不同,叶中上调表达的基因数量明显多于根中上调表达的基因数量;在盐处理12 h 时,GhCML35-4、GhCML10-1、GhCML25-3、GhCML42-4GhCML44-3、GhCML25-5 等基因在叶中的表达量最高,而GhCML49、GhCML44-1、GhCML44-6在根中的表达量最高。GhCML44-2、GhCML44-7在叶中的表达量明显高于根中,且在3 h时最高。在叶和根中,相同的基因具有不同的表达模式,例如GhCML44-2基因在叶中不同时间点均上调,而在根中明显下调。GhCML19-5在根中48 h明显上调表达,而在其他组织和时间点均下调表达。以上结果显示,GhCML基因以不同的方式参与盐胁迫应答,且具有组织特异性。
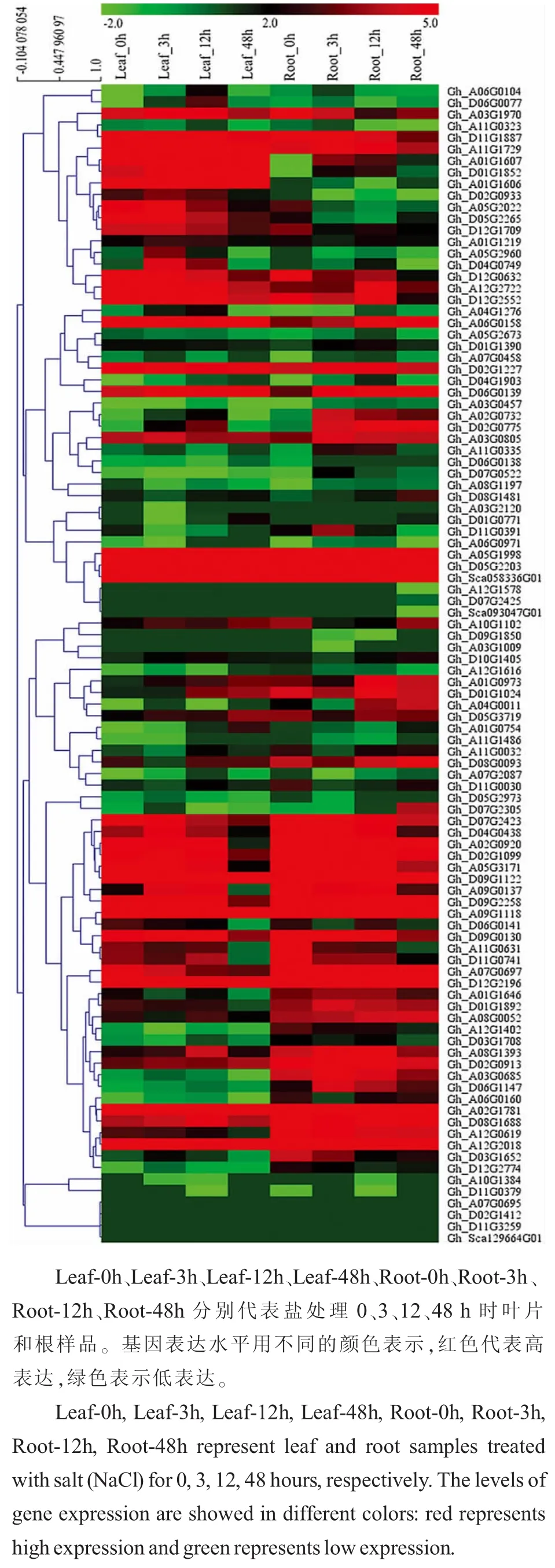
图5 陆地棉CML家族基因在棉花组织中的表达分析Fig.5 Expression analysis of CML family genes in upland cotton

图6 盐处理(300 mmol·L-1NaCl)不同时间棉花根、叶中14个 GhCML 基因的表达情况Fig.6 Expression of 14 GhCML genes in cotton roots and leaves at different times after NaCl treatment(300 mmol·L-1)
2.7 陆地棉CML44-2基因在棉花中功能验证
侵染棉花植株10 d后被侵染棉花幼苗逐渐白化,20 d后再次观察,发现植株仍存在白化现象,证明指示基因在棉花幼苗中沉默成功,且效果稳定(图7A)。分别初步验证正常植株、TRV2空载、GhCML44-2沉默后棉花植株的基因表达量,结果(图7B)显示,正常植株和TRV2空载植株基因表达量无明显变化,而GhCML44-2沉默后植株的基因表达量显著降低,证明植株沉默成功。
盐胁迫处理48 h后,发现GhCML44-2基因沉默后的植株比对照植株萎蔫严重(图7C),与注射空载菌株的植株相比,SOD酶活性降低,MDA含量大幅升高,而PRO含量降低(图7D~F)。由此推测,GhCML44-2基因参与调控植物SOD酶活性和脯氨酸、丙二醛的合成。
3 讨论与结论
CML是所有真核生物中最保守的主要钙离子传感器蛋白。这类蛋白质通过调节各种靶点在细胞信号网络中发挥关键作用,从而响应植物胁迫应答反应[25]。CML家族在其他作物中的功能研究已经很深入,但在棉花中的研究少有报道。
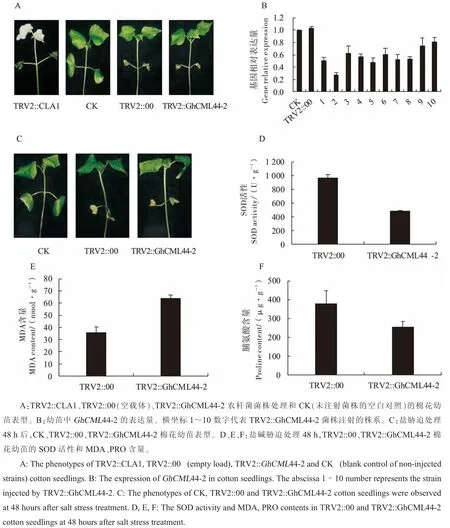
图7 VIGS验证 GhCML 44-2基因的功能Fig.7 VIGS validates the function of GhCML 44-2 gene
本研究从陆地棉、雷蒙德氏棉和亚洲棉中分别鉴定出154、74和78个CML基因,大幅多于拟南芥(50个基因)、水稻(32个基因)。系统发育分析表明,一些GhCML与拟南芥和水稻CML基因具有同源性(图1)。这些研究结果表明在植物CML基因之间存在较近的进化关系。染色体分布分析显示,大多数GhCML基因随机分布在不同的染色体上,一些基因没有定位在任何染色体上。
保守结构域的分析在确定基因功能方面发挥了重要作用[26]。EF-hand是CML蛋白中唯一预测到的结构域,表明该结构域对其功能的重要性和必要性,EF-hand对Ca2+结合和运输具有重要的作用[16,25-26]。本研究发现所有GhCML基因家族成员中均存在EF-hand结构域(图3),这一结果与之前在拟南芥和水稻中的报道一致[16,27]。
Ca2+信号转导植物中的一些非生物胁迫,多种刺激均可以诱导CML基因的表达[28-31]。拟南芥CML24在所有主要器官中都表达,在受到黑暗、高温、寒冷、ABA等影响的植物中,转录水平显著升高[15]。本研究顺式作用元件分析显示,GhCML基因启动子均含有响应不同刺激(干旱、盐、低温和激素等)的作用元件。通过转录组和qRT-PCR分析,发现在盐胁迫下多数GhCML基因表达量都有显著的变化,这一结果暗示GhCML基因在响应盐胁迫的过程中发挥作用。此外,本研究表明通过VIGS沉默GhCML44-2基因后棉花植株耐盐能力明显下降。由此推测,GhCML44-2基因可提高棉花耐盐能力。
在CML基因家族中,很多基因已经被研究[32],但还有一些基因未曾被关注,这些基因是否在响应逆境胁迫通路或者在棉花的生长发育过程中具有重要作用,还需要进一步研究。

