HPLC-Q-TOF-MS 法分析百合中酚类化合物
赵康宏, 严思恩, 何英杰, 李大江, 刘东波,4, 谢红旗,4∗
(1.湖南农业大学园艺园林学院,湖南 长沙410128;2.国家中医药管理局亚健康干预技术实验室,湖南长沙410128;3.湖南省宝庆农产品进出口有限公司,湖南 隆回422200;4.湖南省植物功能成分利用协同创新中心,湖南 长沙410128)
百合为百合科植物卷丹Lilium lancifolium Thunb.、百合Lilium brownii F.E.Brown var.viridulum Baker.或细叶百合Lilium pumilum DC.的干燥肉质鳞叶,多用于阴虚燥咳、劳嗽咳血、虛烦惊悸、失眠多梦、精神恍惚等[1],是1 种药食同源兼具园艺观赏性的药材。
百合中[2-4]既含有酚类、皂苷、多糖、生物碱等活性成分,又含有蛋白质、氨基酸、纤维素等营养成分;其中植物多酚是1 种植物次生代谢产物,具有显著的抗氧化活性[5]。由于体外抗氧化活性评价实验具有易操作、低成本等优点,目前常通过DPPH、ABTS、FRAP 等方式评价化合物体外抗氧化活性[6-7],另外,由于HPLC 可以对化合物进行分离与定量,酚类化合物与DPPH 和ABTS 反应后的峰面积会出现显著降低或是消失[8-10],因此通过DPPH/ABTS+·-HPLC 联用可快速判断单个化合物是否具有抗氧化能力[11]。此外,随着HPLC-MS 技术的发展,通过化合物碎片离子提供的信息,为对其定性分析提供了1 种快速、准确的方法。目前对百合中酚类化合物的体外抗氧化评价、HPLC-MS 分析的研究报道较多,但通过体外抗氧化评价及体外抗氧化与HPLC 联用并结合HPLC-MS 定性分析的方式未见报道。
本研究采用3 种体外抗氧化活性评价方式及DPPH/ABTS+·-HPLC 联用对百合中酚类化合物进行活性评价并基于HPLC-Q-TOF-MS 对其定性分析[12],以期评价百合中酚类化合物抗氧化能力并对其进行定性分析,为进一步研究提供参考。
1 材料与方法
1.1 仪器与试药
1.1.1 材料 湖南省龙山县龙山百合和隆回县龙牙百合均购自湖南省宝庆农产品进出口有限公司,经唐其副教授(湖南农业大学) 鉴定为卷丹Lilium lancifolium Thunb.和百合Lilium brownii F.E.Brown var.viridulum Baker.。
1.1.2 试药 甲醇、乙腈为色谱纯(德国Merck 公司);碳酸钠、福林酚、没食子酸、抗坏血酸、过硫酸钾、冰醋酸、FeCl3、乙醇(均为分析纯,上海国药集团试剂有限公司);2,4,6-三吡啶基三嗪(TPTZ)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸) 二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH) 均购自美国Sigma 公司;蒸馏水。
1.1.3 仪器 UV-1800 (日本Shimadzu 公司); HPLC(1260) -Q-TOF-MS(美国Angilent 公司);KM5200DV 超声仪(昆山超声仪器有限公司);XS205 分析天平(瑞士Mettler toledo 公司)。
1.2 供试品溶液制备 将2 种百合分别打粉后过60 目筛,将靳磊等[13]的方法稍加修改,提取条件为物液比=1 ∶20,提取时间30 min,提取温度40 ℃,pH 7,提取溶剂80%乙醇,抽滤后再次提取,合并滤液,浓缩并将所得提取液用80%乙醇定容至100 mL 备用。
1.3 总多酚含有量测定 总多酚含有量测定采用福林酚法,将Jin L 等[7]的方法稍加调整,用蒸馏水配制质量浓度0.1 mg/mL 的没食子酸标准品溶液,精密移取0、0.2、0.4、0.6、0.8、1.0 mL 于10 mL 量瓶,分别加入2.0 mL蒸馏水摇匀,再加入0.5 mL 福林酚试剂,摇匀静置5 min后加入1.0 mL 15% Na2CO3溶液,摇匀并用蒸馏水定容,于765 nm 处测定吸光值A(GA),样品取1.0 mL 测定。
1.4 抗氧化活性评价
1.4.1 抗坏血酸母液配制 将抗坏血酸用蒸馏水配置成10.0 mmol/L 母液备用。
1.4.2 DPPH 清除率测定 用甲醇配置40 μg/mL DPPH 溶液,将“1.4.1” 项下抗坏血酸母液稀释200 倍后,依次移取1.0、2.0、3.0、4.0、5.0 mL 于试管,用蒸馏水补足至5.0 mL,加入5.0 mL DPPH 溶液,摇匀,以5.0 mL 蒸馏水加5.0 mL DPPH 溶液作为对照组A(DC),以5.0 mL 蒸馏水加5.0 mL 甲醇做空白组A(DB)。室温下避光反应30 min后于517 nm 下测定吸光值A(VD),样品取5.0 mL 测定。
1.4.3 ABTS+·抑制率测定 参照张华等[14]的方法配置ABTS+·溶液。将“1.4.1” 项下抗坏血酸母液稀释100 倍,依次取0.5、1.0、1.5、2.0、2.5 mL 于试管,并补足至2.5 mL,然后分别加入5.0 mL ABTS+·溶液避光反应10 min后于734 nm 处测定吸光值A(VA)。以2.5 mL 蒸馏水加5.0 mL ABTS+·溶液做对照组A(AC),以蒸馏水做空白组A(AB),样品稀释5 倍后取1.0 mL 测定。
1.4.4 Fe3+还原能力测定 试剂配制方式参照Perumal Siddhuraju[15]等的方法。将“1.4.1” 项下抗坏血酸母液稀释100 倍,依次取0.2、0.4、0.6、0.8、1.0、1.2 mL 于试管,并补足至2.0 mL,分别加入5.0 mL 反应试剂,混匀后5 min 即可于λ=593 nm 下测定吸光值A(VF)。以2.0 mL蒸馏水加5.0 mL 反应试剂做对照组A(FC),以蒸馏水做空白组A(FB),样品取2.0 mL 测定。
1.5 DPPH/ABTS+·-HPLC 联用抗氧化活性分析[16]
1.5.1 HPLC 条件优化 经色谱条件优化,确定HPLC 条件为Agilent-ZORBAX SB-C18色谱柱(150 mm×4.6 mm,5 μm);流动相0.1%甲酸水(A) -乙腈,梯度洗脱(0 ~5 min,10%~15%B;5~10 min,15%~19%B;10~20 min,19%~22%B;20 ~22 min,22%~25%B;22 ~30 min,25%~40%B;30~31 min,40%~10%B;31 ~40 min,10%B);体积流量0.8 mL/min;柱温25 ℃;检测波长315 nm;进样量10 μL。
1.5.2 DPPH-HPLC 联用分析 精密移取“1.2” 项下供试液1.0 mL 于10 mL 离心管,加入1.0 mL 40 μg/mL DPPH 溶液,摇匀避光反应30 min 后引入HPLC 中,另各取1.0 mL 供试液加入1.0 mL 蒸馏水作对照组。
1.5.3 ABTS+·-HPLC 联用分析 精密移取“1.2” 项下供试液1.0 mL 于10 mL 离心管,分别加入ABTS+·溶液1.0 mL,摇匀避光反应10 min 后引入HPLC 中,另各取1.0 mL 供试液加入1.0 mL 蒸馏水作对照组。
1.6 HPLC-Q-TOF-MS 联用 色谱条件采用“1.5.1” 项下条件。 质谱条件采用负离子模式电喷雾电离离子源(ESI-);TOF 质量扫描范围m/z 100 ~1 700;载气温度300 ℃;体积流量8 L/min;雾化压力241.3 kPa;鞘气温度350 ℃;体积流量11 L/min;毛细管电压3 500 V;碰撞诱导解离电压175 V;设置碰撞能量梯度为10、20、30 V。
2 结果与分析
2.1 总多酚含有量UV 测定 以没食子酸质量为横坐标(X),吸光值为纵坐标(A),得回归方程A=9.766 3X+0.060 1(R2=0.999 0);总多酚含有量,隆回县龙牙百合为(3.88±0.10) mg/g;龙山县龙山百合为(7.79±0.07)mg/g。2 种百合总多酚含有量差异明显。
2.2 体外抗氧化活性评价 2 种百合通过3 个体外抗氧化活性实验,结果见表1,2 种百合中的酚类化合物都具有一定抗氧化能力。等量龙山百合(卷丹) 总多酚的抗坏血酸当量DPPH 清除能力是龙牙百合 (百合) 的2.19 倍,ABTS+·清除能力是1.72 倍,Fe3+螯合能力则是4.12 倍。三项测定结果存在差异,这可能与2 种百合中所含酚类化合物的种类不一致有关,并且这些酚类化合物与氧化剂的亲和力存在差异,但都表明百合中的酚类化合物具有显著的抗氧化活性。

表1 1.0 mg 总多酚的抗坏血酸当量抗氧化能力
2.3 DPPH/ABTS+·-HPLC 联用抗氧化分析 2种百合中的酚类化合物液相色谱图及其与DPPH/ABTS+·反应后引入HPLC 中的液相色谱图见图1,分别从龙山、龙牙百合中检测出9 个、7 个酚类化合物,在与DPPH 和ABTS 反应后,各个峰峰面积都出现了不同程度降低,但是龙牙百合中峰6 和7 在与DPPH 反应时未表现出明显活性,与ABTS反应后下降显著。龙山百合与DPPH/ABTS+·反应前后HPLC 中各个峰面积变化柱状图见图2,结果表明龙山百合中的9 个酚类化合物与2 种氧化剂都有亲和力,都出现了明显降低;龙牙百合与DPPH/ABTS 反应前后HPLC 中各个峰面积变化柱状图见图3,结果表明龙牙百合中的酚类化合物与ABTS 亲和力强于与DPPH 的亲和力。 “2.2” 项下结果表明,2 种百合中等量总多酚的抗坏血酸当量抗氧化能力具有显著差异,并且,该差异的倍数关系不固定,通过DPPH/ABTS-HPLC 柱前衍生进一步表明,2 种百合中由于所含酚类化合物的种类不同,各个化合物与氧化剂亲和力各异,导致等量总多酚抗氧化能力具有显著差异。此外,龙牙百合中化合物7 与龙山百合中化合物9 保留时间一致,但前者在与DPPH 反应时不表现出亲和力,而后者则表现出较弱亲和力,通过龙山百合中各个化合物与DPPH 反应强度可以发现,化合物9 与DPPH 的亲和力较差,2 种百合中同一化合物出现该差异,推测是由于其自身与DPPH 结合能力较差,在龙牙百合中含有量较低,在与其他化合物竞争时未表现出明显活性。

图1 各样品HPLC 色谱图
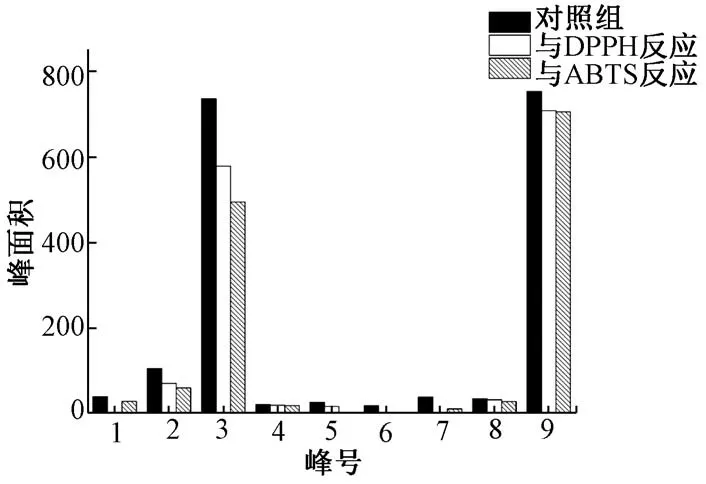
图2 龙山百合与DPPH/ABTS 反应后峰面积变化情况柱状图

图3 龙牙百合与DPPH/ABTS 反应后峰面积变化情况柱状图
2.4 HPLC-Q-TOF-MS 联用定性分析 实验采用负离子模式对2 种百合中的酚类化合物进行扫描,图4 是龙牙百合和龙山百合在负离子模式下的总离子流图,总离子流图中分别扫描出14 个和20 个化合物。分别对2 种百合中丰度较大的化合物做MS/MS 分析,相关离子信息见表2。
表2 中,化合物LSND 和LYND 的准分子离子峰m/z 都是232,MS/MS 裂解信息一致,但保留时间有一点差异,推测为同一化合物或是同分异构体。以化合物LSND 为例,[M-H]-=232.137 1; [A-H2O]-=146.099 5 这可能是香豆素脱去一分子水形成,[A-H2O-CO2]-=102.070 1 也可能是其离子碎片,与文献[17] 报道的1-O-p-香豆素甘油酯相似,推测该化合物分子式为C13H14O4,HPLC 中未检测到,结构见图5(1)。

图4 各样品HPLC 色谱图和总离子流图

表2 酚类化合物精确分子量及二级质谱碎片信息
化合物LS2、3、4 和LY2、3、5 的准分子离子峰m/z都是399,保留时间相近,并且其MS/MS 碎片信息基本一致,这3 个化合物可能是同分异构体。以化合物LS2 为例,[M-H]-=399.156 0,[A1-H]-=163.057 8,香豆素精确分子质量为164.16,在负离子模式下会丢失1 个H, [A1-COOH·-H]-=117.047 6,[A2-H2O]-=145.041 8,这可能是香豆素发生脱羧和脱水后的离子碎片,与文献[17] 报道的1-O-咖啡酸-3-O-p-香豆素甘油酯一致,分子式C21H20O8,结构见图5(2)。
化合物LS1 的准分子离子峰为m/z 415.151 8,化合物LY1 与其相近,但龙牙百合的二级质谱信息干扰较大,因此分析LS1 的碎片信息,化合物LS1 有2 个丰度较大的离子碎片,[A1-H]-=179.056 3 和[A2-H]-=163.042 3;[A1-H]-为咖啡酸m/z 180.14 失去1 个H, [A1-H-COOH·]-=134.014 4 是咖啡酸脱去1 个羧基形成, [A2-H]-是香豆素m/z 164.16 失去1 个H, [A2-H-COOH·]-=117.102 2 是香豆素发生了脱羧反应,并且甘油基团中C3 原子上的1 个H 可能被1 个-OH 取代,该化合物未见报道,推测分子式C21H20O9,命名为1-O-p-香豆素-3-O-咖啡酸-3-羟基甘油酯,结构见图5(3)。
化合物LS5 的准分子离子峰为m/z 429.168 0,只在龙山百合中检出,MS/MS 碎片信息为[A1-H]-=193.069 4,是阿魏酸m/z 194.19 丢失1 个H 形成, [A2-H-COOH·]-=134.053 3 可能是咖啡酸的裂解碎片,但并未找到[A2-H]-=179.012 4 的相关信息,仅推测该化合物可能是文献[17]报道过的1-O-咖啡酸-3-O-阿魏酸甘油酯,结构见图5(4)。
化合物LS7 的准分子离子峰m/z 457.164 6,只在龙山百合中检出,MS/MS 碎片信息为[M-H-C3H7O·]-=397.147 0,表明这个化合物依然有可能是对位取代的酚性甘油酯,并且甘油基团中可能存在1 个双键,[A1-H]-=179.053 1 可能是咖啡酸失去1 个H 形成,[A1-2H-COOH·]-=133.045 6 可能是咖啡酸失去2 个H 后发生脱羧形成的碎片离子; [A2-H-2OCH3·]-=161.043 6 可能是芥子酸失去1 个H 再脱去2个-OCH3形成的碎片,该化合物未见报道,仅推测其可能是1-O-咖啡酸-3-O-芥子酸甘油酯,分子式C23H22O10,结构见图5(5)。
化合物LS8 的精确分子量m/z 163.055 2,只在龙山百合中检出,与文献[17] 报道的p-香豆素一致,结构见图5(6)。
化合物LS9 和LY7 的准分子离子峰m/z 都是441,且保留时间比较接近,考虑为同一化合物或是同分异构体,其MS/MS 碎片信息也基本一致,以化合物1 为例,[A-H]-=163.057 9, [A-H-H2O]-=145.046 2, [A-H-COOH·]-=117.049 5 符合香豆素质谱裂解规律,[2 A-2H+C3H6O]-=381.149 2 表明是与一分子甘油对位取代, [M-H]-=381.149 2,表明甘油基团上可能有1 个H 被一分子-COOCH3取代,则分子式可能是C23H22O9,命名为1,3-Op-香豆素乙酸甘油酯,结构见图5(7)。
综上,龙山百合HPLC 中峰1-9(峰6 含有量过低,在做MS/MS 分析时杂离子干扰太大) 分别鉴定为1-O-咖啡酸-3-O-p-香豆素甘油酯(LS1)、1-O-p-香豆素-3-O-咖啡酸-3-羟基甘油酯(LS2、3、4 推测其是同分异构体)、1-O-咖啡酸-3-O-阿魏酸甘油酯(LS5)、1-O-咖啡酸-3-O-芥子酸甘油酯(LS7);p-香豆素(LS8)、1,3-O-p-香豆素乙酸甘油酯(LS9);龙牙百合HPLC 中峰1-7(峰4、6 在MS 中未检测到) 分别是1-O-咖啡酸-3-O-p-香豆素甘油酯(LY1)、1-O-p-香豆素-3-O-咖啡酸-3-羟基甘油酯(LY2、3、5 推测其为同分异构体)、1,3-O-p-香豆素乙酸甘油酯(LY7)。另外,2 种百合中都含有1-O-p-香豆素甘油酯,但在HPLC中未检测到。
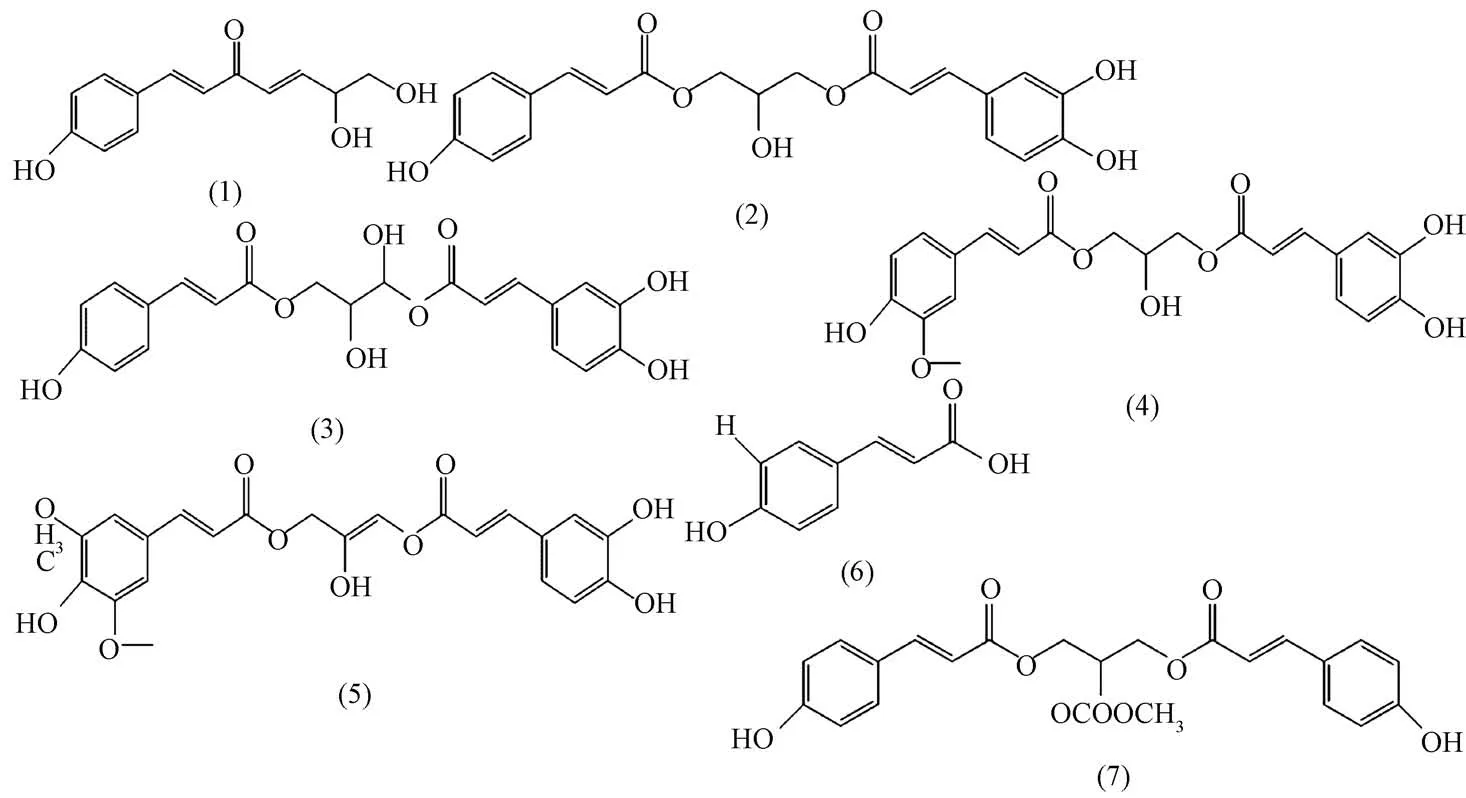
图5 MS/MS 推测各化合物结构式
3 讨论与结论
百合作为重要药材与食材,分布范围广泛且品种繁多,对其化合物含有量及种类产生较大影响,湘产百合是中国百合的一个重要品种,本研究旨在对湖南省两个具代表性产地的百合中具抗氧化能力的酚类化合物进行分析,通过采用3 个体外抗氧化活性评价方式,发现两地所产百合都具有较强的抗氧化能力,这与之前相关研究[18-20]中对其他产地百合酚类化合物抗氧化活性评价相似,并且,两种百合1.0 mg 总多酚抗坏血酸当量抗氧化能力差异显著,龙山县产百合活性更强,表明两种百合都具有作为抗氧化食品或药品开发的潜力;另外通过DPPH/ABTS+·-HPLC 柱前衍生在线抗氧化活性评价实验发现两种百合中的酚类化合物种类不一样,可能是导致其与氧化剂的结合能力有明显差异的重要原因。
此外,由于质谱可以快速、准确地对化合物定性分析,并且酚类化合物是天然产物表现活性的重要组分,关于酚类化合物的研究开发是目前天然产物药用价值及食品开发领域的重要方向,因此,百合中酚类化合物的质谱研究已受到多方关注,这些研究不仅表明百合中含有多种酚类化合物,也表明这些酚类化合物种类及含有量与产地具有较大相关性,Wang 等[21]通过对6 种可食用分属7 个产地的9个百合样本定量分析结果表明,即使是同属百合,当处于不同产地种植时,总多酚含有量也具有一定差异,不同种百合的含有量差异也很明显;并且,研究中通过HPLC-QTOF-MS 分析指出这些产地百合中含有11 种单体酚化合物,会随着产地及品种的差异而产生差异。本研究通过MS/MS分析,表明百合中的酚类化合物是以多酚-甘油酯复合体的形式存在,从中一共鉴定出7 个化合物。
通过DPPH/ABTS-HPLC 联用可以快速分析天然产物具有抗氧化能力的组分,并通过HPLC-Q-TOF-MS 可以快速对具抗氧化能力的组分进行定性分析,但本实验中量效关系并不具体,希望在进一步的研究中通过联合串联质谱对其做精确定量分析,此外,对单个化合物的抗氧化评价也需要通过采用等质量浓度的标准品予以精确表征。

