不同产地刺五加UPLC 指纹图谱
王东晗, 梁宇飞, 张欣欣, 赵丽艳, 李亚鑫, 张丹参, 张万明
(河北北方学院药学系,河北省神经药理学重点实验室,河北 张家口075000)
刺五加为五加科植物刺五加Acanthopanax seuticosus(Rupr.et Maxim.)Harms 的干燥根、根茎及茎,又名五加参、西伯利亚参,别名刺拐棒、老虎潦、一百针等[1]。刺五加主要分布在我国北方的东三省、河北和山西。其性味辛、温、微苦,有益气健脾、补肾安神的功效,常用于治疗脾肺气虚、体虚乏力、食欲不振、肺肾两虚、久咳虚喘、肾虚腰膝酸痛、心脾不足、失眠多梦[2]。现代药理学研究表明, 刺五加具有抗肿瘤[3-5]、 抗抑郁[6-7]、 抗 疲 劳[8]、 扩 张 心 脑 血 管[9]、 免 疫 调节[10-11]等作用。于丽云等[12]通过高效液相色谱法测定了不同生长年限、不同环境、不同部位刺五加中异嗪皮啶的含有量;姚慧敏等[13]采用超高效液相色谱-紫外检测器同时测定了野生刺五加中紫丁香苷、绿原酸、刺五加苷E、异嗪皮啶和槲皮素-3-鼠李糖苷的含有量。几种化学成分表征中药质量的质控方法,无法全面表征中药材化学成分群的整体性和复杂性,难以全面控制刺五加的内在质量[14]。中药指纹图谱立足于中药化学成分系统研究,在中药材及中药制剂的质量控制与评价方面应用广泛[15-16]。已有的对刺五加指纹图谱的研究中[17-18],所建立的HPLC 指纹图谱分析时间长,药材选用的产地比较少,没有很好的代表性。本研究收集了24 批刺五加样品来源于主产地,建立其UPLC 指纹图谱,共有峰数目多,分析时间大大缩短,并对不同产地该药材进行比较,以期明确各产地药材相似度,为其质量控制奠定基础。
1 材料
1.1 仪器 Waters ACQUITY 超高效液相色谱仪(自动进样器,在线脱气系统,二极管阵列检测器,Empower3 色谱工作站, 美国Waters 公司);ME235P 型电子分析天平(1/10 万,德国Sartorius公司);UPT-I-60 L 优普系列超纯水机(成都超纯科技有限公司); 电热恒温鼓风干燥箱DHG-9140AS(宁波江南仪器厂);GAOKE 旋转蒸发仪(巩义市英峪高科仪器厂);Sigma4-15 低速冷冻离心机(美国Sigma 公司);CY-5000 型数控超声波发生器(宁波新芝仪器有限公司)。
1.2 试药 异嗪皮啶对照品 (批号110837-201608,含有量100.0%)、原儿茶酸对照品(批号110809-201205,含有量99.9%)、绿原酸对照品(批号110753-201716,含有量99.3%) 均购自中国食品药品检定研究院;紫丁香苷对照品(批号16060805,含有量大于98%,上海安奈德化学技术中心)。乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。刺五加样品来源于该药材主产地黑龙江、吉林、辽宁、河北、山西等地,见表1。经河北北方学院中药研究所马淑兰教授鉴定为正品,刺五加药材于电热恒温鼓风干燥箱中干燥后,中药粉碎机粉碎,过3 号筛,备用。
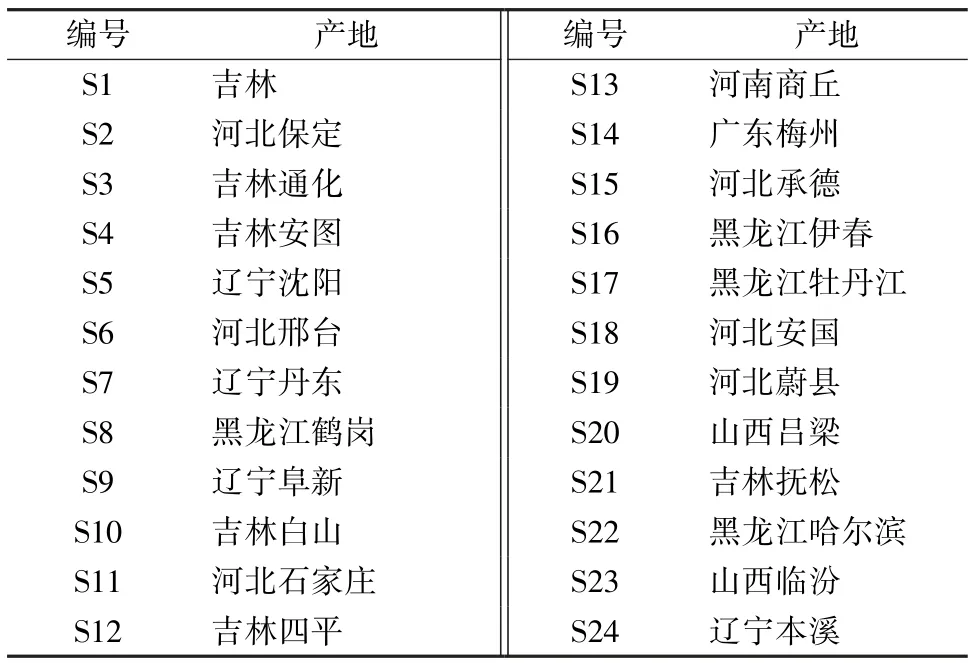
表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 色谱条件 Waters BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相乙腈(A) -0.3%冰乙酸水溶液(B),梯度洗脱(0 ~7 min,95%→80%B;7 ~11 min,80%→70%B;11 ~12 min,70%→60%B);检测波长为原儿茶酸257 nm、绿原酸324 nm、紫丁香苷267 nm、异嗪皮啶220 nm;体积流量0.3 mL/min;柱温30 ℃;进样量2 μL。
2.2 供试品溶液制备 精密称定各产地刺五加粉末1 g, 置于锥形瓶中, 加入72%甲醇15 mL,67 ℃超声(功率560 W) 提取2 次,2 h/次,合并上清液,旋转蒸发至干燥,再用10 mL 20%乙醇溶解,备用。
2.3 对照品溶液制备 精密称取原儿茶酸、绿原酸、紫丁香苷和异嗪皮啶对照品各适量,用20%乙醇溶解并稀释成质量浓度分别为118、198、186、98 μg/mL 的溶液,作为贮备液,备用。
2.4 方法学考察[19]
2.4.1 精密度试验 精密称定吉林产刺五加药材粉末适量,按“2.2” 项下方法制备供试品溶液,在“2.1” 项色谱条件下,连续进样6 针,以紫丁香苷的色谱峰为参照峰,得17 个共有峰相对保留时间和相对峰面积RSD 分别小于1.0%、2.0%,表明该仪器精密度良好。
2.4.2 稳定性试验 精密称定吉林产刺五加药材粉末适量,按“2.2” 项下方法制备供试品溶液,室温放置,在“2.1” 项色谱条件下,分别于0、3、6、9、12、15 h 进样2 μL。以紫丁香苷色谱峰为参照峰进行测定。17 个共有峰在15 h 内的相对峰面积RSD 小于3.0%,相对保留时间RSD 小于1.0%,表明供试品溶液在15 h 内稳定性良好。
2.4.3 重复性试验 精密称取同一产地刺五加药材粉末(产地吉林) 6 份,按“2.2” 项下方法制备供试品溶液,在“2.1” 项色谱条件下进样,以紫丁香苷为参照峰,得到刺五加药材17 个共有峰的相对峰面积和相对保留时间的RSD 分别小于5.0%、1.0%,表明该方法重复性良好。
2.5 指纹图谱建立[19-20]
2.5.1 共有峰标定及参照峰选择 精密称取24 批不同产地样品粉末各1 g,按“2.2” 项下方法制备供试品溶液,在“2.1” 项色谱条件下进样,提取各产地刺五加335 nm 处的色谱图,将色谱图导入“中药色谱指纹图谱相似度评价系统软件(2012 版) ”,生成指纹图谱共有模式和对照指纹图谱,并标定共有峰17 个,见图1 ~2。精密吸取混合对照品溶液进行测定,通过与对照品保留时间比对,指认了指纹图谱17 个共有峰中的原儿茶酸(1 号峰)、绿原酸 (5 号峰)、紫丁香苷 (6 号峰)、异嗪皮啶(11 号峰),见图3。6 号峰紫丁香苷峰形好,峰面积稳定,分离度较好,且为刺五加中主要药理活性成分之一,故选定为UPLC 特征图谱的参照峰。以紫丁香苷为参照峰,计算17 个共有峰相对保留时间和相对峰面积,结果见表2~3。

图1 24 批样品UPLC 指纹图谱Fig.1 UPLC fingerprints of twenty-four batches of samples
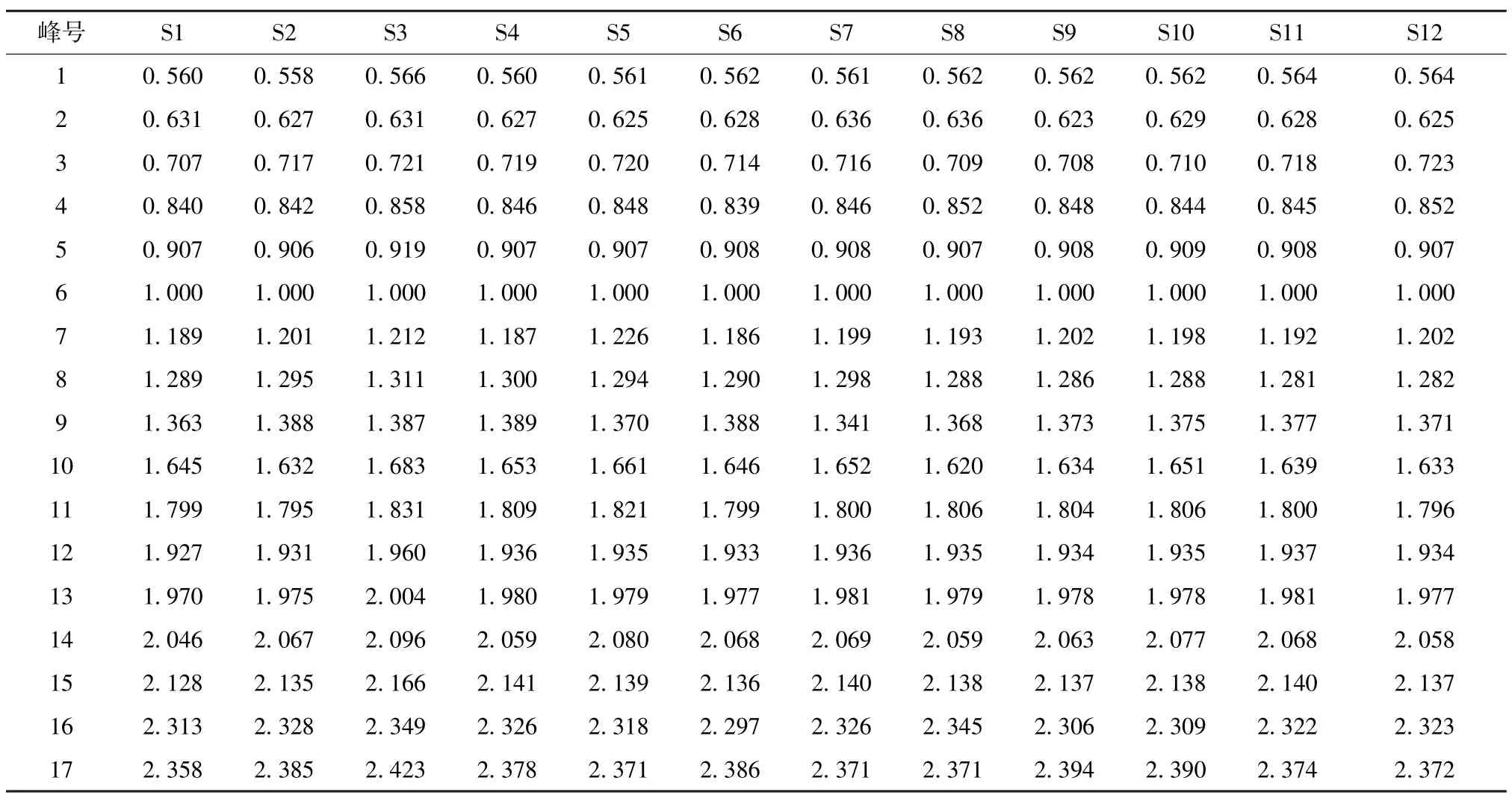
表2 24 批样品共有峰相对保留时间Tab.2 Relative retention time of common peaks of twenty-four batches of samples
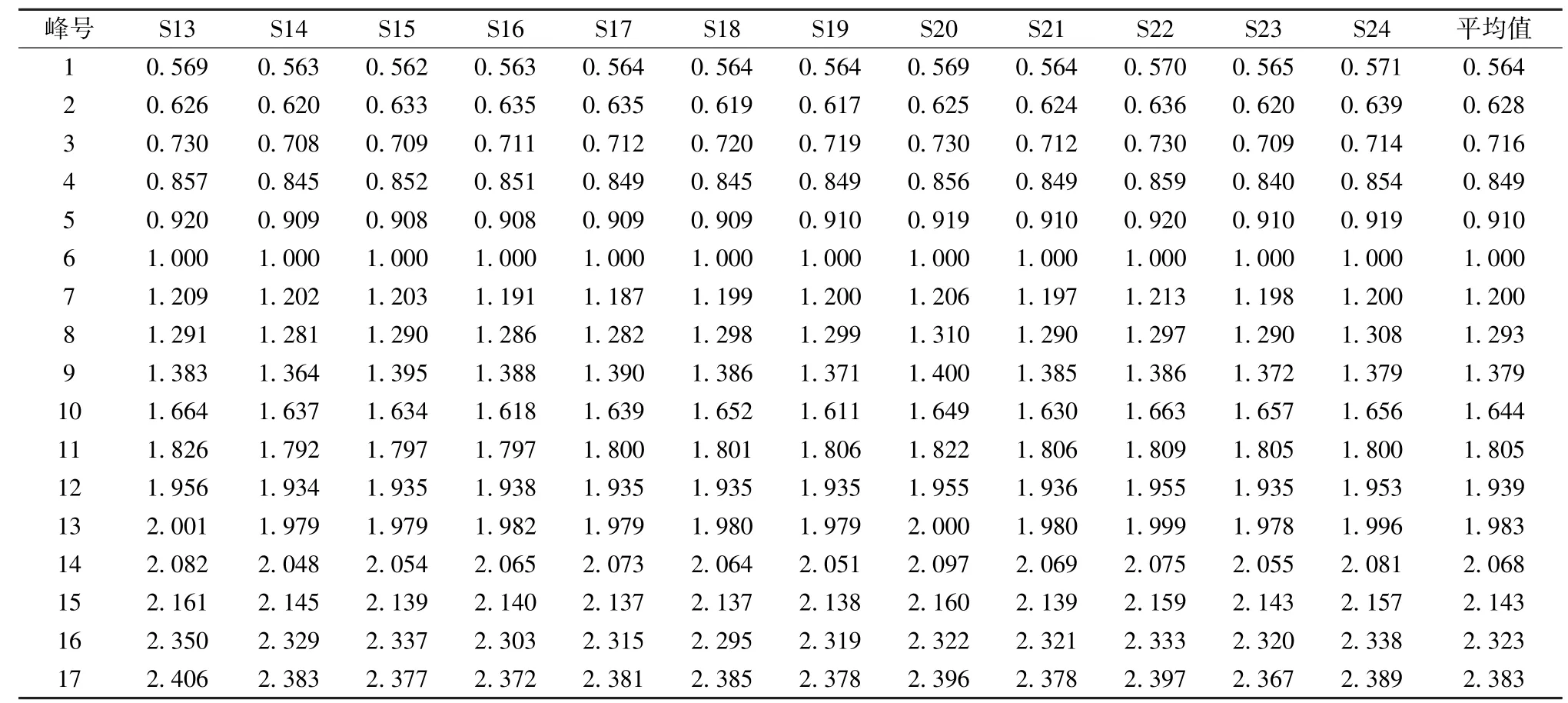
续表2

表3 24 批样品共有峰相对峰面积Tab.3 Relative peak areas of common peaks of twenty-four batches of samples
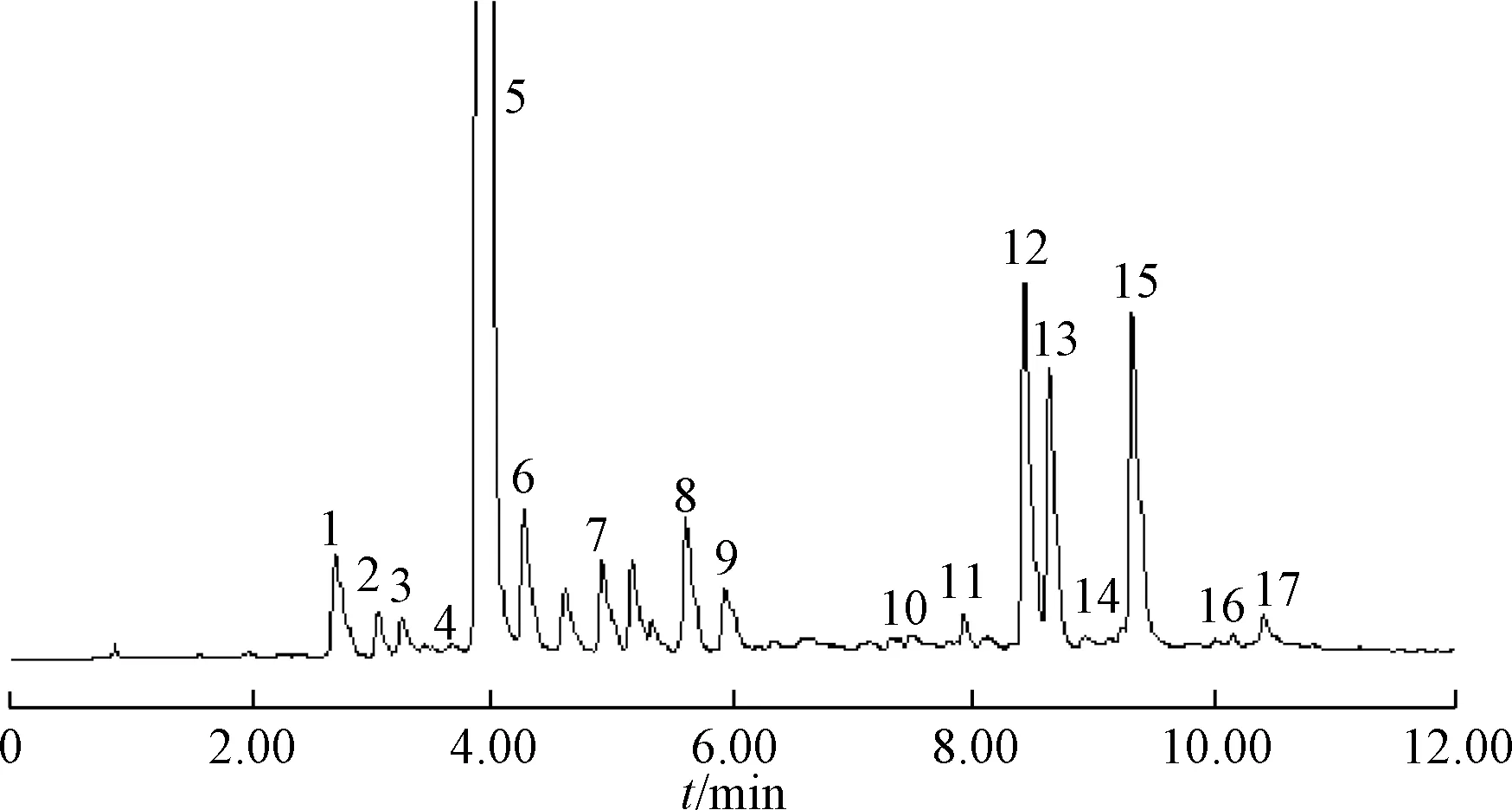
图2 样品对照UPLC 指纹图谱Fig.2 Reference UPLC fingerprint of samples
2.5.2 相似度评价 应用“中药色谱指纹图谱相似度评价系统软件 (2012 版) ” 对24 批样品UPLC 指纹图谱进行相似性分析,结果表明,16 批样品的相似度在0.950 以上,其余8 批相似度小于0.950,表明不同产地间的刺五加具有一定的差异性。见表4。
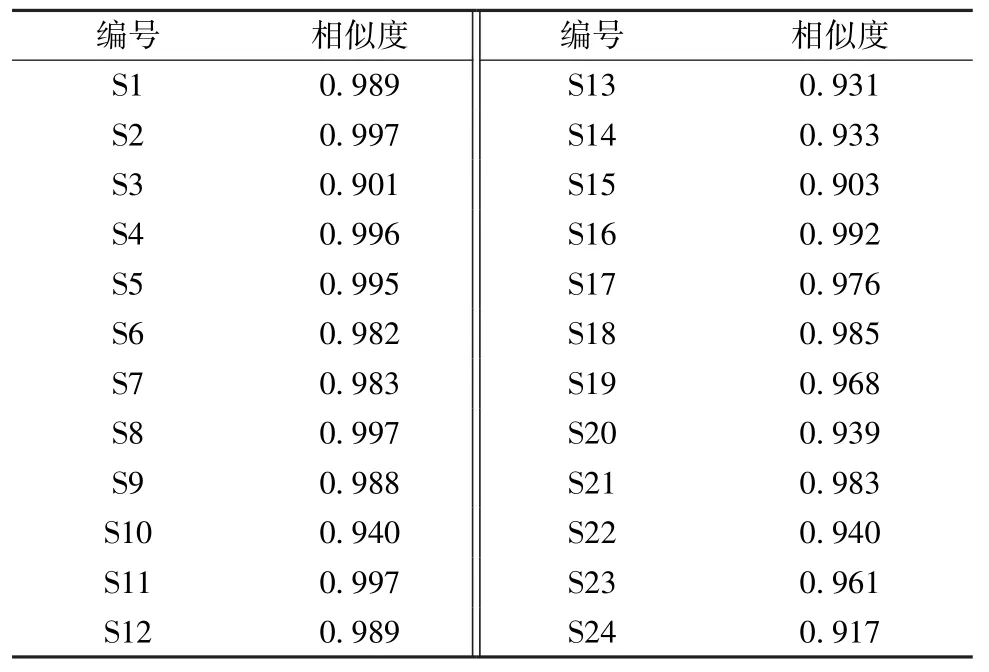
表4 24 批样品相似度Tab.4 Similarities of twenty-four batches of samples
2.5.3 聚类分析 以所测24 批样品中标定的共有峰峰面积为变量,运用SPSS 21.0 统计学软件中的离差平方和法进行聚类分析,标准化数据选择全距从0~1,样品测度选择平均欧氏距离,见图4。结果表明,24 批样品被分为4 类,S1、S2、S4、S5、S8、S9、S11、S16 聚为一类;S12、S15、S24 聚为一类;S14 单独为一类;其余样品聚为一类,此结果与指纹图谱相似度分析结果相似。
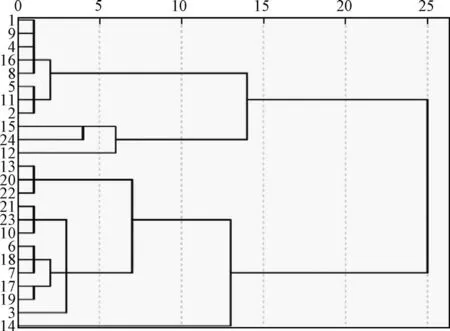
图4 24 批样品聚类树状图Fig.4 Dendrogram of twenty-four batches of samples
3 讨论
本研究在样本收集方面覆盖了多数刺五加产地,包括河北、山西、黑龙江、吉林、辽宁等。样本收集具有地域代表性、收集范围广泛,从而确保了刺五加药材指纹图谱生成的科学性。
在单因素考察的基础上运用Box-Behnken 中心组合设计,以提取时间、提取温度和甲醇体积分数为自变量,进行3 因素3 水平响应面优化设计,最终确定了“2.2” 项下刺五加供试品溶液的制备方法。
在刺五加药材的指纹图谱研究中,应用光电二极管阵列检测器比较了在210 ~400 nm 之间不同扫描波长对吸收峰的数量、强弱及分离情况。结果表明,在335 nm 检测波长下,吸收峰数量多、峰强度大、各色谱峰分布均匀、峰形大小合适、基线平稳,可以表达刺五加各类成分的出峰情况。此外,还比较了乙腈-水、甲醇-水、乙腈-0.1%磷酸水、乙腈-0.1%冰乙酸水、乙腈-0.2%冰乙酸水等不同流动相进行梯度洗脱时峰的分离度和峰形。显示乙腈-0.3%冰乙酸水为流动相时峰的分离度与峰形良好。实验时,以梯度洗脱程序运行12 min,为确保色谱图基线的稳定,每次进样前用初始流动相平衡5 min。
本研究首次对刺五加药材UPLC 指纹图谱进行了相似度评价和聚类分析,标定了17 个共有峰,4个已确认成分;通过对比不同产地刺五加指纹图谱的相似度发现,24 批样品相似度存在一定差异;聚类结果将24 批样品分为4 类。分析结果显示,不同产地刺五加药材受地域影响较大。该方法专属性强、精密度高、重复性好,操作简便,有利于确保产品质量的稳定、均一,以期为刺五加的质量控制提供指导和依据。

