水苏碱在乙醇中的纳滤分离行为
李存玉, 李贺敏, 支兴蕾, 刘莉成, 李红阳, 彭国平∗
(1.南京中医药大学药学院,江苏南京210023;2.江苏省中药资源产业化过程协同创新中心,江苏南京210023)
以乙醇为代表的有机溶剂在中药制药领域中应用广泛,但衍生出的提取物、萃取物、洗脱部位在进行精制纯化时,高温处理所带来的成分转化会严重影响目标产物质量,同时因回收溶剂比例变化而难以循环利用, 造成资源浪费、 环境污染[1]。1993 年高从堦院士首次提出常温化精制的纳滤分离技术[2],其截留分子量在100 ~1 000 Da 之间,分离特点与超滤、微滤有所不同,因其膜材质表面的荷电性,分离过程为电荷、位阻、溶解-扩散效应等多种效应综合的结果[3-4],但针对有机溶液环境下中药成分的纳滤精制研究尚处于探索阶段[5]。
水苏碱是益母草中主要药效成分[6],在光照和长时间加热下均会降解,影响制剂质量的同时也造成药用资源的浪费,在对其进行色谱分离时制得以乙醇为洗脱液的中间体,大多采取低温减压回收来控制成分的降解,但生产效率偏低。本实验探索纳滤技术对乙醇中水苏碱富集的适用性,并结合膜面溶胀特征阐明该成分的分离规律,为明确有机溶液环境下纳滤分离机制提供参考依据。
1 材料
1.1 试药 复合聚酰胺纳滤膜(孔径150、475、800 Da,南京拓鉒医药科技有限公司)。盐酸水苏碱对照品(批号110773-201313,中国食品药品检定研究院)。益母草提取物(自制,益母草饮片加水提取后色谱分离制备得到, 水苏碱含有量>70%)。乙腈为色谱纯;其他试剂均为分析纯。
1.2 仪器 TNZ-1 型纳滤分离设备(南京拓鉒医药科技有限公司);e2695 高效液相色谱仪(美国Waters 公司);ELSD 6000 检测器(美国Alltech 公司);MS105 电子天平[十万分之一,梅特勒-托利多仪器(上海) 有限公司]。
2 方法
2.1 溶液制备
2.1.1 对照品溶液 精密称取盐酸水苏碱对照品3.60 mg,置于5 mL 量瓶中,流动相超声溶解,定容至刻度,即得(每1 mL 含0.72 mg 该成分)。
2.1.2 供试品溶液 益母草提取物用不同体积分数乙醇配制成5.0%、17.5%、30.0%,其中盐酸水苏碱质量浓度为105.0 μg/mL。
2.2 纳滤分离 采用前期建立的方法[7],按照图1 组装纳滤膜、中压泵等纳滤装置,设置操作压力为1.0 MPa。将纳滤膜置于分离系统中,纳滤分离初始阶段需要药液在纳滤膜中循环平衡,排除因膜材质对成分吸附的干扰,待盐酸水苏碱与膜组件之间的吸附、解吸附达到平衡时,从储液罐中取样平衡液,进而开始纳滤,纳滤液罐收集纳滤液,待样品纳滤分离至无法维持系统分离时,关闭纳滤系统,纳滤液中取样纳滤液。
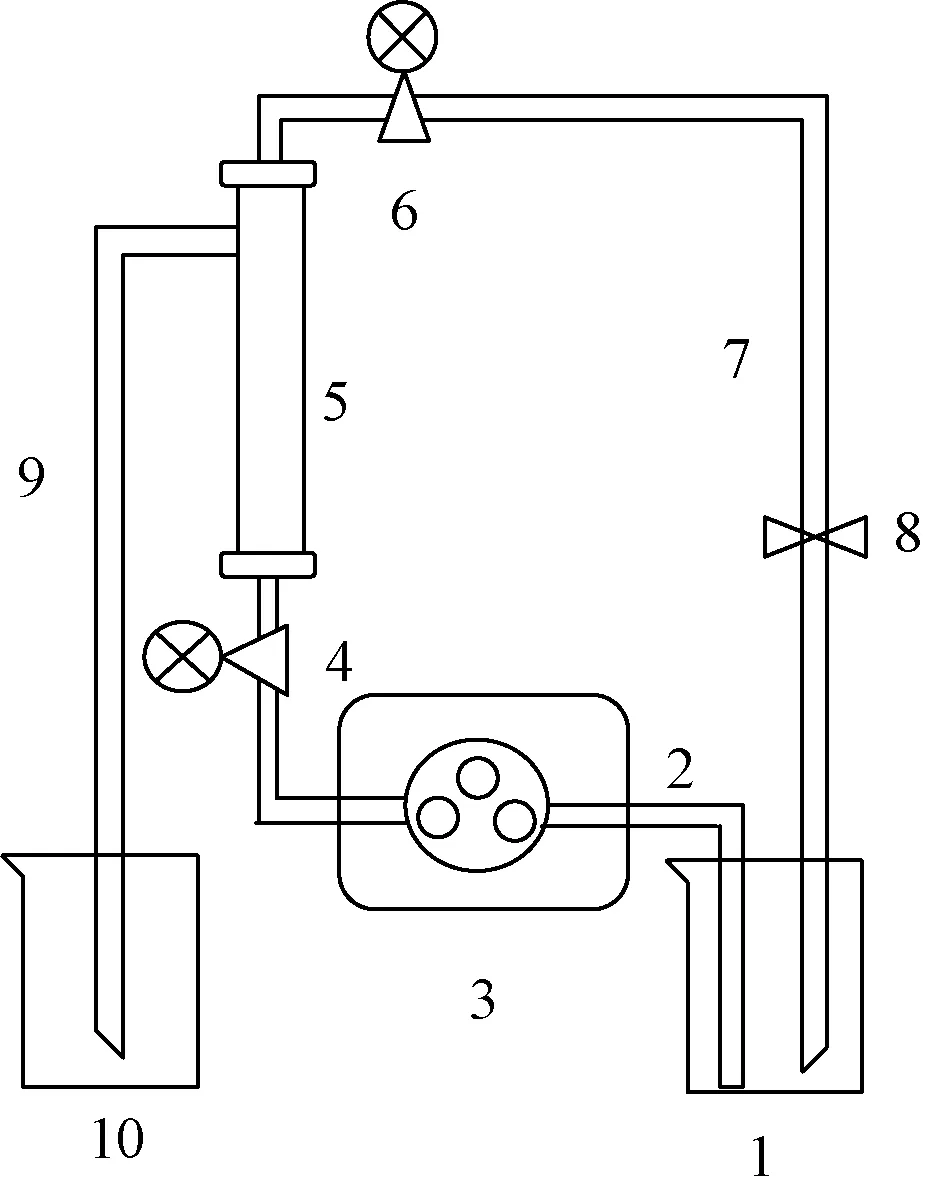
图1 纳滤分离设备Fig.1 Nanofiltration separation equipment
2.3 盐酸水苏碱含有量测定
2.3.1 色谱条件[8]Waters Xbridge Hilic 色谱柱(4.6 mm×150 mm,3.5 μm);流动相乙腈-0.2%冰醋酸(80 ∶20)。蒸发光散射检测器参数为漂移管温度80 ℃,气体体积流量2.0 L/min;体积流量0.8 mL/min。
2.3.2 线性关系考察 精密吸取对照品溶液1、2、5、10、20 μL,在“2.3.1” 项色谱条件下进样测定。以峰面积(Y)、进样量(X) 取对数进行回归,得方程为Y=0.56X+4.60(R2=0.999 5),在0.72~14.4 μg 范围内线性关系良好。
2.4 截留率计算 取纳滤分离制备的纳滤液(C1) 及平衡液(C2),测定峰面积并取对数后代入“2.3.2” 项下回归方程,计算盐酸水苏碱含有量,按照式(1) 计算截留率(R)。

2.5 水苏碱分离数据积累 应用Design-Expert 8.06软件[9],考察乙醇体积分数(A)、pH 值(B)、膜孔径(C) 对盐酸水苏碱纳滤分离行为的影响,以截留率(Y)为评价指标。因素水平见表1。

表1 因素水平Tab.1 Factors and levels
2.6 纳滤分离层溶胀分析 为了排除膜污染带来的干扰,在操作压力1.0 MPa 条件下分别选择空白水溶液及5%、7.5%、30%乙醇,考察膜面因溶胀带来的通量衰减变化,见式(2)、 (3)。其中,J0为初始通量,单位m/s;Jt为单位时间t 时的膜通量,单位m/s;m 为膜通量衰减系数。
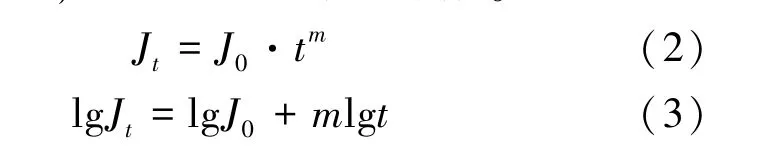
3 结果
3.1 纳滤分离数据积累 根据响应面分析原理[10-11],为保障实验结果的准确性和稳定性,每组平行3 次,取平均值,结果见表2。

表2 试验设计及结果Tab.2 Design and results of tests
3.2 模型拟合 对各因素进行二次多项回归拟合,得方程为Y=39.44-7.26A-4.77B-19.04C+2.43AB+2.96AC-3.23BC+20.52A2+38.28B2+2.20C2,方差分析见表3。由表可知,各因素影响程度依次为C>A>B;P<0.000 1,表明模型极显著;多元相关系数R2=0.985 7,预测R2=0.824 8,调整R2=0.967 3,表明模型拟合度良好。
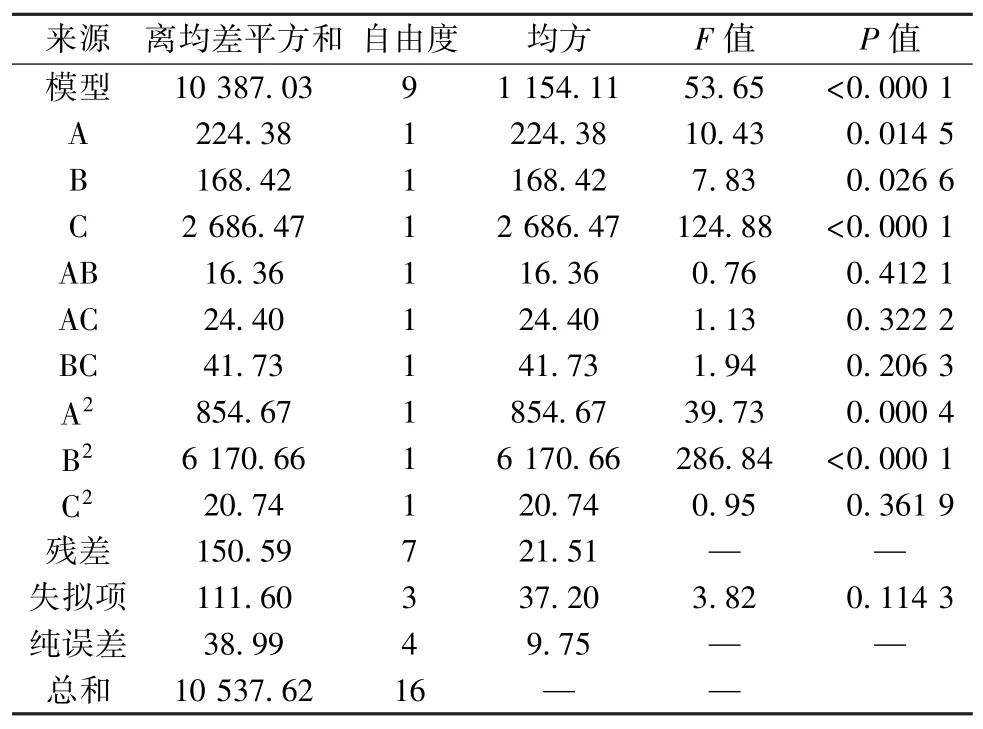
表3 方差分析Tab.3 Analysis of variance
3.3 因素分析 图2 显示,在固定膜孔径、乙醇体积分数时,随着pH 值逐渐升高,截留率呈先下降后升高的趋势,并在30%乙醇中最明显,推测水苏碱两性结构中碱性、酸性基团解离状态不同,pH 增加时碱性基团阳离子首先过渡至化合物等电点,然后在碱性环境中羧基解离成阴离子,再结合纳滤分离的电荷效应[12];在固定pH 值、乙醇体积分数时,截留率随着孔径增加而降低,分离规律符合孔径筛分规律;在固定pH 值、膜孔径时,乙醇体积分数对截留率的影响呈不同的调节规律,在酸碱极端环境下,乙醇可增强纳滤膜截留效率,但在中性至弱碱条件下,反而会促进成分纳滤透过。
表2、图2 显示,水苏碱中的羧基在强碱性条件下以钠盐形式存在,与纳滤膜电荷排斥效应明显,在475 Da 纳滤中的截留率高于80%,乙醇体积分数从5%升至30%时,截留率由82.32%升至91.48%;在酸性条件下,水苏碱以盐酸盐形式存在,乙醇体积分数从5%升至30%时,截留率由95.22%升至96.29%,推测碱性条件下该成分可能未完全解离,纳滤分离时产生的电荷排斥效应弱于酸性条件。
3.4 膜溶胀分析 表4 显示,随着乙醇体积分数增加,衰减系数绝对值也随之升高,相较于水溶液环境,乙醇体积分数增加至5%时单位时间内膜通量衰减明显,随着其升高通量衰减加剧,但超过17.5%后衰减系数相对稳定,表明膜溶胀程度已趋于稳定[13]。
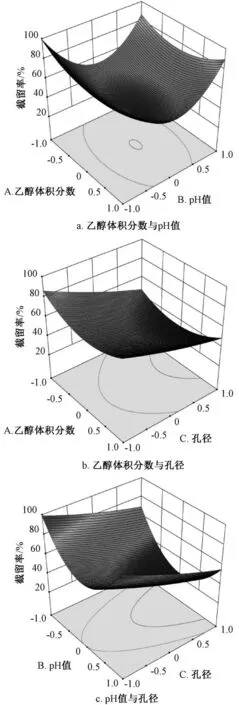
图2 各因素响应面图Fig.2 Response surface plots for various factors
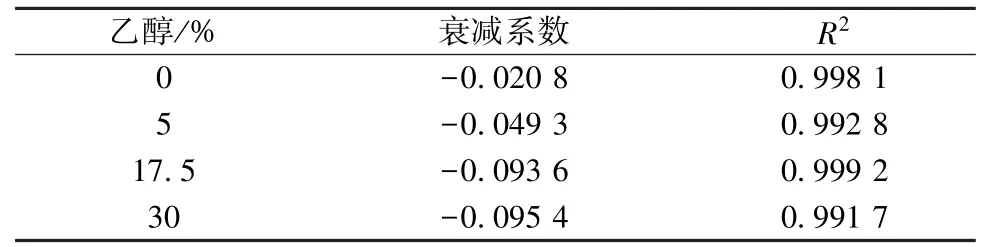
表4 不同乙醇体积分数下纳滤膜衰减系数Tab.4 Decay coefficients of nanofiltration membranes under different ethanol concentrations
4 讨论
随着溶液环境由水逐步向有机相过渡,成分状态、膜面分离层物化性质、成分的跨膜传质行为均发生变化,进而引起分离行为变化[14-15]。其中,在酸、碱性条件下乙醇体积分数增加引起的水苏碱截留率升高,表现出不同程度“强化” 截留率的行为,而且其升高程度并不完全是由膜面溶胀引起的。同时表2 显示,在150 Da 纳滤膜中,pH 7.0下乙醇体积分数从5%升高至30%时,截留率由81.87%降低至70.42%,即乙醇体积分数升高引起膜溶胀加剧,水苏碱截留率反而下降,与上述结果相悖,推测两性生物碱纳滤跨膜传质机制可能与成分存在状态相关。
纳滤分离的经典模型大多基于水溶液环境建立,其适用性有待于验证,本实验中水苏碱纳滤截留行为随着乙醇体积分数、pH 值变化的现象仅靠电荷效应、位阻效应等分离模型无法得到有效解释。对水苏碱存在状态进行分析,发现随着溶液pH 由酸性向碱性环境的过渡,该成分呈现出酸、碱性基团解离-游离的转换状态,当两性基团正负电荷数值相等时,即为等电点。由此推测,酸、碱性条件下水苏碱在乙醇中的解离基团随着溶剂体积分数升高,其溶解度逐步降低,而游离态基团溶解度变化随之相反,从而表现出类表面活性剂性质,并通过分子间缔合团聚的形式在溶液中存在,故在纳滤过滤时“强化” 截留率是由膜面溶胀和分子团聚综合引起的。另外,在水苏碱等电点附近呈电中性状态,由于乙醇可降低分子间表面能,促进多分子团聚态状态向低分子团聚态或单分子态转移,而且此时单分子、低分子团聚态水苏碱比例高于水溶液环境,故此时“削弱” 截留率的行为可能是由存在状态结构大小、膜面溶胀引起的。
对水苏碱跨膜传质过程进行分析,推测在含有乙醇的水溶液环境中,等电点时水苏碱可能更容易接近膜分离层而通过纳滤膜,同时因分子间作用力差异,乙醇与复合聚酰胺材质作用力大于水分子,推测纳滤膜表面乙醇体积分数可能稍高于溶液内部。因此,解离态水苏碱因溶解度与乙醇体积分数呈反比,并在膜面电荷排斥的协同作用下难以进入膜分离层,从而呈现出高截留率现象。
有机溶剂的合理回收和循环利用有助于中药制药企业实现节能减排,但分离机制有待于进一步完善。本实验对两性化合物水苏碱在乙醇中的纳滤分离行为进行分析,今后将结合分离规律建立纳滤传质模型,从而为提升化学成分在有机溶液环境中的适用性、研制耐有机溶剂纳滤膜提供技术支撑。

