不同浓度NaCl处理对灰绿藜种子萌发及幼苗生长发育的影响
任家博 闻志彬
(1.喀什大学生命与地理科学学院,喀什 844006; 2.中国科学院新疆生态与地理研究所,乌鲁木齐 830011)
土壤盐渍化会影响到非盐生植物的生长发育甚至大量死亡,造成局地生物多样性降低,影响生态平衡,也会使农作物产量降低,对粮食安全产生严重威胁[1]。随着土壤盐渍化问题逐渐加剧,研究者在植物耐盐机制、耐盐种质资源开发和盐渍化土壤改善等方面进行了大量研究,而了解植物的耐盐机制、选择合适的耐盐植物对盐碱地改良工作具有重要意义[2~8]。
我国盐生荒漠植被的建群种中,藜科植物居多[9],藜科植物在适应以及改善盐渍化土壤方面具有一定优势。灰绿藜(ChenopodiumglaucumL.)为藜科(Chenopodiaceae)藜属(Chenopodium)的一年生草本植物,广布于南北半球的温带,我国除台湾、福建、江西、广东、广西、贵州、云南诸省区外,其它各地都有分布,常分布于轻度盐碱的土壤上[10~12]。灰绿藜种子萌发受盐浓度和pH影响,同样浓度的NaHCO3对种子萌发的抑制作用大于NaCl[13~14]。盐胁迫会影响灰绿藜叶片中水分和脯氨酸含量[15],导致组织中MDA含量增加,细胞膜的透性变小[16~17],其耐盐性与NHX1基因的表达相关[18]。以往关于灰绿藜耐盐性的研究都只对其进行了某一阶段(如萌发或生长)的实验,而缺少对其进行系统性的研究[13~14,19~20]。因此,本实验拟开展不同浓度NaCl处理对灰绿藜种子萌发、幼苗生长发育,以及根、茎和叶中Na+浓度影响的研究,以期探索灰绿藜耐盐能力,并为抗盐碱种质资源的开发利用提供参考。
1 材料与方法
1.1 种子采集与材料处理
灰绿藜种子于2017年10月3日采自新疆乌鲁木齐市新市区鲤鱼山公园的自然成熟植株。种子自然风干后,置于4℃冰箱中冷藏28 d后开始萌发实验和生长实验。
1.1.1 种子萌发
实验设置9个不同浓度NaCl处理,即0、50、100、150、200、250、300、400和500 mmol·L-1。
在培养皿(直径9 cm;垫有3层定性滤纸)中加入相应浓度NaCl溶液,播种40粒。每个处理包括4个生物学重复。培养皿置于植物培养架上,光强3 000 lx,光照周期为16/8 h(昼/夜),温度25℃/23℃(昼/夜),实验过程中适当补充相应的蒸馏水。播种6 d后开始记录灰绿藜种子萌发数,每3~4 d记录一次,连续观察34 d。
1.1.2 幼苗生长发育
实验浓度梯度设置与1.1.1相同。选择蛭石∶珍珠岩=3∶1作为基质,将基质以1 L/盆的量加入花盆(顶部直径16 cm,底部直径12 cm,高11 cm)中,以1/2 MS培养基作为营养液。种子萌发后每3 d用对应浓度的NaCl溶液处理一次,每个处理包括5个生物学重复。萌发10 d后在每盆中保留1株长势一致的植株。用400和500 mmol·L-1NaCl处理后,初萌发的幼苗均枯萎,因此该实验最终处理浓度为0、50、100、150、200、250、300 mmol·L-1。之后每3~4 d测一次植株高度和叶片数,并在实验中观察记录开花日期、叶型及其他随机出现的有用信息。待肉眼可见各组株高和叶片数差异明显时(萌发后第61 d),测植株高度、茎粗(下至上1 cm处)、根长、根粗(上至下1 cm处)和叶片数,并测定各部分的生物量及Na+含量。
1.2 实验方法
1.2.1 生物量的测定
实验结束后,将植株移出洗掉根部吸附的基质,并将植株分为根、茎和叶三部分,在烘箱中110℃杀青30 min后60℃烘干至恒重,测其质量,并密封保存以备进行Na+含量的测定。
1.2.2 Na+含量的测定
分别取0、50、100、150、200和250 mmol·L-1NaCl处理的根、茎和叶干样(300、400和500 mmol·L-1NaCl处理下植株样本较少,不足以进行Na+含量测定),单独用真空袋包装送至中国科学院新疆生态与地理研究所中心实验室进行Na+含量测定。检测设备及型号:离子色谱仪(美国戴安ICS-5000)、电感耦合等离子发射光谱(美国安捷伦735 ICP-OES)。测试报告编号:XJSDSSJZX20120626。
1.2.3 数据分析
数据分析采用SPSS软件,用One-way ANOVA在0.05水平上进行差异显著性检验并在此之后进行多重比较。
2 结果与分析
2.1 对灰绿藜种子萌发的影响
随着NaCl处理浓度的增大,灰绿藜种子萌发率呈下降趋势,其中50和100 mmol·L-1浓度处理间没有显著差异,而当NaCl处理浓度大于150 mmol·L-1后对种子萌发率也没有显著差异。当NaCl处理低于200 mmol·L-1时,种子萌发时间均为6 d,当处理浓度大于200 mmol·L-1,种子萌发时间则随着处理浓度的增大而推迟。随着NaCl浓度的增加,单位时间内种子萌发数量呈降低趋势,首粒种子萌发的时间会相应延长(图1)。

图1 不同浓度NaCl处理下灰绿藜种子萌发率与时间的关系Fig.1 Relationship between the germination rate and time in Chenopodium glaucum L. under different contents of NaCl
2.2 对灰绿藜幼苗生长发育的影响
从表1~2可看出,灰绿藜的株高、茎粗、根长、根粗、叶片数及根、茎和叶的鲜重、干重在50 mmol·L-1NaCl处理下有最大值,而在300 mmol·L-1NaCl处理下有最小值。
不同浓度NaCl处理下,灰绿藜的株高、茎粗、根长、根粗、叶片数、根部鲜重、根部干重、茎部鲜重、茎部干重、叶片鲜重和叶片干重均具有显著差异(P<0.05),多重比较结果见表1~2。发芽后第37 d,150和300 mmol·L-1NaCl处理下各有1株植株开花;发芽后第44 d,150和250 mmol·L-1NaCl处理下各有1株植株开花;发芽后第59 d,200 mmol·L-1NaCl处理下有1株植株开花。0、50和100 mmol·L-1NaCl处理下,灰绿藜在发芽61 d内无开花现象。
表1 不同浓度NaCl处理对灰绿藜植株生长的影响
Table 1 Effects of different NaCl contents on growth ofC.glaucumL. seedlings
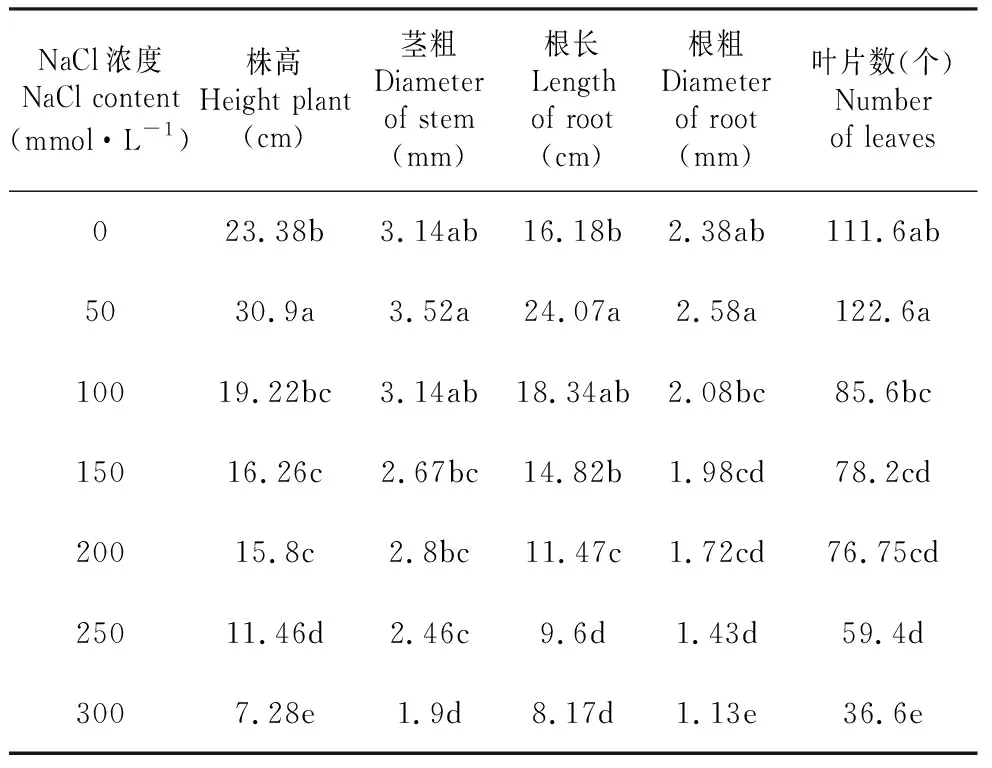
NaCl浓度NaCl content(mmol·L-1)株高Height plant(cm)茎粗Diameter of stem(mm)根长Length of root(cm)根粗Diameter of root(mm)叶片数(个)Number of leaves023.38b3.14ab16.18b2.38ab111.6ab5030.9a3.52a24.07a2.58a122.6a10019.22bc3.14ab18.34ab2.08bc85.6bc15016.26c2.67bc14.82b1.98cd78.2cd20015.8c2.8bc11.47c1.72cd76.75cd25011.46d2.46c9.6d1.43d59.4d3007.28e1.9d8.17d1.13e36.6e
注:表中标有不同字母表示差异显著(P<0.05),下同。
Note:Different letters represented signifcant difference at 0.05 level,the same as below.
2.3 对灰绿藜不同器官中Na+含量的影响
灰绿藜根、茎和叶中Na+浓度均在对照中最低,在200 mmol·L-1NaCl处理下最高。在200 mmol·L-1范围内,随着NaCl浓度的增大,茎和叶中Na+浓度呈上升趋势。在不同浓度NaCl处理下,叶及茎中Na+浓度具有显著差异(P<0.05),而根中Na+浓度差异不显著(P>0.05),多重比较结果见表4。

表2 不同浓度NaCl处理下灰绿藜根、茎、叶的鲜重及根、茎、叶的干重
表3 不同浓度NaCl处理下灰绿藜花果混合物的鲜重和干重
Table 3 The freshand dry weight of flower-fruit mixture ofC.glaucumL. under different NaCl content treatments

NaCl浓度NaCl content(mmol·L-1)花果混合物鲜重Fresh weight of flowers and fructifications(g)花果混合物干重Dry weight of flowers and fructifications(g)1500.08580.01472000.01330.00192500.00710.00133000.03750.0067
注:0、50和100 mmol·L-1NaCl处理下未出现开花现象,且150、200、250和300 mmol·L-1NaCl处理下的5个生物学重复中只有1~2个出现开花现象,故在此没有对花果混合物的干重,鲜重进行单因素方差分析。
Note:The plants under 0,50 and 100 concentrations of NaCl were not bloom. And the number of the plants blooming under 150,200,250 and 300 concentrations of NaCl was only 1-2. Therefore,there was no one-way ANOVA on the dry weight and fresh weight of flower and fructifications.
表4 不同浓度NaCl处理后植株根、茎和叶中的Na+含量
Table 4 Na+content in root,stem and leaf of plants under different NaCl content treatments

NaCl浓度NaCl content(mmol·L-1)根中Na+浓度Concentration of Na+ in root(mg·g-1)茎中Na+浓度Concentration of Na+ in stem(mg·g-1)叶中Na+浓度Concentration of Na+ in left(mg·g-1)03.6626b1.1631d1.63d505.8988ab3.1365c11.5507c1006.0657ab5.3026b13.1635c1505.9619ab6.1145b21.1684b2007.0323a8.0539a35.5285a2505.7957ab5.1107b33.2183a
3 讨论
本实验通过研究不同浓度NaCl处理对灰绿藜种子萌发率的影响,发现灰绿藜种子的萌发率在无NaCl处理下最高(图1),且与其他处理之间存在显著差异(P<0.05)。这与陈莎莎等[20]和王璐等[21]的研究结果不同。原因可能在于所选种子成熟度、种子采集后的保存方式以及原植株(母本)的生长环境不同。
在实验过程中观察到,种子萌发后10 d内,在150、250和300 mmol·L-1NaCl处理下,幼苗有萌发后死亡的现象,这表明植物在不同生长阶段对不良环境的适应能力不同[22]。对比萌发实验的结果(灰绿藜种子在超过300 mmol·L-1NaCl处理后萌发率小于5%,500 mmol·L-1NaCl处理后不能正常萌发),得出灰绿藜植株可在高浓度NaCl环境下生长但其种子无法在高浓度NaCl环境下萌发。
当处理浓度大于50 mmol·L-1之后,NaCl对灰绿藜生长造成不利的影响,主要体现在株高、茎粗、根长、叶片数及根、茎和叶质量的减小(表1~2)。这种影响类似于高温或干旱,是由植物细胞的相对缺水而造成[23]。植株面临不利影响时,会尽快将营养生长转化为生殖生长,造成这种转变的原因在于逆境下单个植株通过光合作用产生的营养物质的量低于正常情况,导致植株内部各个器官之间营养物质的分配比例发生变化[24]。植物缩短生长周期的方法能够最大程度上产生可萌发的种子,这对于种群的种子资源具有保护作用,有利于植物克服阶段性恶劣自然环境或短暂气候变化。
灰绿藜属于泌盐盐生植物[25]。NaCl处理会使灰绿藜叶片中Na+浓度大幅增加,这与冯立田等[26]的研究结果一致。另外,NaCl处理也会使灰绿藜的茎中Na+浓度上升,在200 mmol·L-1NaCl处理下,泌出量达到最高值,茎与叶中的Na+浓度之和为对照的15.6倍。可见灰绿藜能够起到改良盐渍化土地的作用。在NaCl浓度超过200 mmol·L-1后,灰绿藜对Na+的泌出量呈下降趋势。因此,如欲利用灰绿藜进行盐渍化土地的改善工作,选择性地将其种植在NaCl浓度接近200 mmol·L-1的盐渍化土地上能够发挥最大作用。

