聚乙二醇干扰素α-2a联合恩替卡韦治疗CHB的效果及对肝功能和肝纤维化的影响
周红,杨凤,王容,唐坤伦,王文平
尽管已研发出兼具安全性与有效性的乙肝疫苗,但乙肝病毒(HBV)感染仍属于全球范围内的严峻公共卫生问题,约有1/4的感染者在5年内进展为慢性乙型肝炎(CHB)[1]。CHB作为常见的肝脏炎性病变,可引起全身多器官功能损害,严重威胁患者生命健康,且该类患者中10%~20%可迅速演变为肝硬化,1%~5%则将发展至原发性肝癌(HCC)[2],由于病情变化具有不可逆性,其预后效果往往令人堪忧。临床多将长期持续性抑制或终止HBV复制为CHB的主要治疗目标,可杜绝或延缓终末期肝病发生,以提高患者生命质量与延长生存时间[3]。目前常用的抗HBV药物主要包括干扰素(IFN)与核苷(酸)类似物(NAs)两大类,恩替卡韦作为后者的代表性药物,其抑制HBV DNA复制疗效的临床研究已开展较多,由于具备耐药率低、安全性良好等优势,已成为CHB抗病毒治疗的首选之一[4]。聚乙二醇干扰素α-2a(PegIFNα-2a)是IFNα与不同分子量Peg连接而成的长效IFN类药物,由于半衰期相较于普通IFN更长,用药剂量与频次均大幅减少,尤其适宜于CHB长期治疗[5]。然而目前临床将两类药物联合作为抗HBV方案的研究仍较少,对肝功能、肝纤维化的改善趋势也不甚清楚,基于此,现观察PegIFNα-2a联合恩替卡韦治疗CHB的临床效果,报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2013年11月—2018年1月四川省遂宁市中心医院感染科诊治CHB患者48例的临床资料,采用PegIFNα-2a联合恩替卡韦方案者纳入联合组(n=27),单用恩替卡韦进行治疗者纳入对照组(n=21)。联合组:男18例,女9例,年龄21~65(35.3±8.2)岁;病程2~20(12.7±5.0)年;血清丙氨酸氨基转移酶(ALT)(180.5±65.2)U/L;HBV DNA水平(7.62±0.54)lg copies/ml;肝硬化16例,黄疸22例,食欲不振19例,脾功能亢进13例;合并糖尿病9例,高血压病15例,高脂血症11例;CHB家族史10例。对照组:男15例,女6例,年龄23~64(36.4±7.8)岁;病程2~19(12.4±4.8)年;血清ALT(173.4±68.1)U/L;HBV DNA水平(7.80±0.55)lg copies/ml;肝硬化14例,黄疸18例,食欲不振17例,脾功能亢进11例;合并糖尿病6例,高血压病11例,高脂血症8例;CHB家族史9例。2组一般临床资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,患者及家属同意并签署知情同意书。
1.2 选择标准 (1)纳入标准:①临床表现及实验室检查结果均符合CHB相关诊断标准及抗病毒治疗指征[6];②年龄18~65岁;③临床资料完整,且对治疗方案知情同意。(2)排除标准:①诊断出重叠感染其他类型肝炎病毒或人类免疫缺陷病毒(HIV);②合并酒精性、脂肪性、药物性肝病或肝胆胰腺肿瘤;③伴有自身免疫性疾病或甲状腺疾病、心脑肺肾疾病,血液系统功能异常;④6个月内有抗病毒、免疫调节药物应用史;⑤对研究所用药物有过敏反应,或治疗时间不足48周;⑥存在认知、精神障碍而无法配合治疗;⑦未能戒断酗酒或吸毒;⑧妊娠期、备孕期或哺乳期妇女。
1.3 治疗方法 所有患者均常规给予抗炎、保肝、抗纤维化及免疫调节治疗,并服用恩替卡韦片(博路定,中美上海施贵宝制药有限公司生产)0.5 mg/次,1次/d;联合组在此基础上联合应用聚乙二醇干扰素α-2a注射液(派罗欣,瑞士Hoffmann-La Roche有限公司生产)180 μg/次,1次/周,2组均持续治疗48周后观察疗效。
1.4 观察指标与方法 清晨空腹采集患者肘静脉血5 ml待测。
1.4.1 转阴率计算: 血清样品采用荧光定量聚合酶链反应(PCR)技术,经由变性、退火、延伸等步骤制备循环模板扩增,以荧光素染色凝胶电泳法检测HBV DNA水平,结合乙肝表面抗原(HBsAg)、乙肝e抗原(HBeAg)/乙肝e抗体(HBeAb)、乙肝核心抗体(HBcAb)在相关治疗指南中的基线水平进行对比[7],计算治疗后转阴情况。
1.4.2 肝功能检测:参考Child-Pugh肝功能分级标准评估患者肝功能[8],分别对肝性脑病分期、腹水分度、TBil水平、Alb水平、凝血酶原时间(PT)延长情况进行整合计分,每项严重程度均以1~3分计算,将5~6分者归为A级,7~9分者归为B级,≥10分者归为C级,分数或级别越高表示肝功能越差。
1.4.3 肝纤维化检测:清晨空腹采集患者肘静脉血5 ml待测,4℃低温下充分凝血反应30 min,离心提取血清保存于-80℃冰箱待测,采用血清层黏连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、透明质酸酶(HA)对应酶联免疫吸附试验(ELISA)试剂盒(均购自R&D Systems公司)检测,严格按照其说明书进行,并在酶标仪中读取吸光度值,绘制标准曲线并计算对应指标的待测浓度;应用肝脏瞬时弹性检测仪,于患者平卧状态下,测定右腋前线与腋中线之间的第7~9肋间,以25~65 mm深度的肝脏剪切波通过速率重复测量10次,计算均值为肝脏硬度(LSM)值(正常参考范围2.8~7.4 kPa,代偿期肝硬化7.4~12.3 kPa,进展期肝硬化12.4~17.3 kPa,确诊肝硬化≥17.4 kPa)。
1.4.4 细胞免疫指标检测:清晨空腹采集患者肘静脉血5 ml待测。经由抗体标记、红细胞裂解、避光温育、离心、重悬等操作后,以流式细胞仪检测CD4+、CD8+、自然杀伤(NK)细胞(CD2+CD3-CD16+CD56+),计算CD4+/CD8+比值。
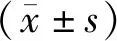
2 结 果
2.1 2组转阴率比较 治疗48周后,联合组HBV DNA转阴率明显高于对照组,差异有统计学意义(P<0.05),而2组HBsAg、HBeAg/HbeAb、HBcAb转阴率比较差异均无统计学意义(P>0.05),见表1。
2.2 2组患者Child-Pugh肝功能分级比较 治疗48周后,2组Child-Pugh肝功能分级均较治疗前下降,且联合组低于对照组,差异均有统计学意义(P<0.05),见表2。
2.3 2组患者肝纤维化比较 治疗48周后,2组血清LN、PCⅢ、HA及LSM水平均较治疗前有显著下降,且联合组明显低于同期对照组,差异均有统计学意义(P<0.05),见表3。
2.4 2组患者细胞免疫指标比较 治疗48周后, 2组外周血CD4+/CD8+、NK细胞水平均较治疗前提升,且联合组明显高于同期对照组,差异均有统计学意义(P<0.05),见表4。
2.5 2组患者药物不良反应发生率比较 治疗48周内,2组血小板减少、贫血、甲状腺功能异常、头痛、恶心等不良反应,均较为轻微,且在停药后自行缓解。并发症发生率比较差异均无统计学意义(P>0.05),见表5。
注:a采用Fisher精确概率法
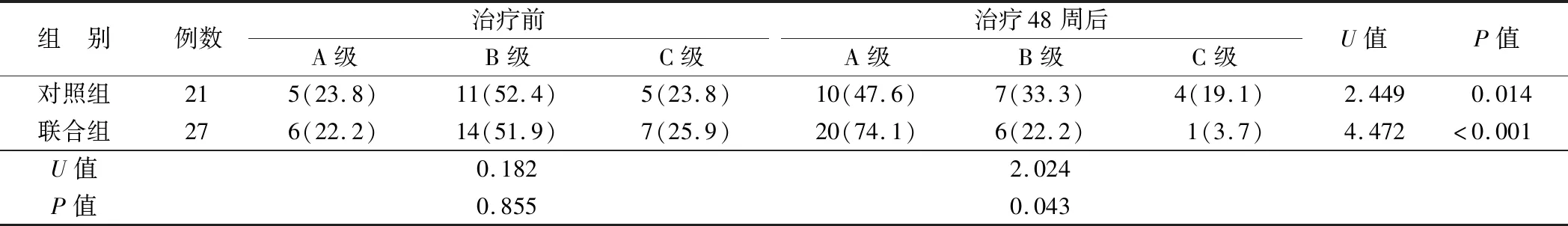
表2 2组患者治疗前后Child-Pugh肝功能分级比较 [例(%)]

表3 2组患者治疗前后血清LN、PCⅢ、HA及LSM水平比较

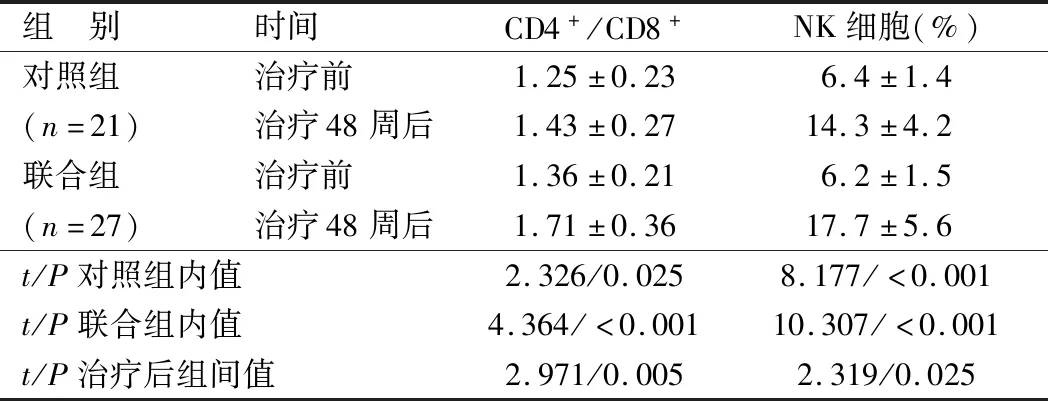
组 别时间CD4+/CD8+NK细胞(%)对照组治疗前1.25±0.236.4±1.4(n=21)治疗48周后1.43±0.2714.3±4.2联合组治疗前1.36±0.216.2±1.5(n=27)治疗48周后1.71±0.3617.7±5.6t/P对照组内值2.326/0.0258.177/<0.001t/P联合组内值4.364/<0.00110.307/<0.001t/P治疗后组间值2.971/0.0052.319/0.025
3 讨 论
HBV隶属于嗜肝DNA病毒科,该病毒并不直接对宿主肝细胞产生损伤作用,可通过激活免疫系统对肝细胞产生过度免疫应答,从而间接导致病理性炎性损伤及坏死[9],因此CHB患者肝功能恢复有赖于HBV清除效率。据相关文献报道,NAs可通过阻断HBV聚合酶上核苷结合位点,与自然底物三磷酸脱氧腺苷产生竞争作用,终止DNA链延伸及病毒复制流程[10],药物适应范围较为广泛,并且口服给药相对方便,70%~90%患者可在短期内迅速控制HBV DNA水平[11]。恩替卡韦化学本质是环戊酰鸟苷的类似物,口服后可代谢为三磷酸盐被迅速吸收,30~90 min内达到血药浓度峰值[12],可高选择性抑制HBV多聚酶启动及前基因组mRNA逆转录负链形成,同时导致病毒逆转录酶失活,其抗病毒作用相较于同类型的阿德福韦酯更强且药效持久[13]。本研究中,2组患者治疗后肝功能均有明显提高,其中联合组提高幅度更大,且HBV DNA转阴率更高,这表明恩替卡韦可通过抑制HBV复制减少肝功能受损程度,联合应用PegIFNα-2a还可加快肝功能转归,究其原因与二者从不同机制协同减弱HBV病理作用有关。有学者得到与本研究类似的结论,但考虑NAs对HBeAg、HBsAg血清学转换率较低,往往需要长期治疗甚至终身服药,耐药变异风险较大[14],长期随访监测医疗资源投入较高,且患者用药依从性也不易保持,一旦停药容易引起病毒学复发甚至病情恶化,故临床应用仍受到一定限制。
肝纤维化是肝炎向肝硬化进展的必经途径,早期纤维化多局限于汇管区、肝小叶胶原性组织增生沉积,而晚期纤维化则将累及肝细胞外基质,引起肝窦毛细血管硬化及大血管血栓形成[15]。相关研究表明,肝纤维化组织本质是肝窦内星状细胞与汇管区肌纤维母细胞异常激活而合成大量胶原纤维、弹性纤维、氨基多糖等聚集体[16],是HBV感染后反复炎性刺激损伤、自修复过程的病理结局,因而抗病毒治疗仍是减缓炎性坏死导致纤维化进程的主要临床策略。本研究中,2组患者经过治疗后肝纤维化指标及LSM值均显著减低,且联合组减低趋势更大,提示PegIFNα-2a联合恩替卡韦能通过有效抑制HBV复制,减少病毒DNA载量,削弱炎性损伤—修复循环作用,并减少肝脏细胞炎性坏死或凋亡,阻止或延缓纤维化进展。PegIFNα-2a采用40kDa分子量Peg合成,相比于采用12kDa分子量的PegIFNα-2b,血药浓度更为稳定,药物载体保护IFNα作用更强,半衰期也更长,药物分布更易于集中在肝脏与外周血[17],由于血液容量相仿,故前者无需参照体质量设计给药剂量。
不同于慢性丙型肝炎(CHC)患者一经确诊均需立即开展规范的抗病毒治疗措施,CHB患者通常需确保抗病毒治疗处于最佳时机,否则将造成医疗资源浪费,并增加后续治疗难度[18]。何佳奇等[19]指出,如CHB患者免疫应答不充分,抗病毒治疗无法协同免疫机制发挥最佳效果;如CHB患者免疫应答过强,则易在IFN治疗中导致肝功能损害加重甚至肝衰竭。IFN作为具有免疫调节的天然细胞因子,同样对肝脏内病毒具有较强清除能力,尽管耐药率较低,但相对NAs类药物作用较弱,且由于广泛参与机体生理作用,该类药物并不能应用于失代偿期肝硬化及重型肝炎患者,可能引起较多药物不良反应,其安全性一度遭到临床质疑。本研究发现,2组治疗后HBsAg、HBeAg/HbeAb、HBcAb转阴率差异不大,但联合组细胞免疫功能改善效果较对照组更佳,加用PegIFNα-2a也并未增加药物不良反应发生率,这说明PegIFNα-2a能有效增强淋巴细胞对肝内感染靶细胞的特异性细胞毒性作用,调节细胞免疫功能维持在有助于抗病毒治疗发挥作用的水平内。联合用药方案安全性较好,导致的不良反应均较为轻微,每日口服给药方便,患者容易耐受,研究中未见脱落病例,一定程度减少其耐药性,但仍需密切对患者临床表现及生化指标进行持续监测。由于随访时间有限,2组免疫应答水平未获得满意疗效,应在未来研究中通过扩大样本量并延长观察时间获得更有说服力的结论。

表5 2组药物不良反应发生率比较 [例(%)]
综上所述,PegIFNα-2a联合恩替卡韦治疗CHB能通过有效消除HBV,改善患者肝功能、肝纤维化、LSM值及细胞免疫功能,近期疗效较好且安全性突出,对患者预后康复有利。
利益冲突:无
作者贡献声明
周红、杨凤:提出实验思路,设计实验方案,起草及修改论文;王容、唐坤伦:提出意见,指导修改;王文平:收集整理材料及文献

