低氧训练诱导miR-27/PPARγ调控肥胖大鼠腓肠肌脂肪酸代谢的研究
朱 磊,路瑛丽,冯连世*,张素娴
低氧训练诱导miR-27/PPARγ调控肥胖大鼠腓肠肌脂肪酸代谢的研究
朱 磊1,路瑛丽2,冯连世2*,张素娴3
(1.曲阜师范大学 体育科学学院,山东 曲阜 273165;2.国家体育总局体育科学研究所,北京 100061;3.日照市体育运动学校,山东 日照 276800)
:探讨在低氧条件下运动对营养性肥胖大鼠腓肠肌中miR-27/PPARγ及其下游脂代谢相关调控基因和蛋白表达的影响。:SD大鼠喂饲高脂饲料构建营养性肥胖大鼠模型,建模成功后随机分为5组,分别为正常氧浓度组(C组)、低氧训练1周组(E1组)、低氧训练2周组(E2组)、低氧训练3周组(E3组)和低氧训练4周组(E4组),每组10只。低氧训练大鼠置于13.6%低氧环境(相当于实际海拔3 500 m高度氧含量),水平动物跑台训练(20 m/min,1 h/天,5天/周)。末次训练24 h后(禁食12 h)麻醉取右侧腓肠肌中端。RT-PCR检测大鼠腓肠肌miR-27、PPARγ、ATGL、CD36 m RNA的表达量,Westent Blot检测大鼠腓肠肌PPARγ、ATGL、CD36、蛋白表达量。:1)肥胖大鼠腓肠肌miR-27表达量在前2周降低,随后2周又逐渐上升,E4组miR-27相对表达量非常显著高于其他各组(<0.01)。2)PPARγ mRNA随低氧训练时间的增加表达量逐渐上升,但E3组出现下降趋势,与E1组、E2组(<0.05)和E4组(<0.01)相比呈显著降低,C组显著低于E4组(<0.05);PPARγ蛋白表达量随低氧训练时间的延长先下降后上升,C组和E1组均非常显著高于E2、E3、E4组(<0.01)。E2组显著低于E3组(<0.05)和E4组(<0.01)。3)ATGL mRNA表达量逐渐增多,其中C组非常显著低于E1、E2组、E3组、E4组(<0.01),E3组显著低于E4组(<0.01);ATGL蛋白相对表达量逐渐增加,C组与E1组均非常显著低于E3组(<0.01)和E4组(<0.05)。4)CD36 mRNA表达量先下降后上升,C组显著高于E2组、E3组(<0.05),E1组显著高于E2组(<0.05);C组CD36蛋白表达量显著低于E2和E3组(<0.05)。:肥胖大鼠腓肠肌中miR-27在低氧训练第4周增加显著,介导PPARγ调控下游脂代谢相关靶基因的表达,从而调控大鼠机体脂代谢水平,这可能是低氧训练减脂降体重的分子学机制。
低氧训练;miR-27;PPARγ;肥胖大鼠;脂肪酸代谢
世界卫生组织(WHO)公布的数据显示,2016年全球肥胖成年人占总人口的13%,肥胖作为一种脂代谢紊乱综合征,是众多代谢疾病的诱因,严重危害人类的健康,如何增加脂肪的分解,抑制脂肪的生成,受到社会各界的广泛关注。众多研究表明,低氧训练不仅可以降低体脂率,减轻体重(朱磊,2016; Goodman,2014),还可以干预因肥胖引起的动脉粥样硬化、高血脂等一系列脂代谢紊乱疾病,降低其患病风险(Haufe et al,2008; Lam et al,2009)。低氧降低体脂率主要是通过调节脂质合成、分解过程中关键酶的表达,进而减少脂肪的分化以及加速脂肪的分解,最终实现减脂的目的(荆文 等,2012; 朱磊 等,2016b)。
近期研究表明,miRNA在脂代谢调节中发挥重要作用,是当前的研究热点。miRNA参与脂肪的合成、分解、转运等过程,调节脂代谢通路中相关基因和蛋白的表达,影响脂代谢相关酶的活性,从而实现对脂代谢的调节(Feinberg et al.,2016)。其中miR-27是目前发现的与脂代谢相关性最高的一种miRNA。miR-27可与PPARγ发生特异性结合,影响其表达,诱导脂代谢通路中PPARγ下游基因和蛋白的表达,进而实现对脂质分解以及合成代谢效率的调节作用(Lozano-Velasco et al,2011; Mozos et al.,2014)。
脂肪酸的分解主要在线粒体中,由脂肪酸的β氧化来完成。腓肠肌中丰富的线粒体可以更好地氧化分解脂肪酸,高效产生ATP为机体运动提供能量。目前关于miR-27参与肝脏脂质代谢的研究较多,关于低氧环境下运动对腓肠肌miR-27时序性变化影响的研究较少,对miR-27调控靶基因PPARγ影响下游脂代谢相关基因、蛋白表达水平的机制尚不明了。本实验主要通过4周低氧训练的干预,检测低氧训练对miR-27/PPARγ以及对下游参与脂代谢的调控因子在转录水平、蛋白水平的时序性变化的影响,探讨低氧训练在减轻体脂百分比、降低体重的过程中可能的分子学机制,从而为科学减肥、制定减脂计划以及治疗脂代谢紊乱相关疾病提供理论依据。
1 材料与方法
1.1 实验动物及分组
SPF级5周龄雄性SD大鼠120只,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。所有大鼠饲养于国家体育总局体育科学研究所动物房,随机挑选出20只进行普通饲料饲养,100只高脂饲料(45%脂供能,research diets公司)饲养,所有大鼠起始体重无显著差异。大鼠自由饮食无干预,室温控制在22±1℃,湿度为55%±2%,开启动物房昼夜交替照明设施,每12 h轮换。进行为期8周的高脂饮食饲养,大鼠体重增加显著,从中挑选出肥胖大鼠,构成肥胖大鼠模型,营养性肥胖大鼠模型构建是否成功的判断标准:高脂饮食饲养组大鼠体重与普通饮食饲养组体重均值相比增加超20%,TC、TG等与脂代谢相关血液指标与对照组相比有显著性变化,Lee’s 指数显著上升(王根辈 等,2012; 朱磊 等, 2016a)。建模成功后继续高脂饮食,正式实验前进行1周的适应性训练(跑台速度由16 m/min渐增到25 m/min,训练时间由20 min/天渐增到60 min/天)。将所有肥胖大鼠进行跑台适应性训练,从中选取50只能够完成跑台训练的大鼠,随机选择10只为一组,分为5组:常氧未训练对照组(C组,)、低氧训练1周组(E1组)、低氧训练2周组(E2组)、低氧训练3周组(E3组)、低氧训练4周组(E4组)。利用低氧房模拟13.6%氧浓度低氧环境,水平动物跑台训练(20 m/min,60 min/天,5天/周)。根据实验分组情况分别训练0周、1周、2周、3周、4周。
1.2 取材
大鼠末次训练结束恢复24 h(禁食12 h),麻醉后取右侧腓肠肌,冰生理盐水漂洗杂物,置于液氮中迅速冷冻,-80℃超低温冰箱保存。
1.3 测定指标及方法
1.3.1 RT-PCR检测PPARγ、ATGL和CD36 mRNA的表达
实验涉及的全部引物如表1所示,由上海生工合成。

表1 RT-PCR引物序列
RT-PCR检测:取腓肠肌100 mg左右,液氮中充分研磨后Trizol法提取总RNA,测量总RNA浓度,琼脂糖电泳对RNA完整性检验,反转录试剂盒(RR037A,TakaRa)将总RNA在核酸扩增仪中反转录获取cDNA,利用荧光定量PCR仪进行cDNA的快速扩增与荧光定量检测,每个样本3个复孔,β-actin为内参。反应条件:起始模板预变性95℃,30 s;PCR循环反应95℃,5 s;60℃,31 s,40个循环。荧光定量PCR得到3个重复样本Ct值,取平均值,将实验数据代入公式计算2-△△Ct 值进行相对定量计算。
1.3.2 Western Blot法检测PPARγ、ATGL和CD36蛋白的表达
从超低温冰箱取腓肠肌组织置于液氮中充分研磨,加入蛋白提取液(碧云天)提取总蛋白,采用BCA法测试得到蛋白浓度并加loding Buffer(碧云天)和去离子水调至统一值,沸水浴15 min,-20℃冰箱冷藏,常规Westent blot法检测,将转膜后的PVDF膜置于化学发光成像系统(Power pactTM Basic,BIO-RAD),滴加ECL发光液(Millipore,美国)显影,后使用ImageJ软件分析条带灰度值。
表2 抗体的稀释比例和来源
Table 1 Dilution Ratio and Source of Antibody
1.5 统计学分析
本实验中所有数据均用SPSS 23.0软件进行统计学分析。0.05表示具有显著差异,<0.01表示具有非常显著差异。采用单因素方差分析法分析比较组间差异,利用GraghPad Prism 5.0软件汇总分析并作图。
2 实验结果
2.1 各组大鼠miR-27相对表达量的时序性变化
在低氧运动的干预下,大鼠腓肠肌miR-27相对表达量先减少后增加,但在前3周低氧运动干预中没有显著性变化,E4组表达量最高,非常显著高于其他组(<0.01)(图1)。

图1 各组大鼠腓肠肌miR-27和PPARγ的相对表达量
Figure 1. Relative mRNA and Protein Levels of miR-27 and PPARγ in Gastrocnemius of Rats
注:*<0.05,**<0.01,下同。
2.2 各组大鼠PPARγ表达的时序性变化
PPARγ mRNA表达量随低氧训练时间的增加逐渐上升,但E3组出现下降趋势,与E1组、E2组(<0.05)和E4组(<0.01)相比显著减少。E4组PPARγ mRNA表达量显著高于C组(<0.05);C组PPARγ蛋白表达量和E1组相比无统计学差异,两组均非常显著高于E2、E3、E4组(<0.01),且E2组同时显著低于E3组(<0.05)和E4组(<0.01)(图1)。
2.3 各组大鼠ATGL表达的时序性变化
C组肥胖大鼠腓肠肌ATGL mRNA表达量非常显著低于E1组、E2组、E3组、E4组(<0.01),E3组非常显著低于E4组(<0.01);ATGL蛋白表达量出现一个先增加后略有减少的趋势,C组和E1组均显著低于E3组(<0.01)和E4组(<0.05)(图2)。
Figure 2. Relative mRNA and Protein Levels of ATGL in Gastrocnemius of Rats
2.4 各组大鼠CD36相对表达量的时序性变化
CD36 mRNA表达量先下降后上升,C组显著高于E2组、E3组(<0.05),E1组显著高于E2组(<0.05);C组CD36蛋白表达量显著低于E2和E3组(<0.05)(图3)。
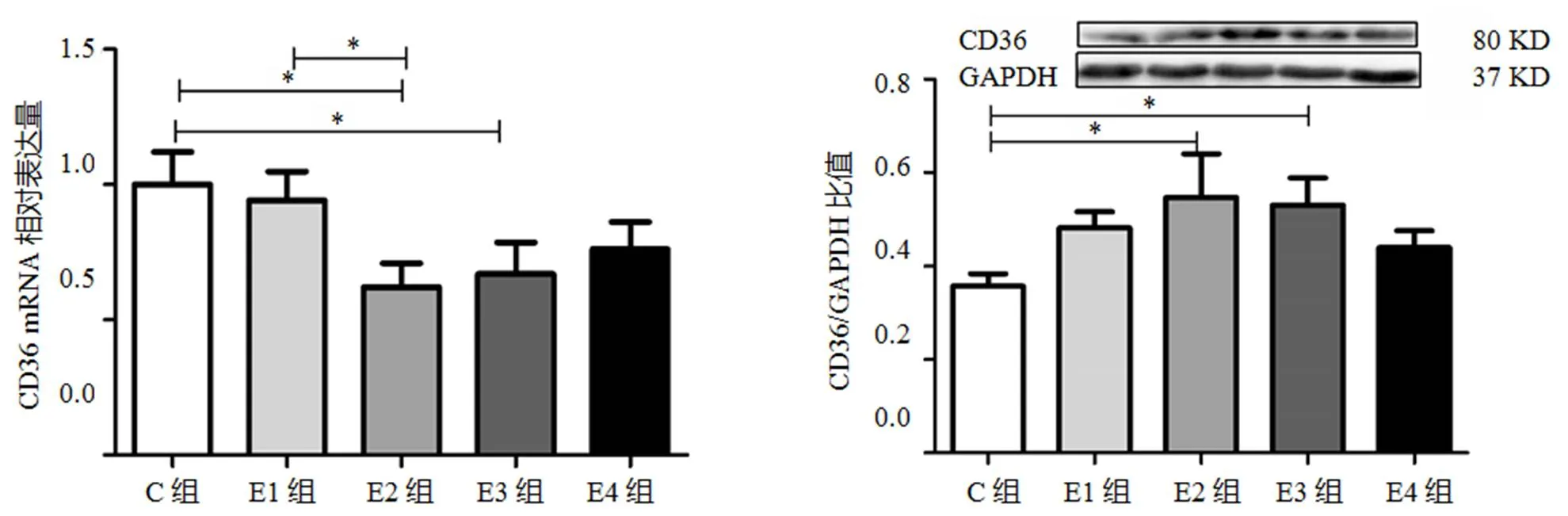
图3 各组大鼠腓肠肌CD36的相对表达量
Figure 3. Relative mRNA and Protein Levels of CD36 in Gastrocnemius of Rats
3 分析与讨论
有研究显示,高原低氧训练或者是低压氧仓模拟低氧环境等低氧条件都可以在一定程度上减轻体重,降低体脂百分比(安江红 等,2014; 袁建琴 等,2003),后期不断有人通过大量的大鼠实验证实了此结论(Disanzo et al.,2014; Lu et al.,2014)。Lu等(2014)研究发现,肥胖大鼠在经过4周的低氧训练后,体重、体脂比均出现非常显著下降。王宁琦(2012)等征集一些青年志愿者,进行了高原低氧环境的模拟实验,经过4周的训练后,BMI指数、体重、腰围、体脂百分比均较测试前显著降低,HDL-C浓度较低氧训练前升高了5.7%,此外体脂比在低氧训练3周时出现与整体走势相反的现象,在整体下降大趋势下出现短暂性上升,产生这种现象的原因可能是机体对低氧训练环境适应过程中出现的短暂性反馈,具体机制还尚不清楚,有待进一步的实验探究。
3.1 低氧训练对肥胖大鼠腓肠肌miR-27、PPARγ时序性变化的影响
miR-27在脂代谢过程中起到重要作用,主要是通过对脂类合成、氧化分解、转运等关键酶在转录后水平的调控来影响脂代谢,成为研究脂代谢机制的新切入点(Feinberg et al.,2016;Li et al.,2015)。在所有研究过的miRNA中,与脂代谢高度相关的主要集中在miR-27(Qin et al.,2016)、miR-122(Yamada et al.,2015)、miR-33(Marquart et al., 2010)、miR-370(Li et al.,2015)、miR-143(Dankel et al., 2014)、miR-378(Liu et al.,2015)等,其中miR-27是目前为止研究的所有miRNA中与脂肪细胞分化相关系数最高的一种miRNA。Vickers等(2013)提取人和鼠肝脏中约150余种miRNA,利用基因芯片技术筛选后发现,miR-27是其所有miRNA中与脂代谢调控相关性最高的。研究发现,miR-27模拟物可以分解机体脂肪酸,降低其浓度,抑制脂肪细胞向成熟脂肪细胞的分化,下调体脂百分比,为科学的减脂降重、防治脂代谢紊乱相关疾病提供新方向(Xie et al.,2016)。低氧训练因高效安全减肥调节脂代谢受到大家广泛的关注,但是关于低氧训练对腓肠肌miR-27的影响还鲜有报道。本实验结果显示,在低氧训练前3周miR-27表达量先下降后上升,但没有显著性变化,在第4周出现非常显著升高,可能是机体逐渐对低氧训练环境做出的适应性变化。
PPARγ在脂肪组织中分布比较广泛,不仅可以调节脂肪细胞的分化,还在脂肪酸的合成、分解、转运中发挥重要作用。miR-27在脂代谢通路中是PPARγ上游的调控因子,与肥胖的发生密切相关,在脂肪代谢中起到重要作用。利用荧光素酶报告分析,miR-27可特异性识别PPARγ3’端UTR位点,结合后抑制PPARγ的表达(Ji et al.,2009)。miR-27与脂肪的生成呈负相关,随着miR-27的表达的增加对PPARγ蛋白表达的抑制作用逐渐增强,进而抑制脂肪的分化与生成,抑制作用随脂肪分化程度的加深而逐渐减弱(Karbiener et al.,2009; Liu et al.,2015)。Takahashi等(2012)利用基因敲除技术敲除3T3-L1细胞PPAR基因,发现细胞丧失脂肪分化能力。大量学者研究均证实,低氧和运动都可以引起机体PPARγ蛋白表达的变化。Lui等(2015)实验发现,低纬度低氧环境中鹿鼠骨骼肌中PPARγ mRNA的表达量的仅为是高纬度中的一半,同时PPARγ蛋白水平也出现相同的变化趋势。另外,实验结果还显示,低氧环境可以刺激鹿鼠,使骨骼肌中PPARγ蛋白浓度逐渐增加。此外,禹尚美(2015)通过人工模拟低氧环境,研究低氧对脂代谢的影响,将SD大鼠随机分为常氧组、常氧训练组、低氧组、低氧训练组,实验开始3周后发现,脂肪中PPARγ mRNA表达量在各组间无统计学差异,这与本实验结果略有不同,PPARγ mRNA的表达量整体上呈现上升趋势,E4组显著高于C组和E3组,但E3组与整体变化趋势不同步,原因可能是机体在适应低氧训练环境过程中出现暂时性反馈现象,具体机制有待进一步探究。但PPARγ蛋白与mRNA变化趋势存在一定的差异,在低氧训练第1周时蛋白表达量未有显著性变化,在低氧训练2周时出现非常显著降低,但是随低氧训练时间的延长,PPARγ蛋白的浓度又逐渐升高,但仍显著低于C组和E1组。出现这种表达不一致的原因可能是由于基因转录后水平的调控,mRNA在翻译成蛋白的过程中,存在一定的时间与位置的差异,在这个过程中可能会发生miRNA降解或者基因沉默,且蛋白在机体的存活时间比mRNA更久,RT-PCR检测的灵敏性高于Westent Blot技术。也有可能是由于机体存在某种因子抑制了蛋白的表达,孙文星等(2016)研究发现,PPARγ mRNA在肌内脂肪细胞中的表达量显著低于皮下脂肪细胞,可能是体内存在某种反馈机制对PPARγ的表达具有一定的抑制作用。PPARγ蛋白水平的降低可抑制脂肪的分化与形成,减少体内脂肪细胞的生成,这一过程主要发生于脂肪细胞。随着低氧运动时间的延长,抑制脂肪分化作用逐渐减弱,在低氧训练2、3、4周PPARγ蛋白水平逐渐升高,可能是对低氧环境的逐渐适应性变化,PPARγ蛋白浓度的增加可以上调其下游与脂代谢相关基因的表达,促进脂质的分解,为机体运动提供更多的能量,进而降低体重。
3.2 低氧训练对营养性肥胖大鼠腓肠肌脂代谢相关因子时序性变化的影响
PPARγ在脂肪组织广泛分布,且在肝脏、骨骼肌等组织中表达量同样较高,它有多个与脂肪酸或者是胆固醇转运和代谢相关基因的结合位点,如脂肪酸移位酶(CD36/ FAT)和脂蛋白脂酶(LPL)等(González-Muniesa et al., 2015)。PPARγ参与骨骼肌中的脂肪酸代谢主要是通过调控LPL、CD36、ATGL、FATP-1基因的表达来实现(孙文星 等,2016),进而调节体脂百分比,减轻体重。CD36是一种跨膜转运蛋白,有多个结合位点,可以与多种脂质结合,能够转运长链脂肪酸至骨骼肌氧化分解,主要通过关闭或者是打开通道来调节脂肪酸转运进而调节脂代谢效率(孙婧瑜,2014; Glatz et al.,2010)。在静息条件下,机体对能量的需求较少,在转运脂肪酸时肉碱转移酶1(CPT-1)可能起到更重要的作用,但是当机体在运动过程中需要大量能量时,则是CD36发挥主要作用(Holloway et al.,2009)。Kriska等(2014)研究证实,CD36是PPARγ的下游基因,发现通过激活PPARγ可以上调CD36的表达,曾颖等(2012)研究结果同样证实PPARγ激动剂可以促进巨噬细胞中CD36蛋白的表达。Nishikawa等(2012)将Balb/c小鼠经过9周高脂饲养后发现,CD36等与肝脏脂肪酸转运相关的基因以及与脂肪酸合成相关基因表达量均有所增加。朱磊等(2018)实验结果同样显示,经过4周的低氧训练营养性肥胖大鼠肝脏中的CD36、ATGL、LPL表达量逐渐增加,这与本实验中CD36蛋白的变化类似,在低氧训练前3周逐渐增加,到第4周出现下降趋势。本实验CD36基因在低氧训练第1周时无显著性变化,第2周出现显著下降,随后逐渐增加但无统计学意义。引起CD36 mRNA水平和蛋白水平变化趋势不同的原因可能是存在mRNA转录后调控的原因,mRNA翻译成蛋白质的效率增大,或者是转录后抑制蛋白的翻译作用减弱,并且RT-PCR检测比Westent blot检测的灵敏性要高。
脂肪甘油三酯水解酶(adipose triglyceride lipase,ATGL)在脂肪水解为甘油和脂肪酸中发挥重要作用,是脂肪水解的关键限速酶,饮食对ATGL表达量的影响较大,在饥饿状态时,表达量增加,促进脂肪的分解,摄食后表达量降低,抑制脂肪的分解,所以有人认为可以通过调节ATGL的转录速率以及蛋白的活性来影响脂代谢(胡深强 等,2011)通过在小鼠的饮食中增加罗格列酮(PPARγ激动剂),发现ATGL表达量显著增加(Shen et al.,2007),另有研究发现在脂肪细胞中,PPARγ可以促进ATGL的表达,但ATGL活性未受影响(丁明 等,2009),上述研究均证实ATGL是PPARγ下游靶基因。Nadeau等(2006)研究发现,大鼠骨骼肌中脂肪酸合成酶(Fatty acid synthetase,FAS)蛋白浓度、固醇调节元件结合蛋白1(SREBP-1)蛋白浓度和mRNA相对表达量在运动后出现显著增加,提示有氧运动可以提升脂肪氧化分解供能能力,这与本实验大鼠腓肠肌中ATGL和CD36蛋白的变化趋势相类似。有研究发现,低氧可以促进虾虎鱼肝脏中ATGL蛋白的表达,并且低氧暴露时间越长,效果越明显(Gracey et al.,2011)。Lu等(2014)在对营养性肥胖大鼠高住高训后,大鼠脂肪组织中ATGL的表达量在低氧训练2周和3周时较对照组显著增加,但是低氧训练1周组有所下降,低氧训练4周组较对照组无显著性变化。本实验ATGL经过4周低氧训练mRNA和蛋白质表达量均显著增加,但E3组ATGL mRNA表达量显著低于E4组,E3组相较于低氧训练的前2周也略有下降,但无统计学意义,E3组、E4组ATGL蛋白相对表达量显著高于C组和E1组,这一变化趋势与E3组PPARγ mRNA的变化有所不同,这可能是在转录过程中机体对低氧环境的暂时性适应,并且最后起到调节作用的是蛋白质,所以还是以蛋白的变化为主要依据,且Steinberg等(2007)也证实在肥胖群体中,ATGL mRNA出现轻微性下降在脂肪降解过程中作用并不是特别重要,ATGL蛋白翻译后的修饰过程更为重要。低氧训练可促进腓肠肌ATGL和CD36的蛋白表达量逐渐增加,进而加速腓肠肌中脂肪的分解,脂肪分解可以为腓肠肌运动提供更多的能量,因此改善了肥胖大鼠的血脂含量和体脂百分比,这可能也是低氧训练减脂降体重的原因。
综上所述,低氧训练可以上调营养性肥胖大鼠腓肠肌中miR-27的表达,miR-27可以通过抑制PPARγ的表达减少成熟脂肪细胞的生成,减少脂肪堆积,但随着时间的延长抑制作用逐渐减弱,PPARγ蛋白表达量逐步增加,ATGL和CD36蛋白随低氧训练时间的延长蛋白浓度逐渐增加,从而促进了脂肪的氧化分解,减少了机体脂肪的堆积。
4 结论
低氧训练可通过miR-27来调节营养性肥胖大鼠腓肠肌中PPARγ的表达,进而调控下游与脂代谢相关靶基因的表达,进而促进腓肠肌中脂肪的分解代谢,这可能是低氧训练减脂降体重的分子学机制。有待通过过表达/抑制miR-27的表达,进一步验证低氧训练过程中miR-27介导PPARγ调控脂代谢的具体机制。
安江红,赵凡,赵之光, 2014. Hihilo对优秀古典跤运动员备战全运会赛前减控体重期间部分生理生化指标的影响[J].中国运动医学杂志, 33(2): 115-11.
丁明,徐冲,徐国恒, 2009. Atgl调节细胞内脂质代谢和代谢相关疾病[J].中国生物化学与分子生物学报, 25(4): 309-315.
胡深强,潘志雄,王继文, 2011.脂肪甘油三酯脂肪酶(atgl)的生物学功能及调控机制[J].中国生物化学与分子生物学报, 27(8): 721-727.
荆文,冯连世,邹飞,等, 2012. 低氧暴露及低氧训练调控脂代谢研究进展[J].中国运动医学杂志, 31(12): 1122-1126,1108.
孙婧瑜,2014. Cd36对骨骼肌脂肪酸代谢调控的机制研究[D].上海:华东师范大学.
孙文星,南文婷,谷淑华,等, 2016. Mir-27b及其靶基因pparγ在肌内和皮下脂肪细胞中的差异表达分析[J].南京农业大学学报, 39(2): 249-254.
王根辈,栗志文,曹晶,等, 2012.高脂饮食诱发大鼠营养性肥胖动物模型的研究[J]. 吉林医学, 33(1): 5-7.
王宁琦,胡扬,官余凌,等, 2012. 4周低氧运动结合饮食控制对肥胖青年体重、血脂及胰岛素抵抗的影响[J].中国运动医学杂志, 31(4): 289-294.
禹尚美,2015.低氧及低氧训练对大鼠身体脂肪代谢的影响[D].北京:北京体育大学.
袁建琴,曹建民,徐勇,等,2003.现代五项高原训练某些生理生化指标的训练监控研究[J].北京体育大学学报, 26(1): 51-52.
曾颖,孙玉慧,黄延锦, 2012.过氧化体增殖物激活型受体γ对巨噬细胞脂质蓄积及CD36表达的影响[J].中国动脉硬化杂志, 20(2): 121-124.
朱磊,2016.低氧训练诱导mir-27/pparγ、mir-122/pparβ调控肥胖大鼠肝脏脂代谢机理的研究[D].上海:上海体育学院.
朱磊,路瑛丽,冯连世,等, 2016a. 不同配方高脂饲料构建sd大鼠肥胖模型的实验研究[J].中国运动医学杂志, 35(7): 642-647.
朱磊,路瑛丽,冯连世,等, 2016b. microRNA调节脂代谢的研究进展[J].中国体育科技, 52(3): 61-68.
朱磊,路瑛丽,冯连世, 2018.低氧训练诱导mir-27/pparγ调控肥胖大鼠肝脏脂肪酸代谢变化的研究[J].中国体育科技, 54(1): 115-122.
DANKEL S N, DEGERUD E M, BORKOWSKI K, et al., 2014. Weight cycling promotes fat gain and altered clock gene expression in adipose tissue in c57bl/6j mice[J]. Am J Physiol Endocrinol Metab, 306(2): E210.
Disanzo B L, You T, 2014. Effects of exercise training on indicators of adipose tissue angiogenesis and hypoxia in obese rats[J]. Metabolism, 63(4): 452-455.
FEINBERG M W, MOORE K J , 2016. Microrna regulation of atherosclerosis[J]. Circ Res 118(4): 703-720.
GLATZ J F, LUIKEN J J, BONEN A, 2010. Membrane fatty acid transporters as regulators of lipid metabolism: Implications for metabolic disease[J]. Physiol Rev, 90(1): 367-417
GONZÁLEZ-MUNIESA P, LOPEZ-PASCUAL A, DE ANDRÉS J, et al., 2015. Impact of intermittent hypoxia and exercise on blood pressure and metabolic features from obese subjects suffering sleep apnea-hypopnea syndrome[J]. J Physiol Bioch, 71(3): 1-1.
GOODMAN Z D, 2014. The impact of obesity on liver histology[J]. Clin Liver Dis, 18(1): 33-40.
GRACEY A Y, LEE T H, HIGASHI R M, et al., 2011. Hypoxia-induced mobilization of stored triglycerides in the euryoxic goby gillichthys mirabilis[J]. J Exp Biol, 214(Pt 18): 3005-3012.
HAUFE S, WIESNER S, ENGELI S, et al., 2008. Influences of normobaric hypoxia training on metabolic risk markers in human subjects[J]. Med Sci Sports Exer, 40(11): 1939.
HOLLOWAY G P, JAIN S S, BEZAIRE V, et al., 2009. Fat/cd36-null mice reveal that mitochondrial fat/cd36 is required to upregulate mitochondrial fatty acid oxidation in contracting muscle[J]. Am J Physiol Regul Integr Comp Physiol, 297(4): R960.
JI J L, Zhang J Sh, Huang G C, et al., 2009. Over-expressed microrna-27a and 27b influence fat accumulation and cell proliferation during rat hepatic stellate cell activation[J]. Febs Letters, 583(4): 759-766.
KRISKA T, CEPURA C, GAUTHIER K M, et al., 2014. Role of macrophage pparγ in experimental hypertension[J]. Am J Physiol Heart Circ Physiol, 306(1): 26-32.
LAM D C, XU A, LAM K S, et al., 2009. Serum adipocyte-fatty acid binding protein level is elevated in severe osa and correlates with insulin resistance[J]. Eur Res J, 33(2): 346.
LI X L, LIAN F ZH, LIU CH, et al., 2015. Isocaloric pair-fed high-carbohydrate diet induced more hepatic steatosis and inflammation than high-fat diet mediated by mir-34a/sirt1 axis in mice[J]. Sci Rep, 5: 16774.
LIU S Y, ZHANG Y Y, GAO Y, et al., 2015. Mir-378 plays an important role in the differentiation of bovine preadipocytes[J]. Cell Physiol Bioch Int J Exp Cell Physiol Bioch Pharmacol, 36(4): 1552-62.
LIU W X, ZHOU F, WANG Y, et al., 2015. Voluntary exercise protects against ulcerative colitis by up‐regulating glucocorticoid‐mediated ppar-γ activity in the colon in mice [J]. Acta Physiol, 215(1): 24-36.
LOZANO-VELASCO E, CONTRERAS A, CRIST C, et al., 2011. Pitx2c modulates pax3+/pax7+ cell populations and regulates pax3 expression by repressing mir27 expression during myogenesis [J]. Dev Biol, 357(1): 165-178.
LU Y L, JING W, FENG L S, et al., 2014. Effects of hypoxic exercise training on microrna expression and lipid metabolism in obese rat livers[J]. J Zhejiang Univ Sci B, Sep;15(9):820-829.
LUI M A, MAHALINGAM S, PATEL P, et al., 2015. High-altitude ancestry and hypoxia acclimation have distinct effects on exercise capacity and muscle phenotype in deer mice[J]. Am J Physiol Regul Integr Comp Physiol, 308(9): R779.
KARBIENER M, FISCHER C, NOWITSCH S, et al., 2009. Microrna mir-27b impairs human adipocyte differentiation and targets PPARγ[J]. Biochem Bioph Res Co, 390(2): 247-251.
MARQUART T J, ALLEN R M, ORY D S, et al., 2010. Mir-33 links srebp-2 induction to repression of sterol transporters[J]. Proc Natl Acad Sci USA, 107(27): 12228-12232.
MOZOS A, CATASÚS L, D'ANGELO E, et al., 2014. The foxo1-mir27 tandem regulates myometrial invasion in endometrioid endometrial adenocarcinoma[J]. Hum Pathol, 45(5): 942-951.
NADEAU K J, EHLERS L B, AGUIRRE L E, et al., 2006. Exercise training and calorie restriction increase srebp-1 expression and intramuscular triglyceride in skeletal muscle[J]. Am J Physiol, 291(1): 90-98.
NISHIKAWA S, SUGIMOTO J, OKADA M, et al., 2012. Gene expression in livers of balb/c and c57bl/6j mice fed a high-fat diet[J]. Toxicol Pathol, 40(1): 71.
QIN N, ChEN Y, JIN M N, et al., 2016. Anti-obesity and anti-diabetic effects of flavonoid derivative (fla-cn) via microrna in high fat diet induced obesity mice[J]. Eur J Pharm Sci, 82(1): 52-63.
SHEN W J, PATEL S, YU Z, et al., 2007. Effects of rosiglitazone and high fat diet on lipase/esterase expression in adipose tissue[J]. BBA- Biomembranes, 1771(2): 177-184.
STEINBERG G R, KEMP B E, WATT M J, 2007. Adipocyte triglyceride lipase expression in human obesity[J]. Am J Physiol Endocrinol Metab, 293(4): 95-98.
TAKAHASHI A, MORITA M, YOKOYAMA K, et al., 2012. Tob2 inhibits peroxisome proliferator-activated receptor γ2 expression by sequestering smads and c/ebpα during adipocyte differentiation[J]. Mol Cell Biol, 32(24): 5067.
VICKERS KASEY C, SHOUCRI BASSEM M, LEVIN MICHAEL G, et al., 2013. Microrna‐27b is a regulatory hub in lipid metabolism and is altered in dyslipidemia[J]. Hepatology, 57(2): 533-542.
XIE W, LI L, ZHANG M, et al., 2016. Microrna-27 prevents atherosclerosis by suppressing lipoprotein lipase-induced lipid accumulation and inflammatory response in apolipoprotein e knockout mice[J]. Plos One, 11(6): e0157085.
YAMADA H, OHASHI K, SUZUKI K, et al., 2015. Longitudinal study of circulating mir-122 in a rat model of non-alcoholic fatty liver disease[J]. Clin Chim Acta, 446: 267-271.
Effects of Hypoxia Exercise Induced miR-27 / PPARγ on Fatty Acids Metabolism in Gastrocnemius of Obese Rat
ZHU Lei1, LU Yingli2, FENG Lianshi2*, ZHANG Suxian3
: To explore the effects of hypoxic exercise on miR-27 / PPARγ and lipid metabolism related gene and protein expression levels in gastrocnemius muscle of obese rats.: The high-fat diet induced obese rats were randomly divided into 5 groups (=10 in each group), i.e., a normal oxygen concentration group (C), a hypoxia-exercises-for-1-week group (E1), a hypoxia-exercises-for-2-weeks group (E2), a hypoxia-exercises-for-3-weeks group (E3) and a hypoxia-exercises-for-4-weeks group (E4). The exercise training was conducted in an environment of 13.6% hypoxic (equivalent to the actual altitude of 3500 meters high oxygen content), rats were running on an animal treadmill in a speed of 20 m/min for 1 h/d,5d/w. After 24 h of the last exercise (12 h fasting), the middle of the right gastrocnemius muscle was collected. The RT-PCR was used to detect the mRNA levels of miR-27, PPARγ, CD36 and ATGL, the protein levels of PPARγ, CD36 and ATGL were measured by using Western blotting.: 1) In the first two weeks, the expression levels of miR-27 was gradually decreased in gastrocnemius muscle, but it was gradually increased in the subsequent two weeks. The expression levels of miR-27 in group E4 were significantly higher than other groups (<0.01). 2) The mRNA levels of PPARγ were gradually increased during the training session, but the mRNA levels of PPARγ in group E3 were significantly lower than that of group E1 and E2 (<0.05), and group E4 (<0.01); the group C was significantly lower than group E4 as well (<0.05); the protein levels of PPARγ showed a trend from decline to rise during training session, both group C and E1 were significantly higher than group E2、E3 and E4 (<0.01), the group of E2 was significantly lower than E3 group (<0.05) and E4 group (<0.01). 3) The mRNA levels of ATGL in group C were significantly lower than E1、E2、E3 and E4 groups (<0.01), and the group E3 was significantly lower than group E4 (<0.01); moreover, the protein levels of ATGL were lower in group C and E1 than that of group E3 (<0.01) and group E4 (<0.05); 4) The mRNA levels of CD36 in group C were significantly higher than group E2 and E3 (<0.05), the group E1 was significantly higher than group E2 as well (<0.05). The protein levels of CD36 in group C was significantly lower than group E2 and E3 (<0.05).: The miR-27 in skeletal muscle of obese rats was increased significantly at the fourth week of hypoxic exercise training. miR-27 regulates the transcription and translation of target genes in the downstream of PPARγ, thereby regulates the lipid metabolism in rats, and this is the potential molecular mechanism of hypoxic exercise in reducing body fat and weight.
exercise
2018-10-18;
2019-05-20
国家自然科学基金资助项目(31471139)
朱磊(1977-),男,副教授,博士,主要研究方向为低氧训练调控脂代谢的机制, E-mail: zhulei316@126.com。
冯连世(1964-),男,研究员,博士,主要研究方向为运动训练监控、高原(低氧)训练, E-mail: fenglianshi@ ciss.cn。
G804.7
A
1000-677X(2019)06-0055-07
10.16469/j.css.201906007

