跑台运动对慢性睡眠剥夺大鼠行为学改变、海马炎症因子及海马齿状回BDNF/TrkB信号通路的影响
崔建梅,郭燕兰,李中华,杨 洁,于 芳,李洪涛,苏晓云
跑台运动对慢性睡眠剥夺大鼠行为学改变、海马炎症因子及海马齿状回BDNF/TrkB信号通路的影响
崔建梅1*,郭燕兰1,李中华1,杨 洁1,于 芳1,李洪涛2,苏晓云3
(1.中北大学 体育学院,山西 太原 030051;2.山西省体育科学研究所,山西 太原 030051;3.山西医科大学 汾阳学院,山西 太原 030001)
:研究认为,体育运动可以改善慢性睡眠缺失引起的认知功能下降和情绪障碍,海马DG区在学习、记忆和空间编码中起着关键作用,并且对睡眠缺失高度敏感。因此本研究主要通过测量8周跑台运动对慢性睡眠剥夺(chronic sleep deprivation,CSD)大鼠海马炎症因子(IL-6及TNF-a)水平和海马DG区BDNF及TrkB表达的影响,探讨跑台运动改善CSD大鼠认知功能及焦虑样行为的可能机制。:将44只大鼠随机分为对照组(SG)、运动组(EX)、慢性睡眠剥夺组(CSD)和睡眠剥夺运动组(CSD+E)。随后,CSD和CSD+E组大鼠采用多平台水环境法制作CSD模型,同时,EX 和CSD+E组大鼠进行8周中等强度跑台运动(1 h/day/6 d/week)。跑台运动及CSD结束后,采用高架迷宫实验(EPM)评估大鼠焦虑样行为,八臂迷宫实验(ERM)评估大鼠空间学习记忆能力;除外,海马炎症因子(IL-6、TNF-a)水平及海马DG区BDNF及其受体TrkB表达被测量。:1)与SG组比较,ERM 实验中,CSD组大鼠错误潜伏期缩短,训练达到标准次数及TM显著增多(均<0.01)、CN减少(<0.05);EPM实验中,CSD组大鼠ORT、ORE均显著减少,焦虑指数显著增加(均<0.01);海马促炎因子IL-6及TNF-a水平显著增加(均<0.01);海马DG区BDNF及TrkB表达显著降低(均<0.01);2)8周跑台运动显著削弱了大鼠焦虑样行为,阻止了大鼠空间学习记忆能力的下降,海马促炎因子IL-6及TNF-a水平明显下降(<0.05,<0.01),海马DG区BDNF及TrkB表达均显著增强(<0.05,<0.01)。:中等强度跑台运动可以增强CSD大鼠学习记忆能力,削弱大鼠焦虑样行为,可能与此运动减弱海马炎症反应、增加海马DG区BDNF及其受体TrkB表达,从而增强BDNF/TrkB信号通路对CSD大鼠海马的神经保护作用有关。
跑台运动;慢性睡眠剥夺;学习记忆能力;焦虑样行为;海马炎症因子;BDNF/TrkB通路
随着社会竞争日趋激烈,个人工作时间越来越长,约19%的成年人每周工作超过48 h,7%的成人每周工作超过60 h(Alterman et al.,2013)。因此,由于职业和社会的需要,长期的睡眠缺失在现代社会变得越来越普遍。WHO估计,全世界有3亿多成年人患有睡眠障碍(每天睡眠少于6 h),其中30%~50%的睡眠障碍患者与社会压力和神经精神障碍直接相关。众所周知,睡眠在大脑发育、突触可塑性及神经恢复方面起重要作用,并且睡眠不足或睡眠障碍会对心理造成负面影响、引起神经发生减少、认知功能下降(包括注意力、决策和各种类型的记忆)及免疫功能紊乱(Krishnan et al.,2016)。此外,长期睡眠不足被认为是各种疾病(如精神疾病)的危险因素,甚至可能在几个月或几年的时间内造成致命后果(Besedovsky et al.,2016)。Alzoubi等(2017)通过行为学实验证实,急性及慢性睡眠剥夺会使啮齿动物在一些行为任务中产生记忆缺陷。此外,临床及动物实验均表明长期睡眠不足会导致人类病态焦虑及动物类焦虑行为。因此,慢性睡眠剥夺与焦虑之间的关系需深入研究。
越来越多的证据表明,睡眠剥夺会导致机体免疫系统功能紊乱和炎症反应过度激活。Hurtado-Alvarado等(2013)研究表明,IL-l、IL-6及TNF-a等细胞因子均参与睡眠觉醒的调节过程,而睡眠不足会增加炎症反应细胞因子的分泌。Yehuda等(2009)研究认为,72 h睡眠剥夺可使大鼠血清中TNF-a、IL-6、IL-1和IL-1b水平升高;Lekander等(2013)研究发现,急性睡眠不足可激活HPA轴从而增强外周促炎细胞因子IL-6和TNF-a水平,并且睡眠障碍也被报道可以升高海马IL-6水平,导致认知功能下降。上述研究证实急性睡眠剥夺和神经炎症因子及神经功能紊乱之间的联系,但是慢性睡眠不足是否会导致与急性睡眠不足同样程度的大脑炎症损害还有待研究。
海马是与认知功能及情绪调节有关的大脑区域。研究认为,海马DG(dentate gyrus)区在学习、记忆和空间编码中起着关键作用,DG区损伤会导致空间学习障碍(Aimone et al.,2011)。Marks等(2005)研究发现,即使是短时间(3~4 h)的急性睡眠剥夺也可以损害海马DG区LTP的形成,因此海马DG区对睡眠缺失高度敏感,并且研究认为海马DG区新生神经元对睡眠剥夺导致的神经炎症较为敏感,可增加新生神经元的死亡率,并阻碍其整合到海马回路(Monje et al.,2003)。而且临床研究证实,睡眠剥夺被证明可以减少DG区细胞增殖及神经发生导致DG区萎缩与慢性原发性失眠患者认知功能受损有关(Kline et al.,2016)。多数学者研究认为,脑源性神经营养因子(BDNF)与海马细胞增殖和/或神经发生有关(Abrous et al.,2005),其活性主要由其受体酪氨酸激酶B(Tyrosine kinase B,TrkB)介导,可调节局部炎症和睡眠,并且海马长时程增强(LTP)是由BDNF/TrkB信号通路诱导的,结果提示BDNF信号通路是参与学习记忆细胞机制的关键组成部分(Chen et al.,2017)。Zielinski等(2011)研究认为促炎因子白细胞介素-1(IL-1)和肿瘤坏死因子(TNF-a)升高及BDNF/TrkB信号通路功能障碍与睡眠缺失导致的认知功能下降有关。因此可以认为,慢性睡眠剥夺大鼠焦虑及认知功能受损可能与海马神经炎症及海马DG区BDNF/TrkB信号通路有关。
临床与动物实验均证实,体育锻炼具有增强认知功能和学习记忆能力的作用(Rimes et al.,2015)。然而,运动的抗焦虑作用结论不一,Lalanza等(2012)研究认为,跑台运动会加剧睡眠剥夺大鼠的焦虑行为,最近多数研究表明,运动预干预可以防止啮齿动物因急性睡眠不足而产生的焦虑行为(Vollert et al.,2011)。本课题组前期研究也已证实,4周跑台运动预干预可以通过增强睡眠剥夺大鼠杏仁核BDNF表达及抗氧化能力,改善睡眠剥夺大鼠学习记忆能力及焦虑样行为(崔建梅 等,2016)。但是,以前的研究很少涉及中等强度跑台运动对慢性睡眠剥夺大鼠焦虑及认知功能的影响。因此,本研究通过复制大鼠慢性睡眠剥夺(chronic sleep deprivation,CSD)模型,探讨8周中等强度跑台运动对CSD大鼠空间学习记忆能力及焦虑样行为的影响,及确定这些影响是否与海马炎症因子(IL-6,TNF-a)和海马DG区BDNF及其受体TrkB表达有关。
1 研究材料与方法
1.1 动物及分组
2月龄SD雄性大鼠44只,体质量(200~220)g,被放在标准鼠笼中饲养(3只/笼),室温(24±2)℃,湿度(55±10)%, 光暗周期为12 h光照/12 h黑暗,大鼠可自由摄食、饮水。实验前将大鼠随机分为对照组(sedentary group,SG)、运动组(exercise group,EX)、慢性睡眠剥夺组(chronic sleep deprived group,CSD)和睡眠剥夺运动组(chronic sleep deprived group with exercise group,CSD+E)。
1.2 CSD模型建立
适应实验室环境1周后,CSD组及CSD+E组大鼠根据 Alzoubi等(2016)学者采用的多平台水环境法制作大鼠CSD模型。每天睡眠剥夺18 h(每天中午12:00至次日早上6:00时),持续8周。具体方法如下:大鼠被放在一个大玻璃缸(170 cm×40 cm×55 cm),20个直径5 cm的小平台(置于水平面上2 cm、水温24℃)、间隔7 cm,排成2排放置在玻璃缸中,并且大鼠在平台上可自由摄食饮水。当大鼠进入REM阶段时,就会出现肌肉张力失调导致大鼠触水惊醒。CSD前大鼠需适应水环境平台3天(1 h/天)。
1.3 中等强度跑台运动干预训练方案
EX及CSD+E组大鼠实施跑台运动8周,跑台训练时大鼠跑速(18~21)m/min,5% 坡度运动8周(60 min/ 天/6天/周,每周一到周六),每周日允许大鼠休息1天(Zielinski et al.,2013)。
1.4 行为学测试
1.4.1 高架迷宫(elevated-plus maze,EPM )测试
跑台运动结束后第2天,根据Mazor等(2009)描述的EPM实验评估大鼠的焦虑样行为。EPM(距离地面50 cm)包括两个开放臂和两个闭合臂,一中央平台连接4臂。正式实验时,大鼠被面对开放臂放置在迷宫中央,自由探索迷宫5 min。
测试指标:开放臂时间(open arm time,ORT)及闭合臂时间(close arm time,CRT);开放臂次数(open arm entries,ORE)及闭合臂次数(close arm entries,CRE);焦虑指数:1-[(ORT/ORT+CRT) + (ORE/ORE+CRE)]×%,比值越大,表明焦虑程度越严重。
1.4.2 八臂迷宫测试(eight arm maze test,ERM)
所有大鼠在第9周周一进行ERM实验,实验前大鼠被放置在迷宫中适应2天。第1天,将(3~4)只大鼠同时放在迷宫中央,通向八臂的门均打开,大鼠自由活动;第2天八臂末端均放置食物,允许大鼠自由活动及摄食,所有食物摄取完毕后结束;第3天进行训练(2次/天)。每次训练时,只有1、2、5、7号臂放置饵料,整个实验过程均维持此顺序。训练成功标准:在连续3次训练中,错误次数少于2次,为训练成功。正式测试时,大鼠置于迷宫中央区,关住鼠门,20 s后打开鼠门并开启八臂迷宫测试软件,测试时间10 min。
测试指标包括:总记忆错误次数(参考记忆错误次数+工作记忆错误次数,total memory errors,TM)、错误潜伏期(s)、训练达到标准次数及大鼠第一次错误前正确次数(correct numbers,CN)。
1.5 海马炎症细胞因子含量测量
ERM实验结束后,将每组6只大鼠断头取脑后,冰上剥离海马组织并称重,加入生理盐水制成10%海马组织匀浆,离心(12 000 rpm/min,10 min)后取上清液,参照试剂盒说明(购买于美国Abcam公司)采用ELISA法检测海马炎症因子IL-6及TNF-a水平。
1.6 海马DG区BDNF、TrkB免疫组化染色
ERM实验结束后,每组剩余大鼠经水合氯醛(150 mg/ kg)麻醉后4%多聚甲醛150ml经心脏灌注取脑,石蜡包埋脑组织行海马DG区冠状位切片(5 μm),将切片置于烘烤箱内烘烤2 h,随后经二甲苯脱蜡(10 min)、乙醇水化后加H2O2(3%)的甲醇溶液室温孵育30 min,PBS漂洗后滴加BDNF(1:00)、TrkB(1:2000)一抗4℃过夜,滴加BDNF及TrkB二抗,在37℃恒温箱内孵育30 min,显色剂显色10 min,苏木素复染,梯度酒精脱水(50%、80%、90%、95%、100%乙醇各5 min),二甲苯透明(20 min),中性树脂封片。
光学显微镜下每组每张切片随机取5个视野(400 倍)拍片,测量大鼠海马DG区BDNF及TrkB阳性细胞数量(number)及面积(μm2)。
1.7 统计学处理
数据统计应用SPSS 18.0软件,数据结果用±表示,CSD和跑台运动对大鼠行为学数据及海马炎症因子和海马DG区BDNF及TrkB表达的影响采用双因素方差(Two Way ANOVA)分析,组间差异比较采用LSD post hoc法,<0.05表示差异具有统计学意义。
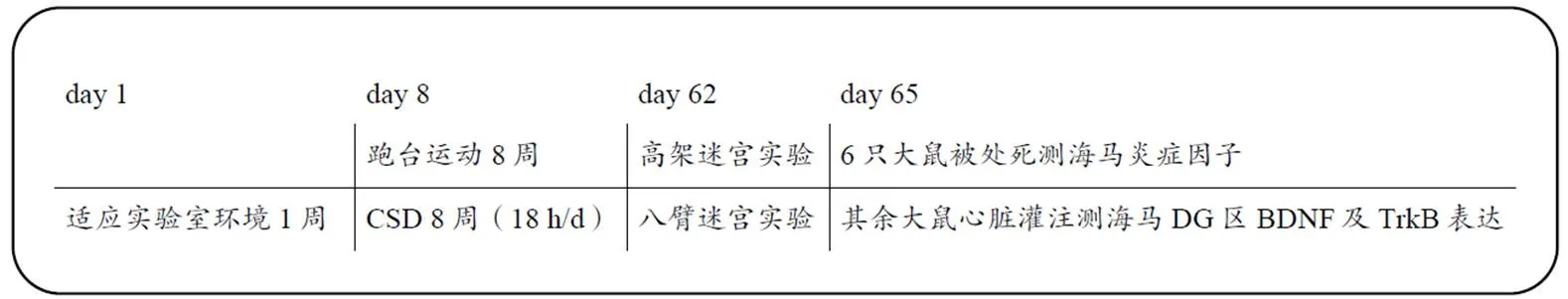
图1 实验流程
Figure 1. Protocols of the Experimental
2 结果
2.1 跑台运动对CSD大鼠焦虑样行为的影响
双因素方差分析显示慢性睡眠剥夺和跑台运动显著影响了大鼠EPM实验中ORT(F1,43=28.627,=0.000;F1,43=9.420,=0.004)、ORE(F1,43=55.215,=0.000;F1,43=8.834,=0.005)及焦虑指数(F1,43=69.773,=0.000;F1,43=28.969,=0.000)。运动和慢性睡眠剥夺对ORE(F1,43=7.423,=0.010)和焦虑指数均有显著交互效应(F1,43=6.061,=0.018),但对ORT无显著交互相应(F1,43=0.028,=0.050)。
表1结果显示,与SG组比较,CSD组大鼠EPM实验中ORT、ORE均明显减少(=0.000,=0.003),焦虑指数显著增加(=0.000);而经过8周跑台运动,CSD运动组大鼠与CSD组大鼠比较,ORT显著增加(=0.028),焦虑指数显著下降(=0.045),而ORE无显著改变(=0.862);而与SG组比较,EX组大鼠ORT、ORE均明显增加(=0.047,=0.000),焦虑指数显著下降(=0.000)。
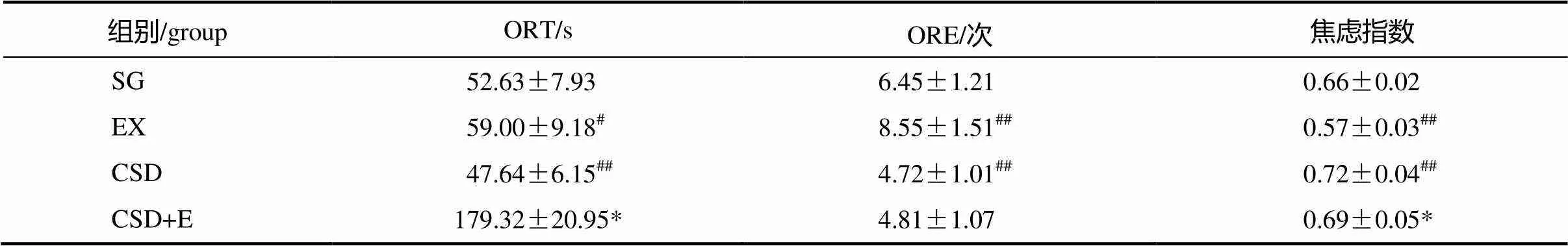
表1 各组大鼠高架迷宫实验中开放臂时间、次数及焦虑指数结果
注:##<0.01,#<0.05,vs SG group;*<0.05,CSD+E vs CSD group。
2.2 跑台运动对CSD大鼠学习记忆能力的影响
双因素方差分析显示,CSD和跑台运动显著影响了大鼠ERM实验中训练达到标准次数(F1,43=55.442,=0.000;F1,43=25.442,=0.000)、错误潜伏期(F1,43=43.222,=0.000;F1,43=10.550,=0.002)、第一次错误前正确次数(F1,43=21.316,=0.000;F1,43=5.329,=0.026)及总错误次数(F1,43=121.121,=0.000;F1,43=5.981,=0.019);运动和慢性睡眠剥夺除对训练达到标准次数具有交互效应外(F1,43=9.750,=0.003),错误潜伏期(F1,43=1.591,=0.215)、第一次错误前正确次数(F1,43=0.592,=0.446)及总错误次数(F1,43=1.495,=0.229)均无显著交互效应。
图2显示,与SG组比较,CSD组大鼠训练达到标准次数(15.72±2.28次)及TM(6.19±1.16次)显著增多(=0.000,=0.003)、错误潜伏期(302.37±42.22 s)缩短(=0.003)、第一次错误前正确次数(3.18±0.98次)减少(=0.035);而经过8周跑台运动,与CSD组大鼠比较,CSD运动组大鼠达到标准次数(11.09±1.92次)及TM(5.09±0.94次)显著减少(均=0.000)、错误潜伏期(357.45±46.25 s)显著延长(=0.000)、第一次错误前正确次数(4.27±1.10次)增多(=0.000);与SG组比较,EX组大鼠训练达到标准次数及TM显著减少(=0.045,=0.039),其它指标均无显著差异(均>0.05)。
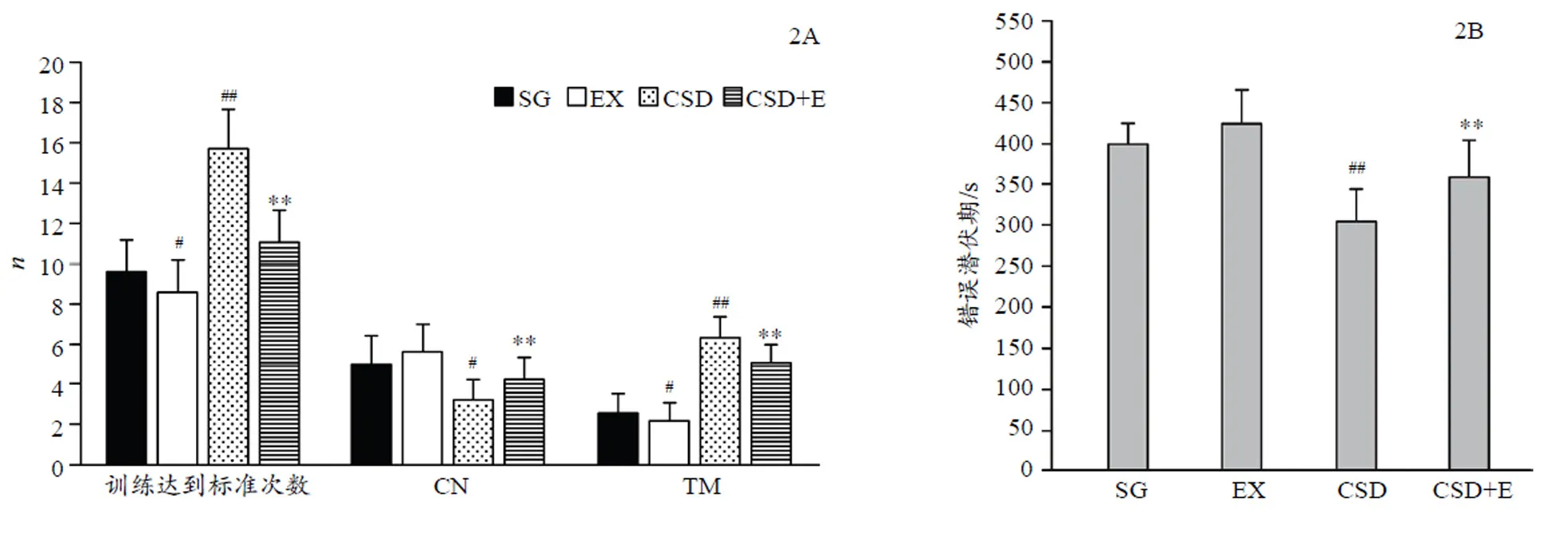
Figure 2. Results of the Numbers of Achieving Training Standard, Correct Numbers before First Error, Total Memory Errors and the Latency of Memory Error after 8-week Treadmill Exercise or CSD Treatment among SG, EX, CSD and CSD+E Groups
注:##<0.01,<0.05,vs SG group;**<0.01,CSD+E vs CSD group。
2.3 跑台运动对CSD大鼠海马炎症因子TNF-a及IL-6的影响
双因素方差分析显示慢性睡眠剥夺和跑台运动显著影响了海马促炎因子IL-6(F1,43=6.827,=0.017)及TNF-a水平(F1,43=91.792,=0.000),然而运动和慢性睡眠剥夺对IL-6及TNF-a均无交互效应(F1,43=0.010,=0.922;F1,43=1.117,=0.303)。
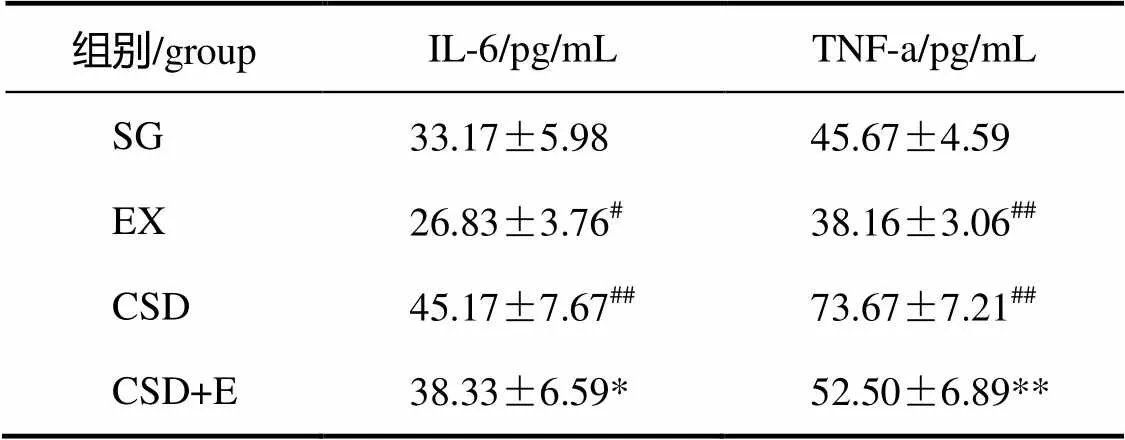
表2 各组大鼠海马炎症因子TNF-a及IL-6结果
注:##<0.01,#<0.05,vs SG group;**<0.01,*<0.05,CSD+E vs CSD group。
与对照组比较,CSD组大鼠海马促炎因子IL-6及TNF-a水平明显增加(=0.003,=0.000);而经过8周跑台运动,与CSD组大鼠比较,CSD运动组大鼠海马促炎因子IL-6及TNF-a水平显著减少(=0.039,=0.000);与对照组比较,运动组海马促炎因子IL-6及TNF-a水平显著下降(=0.046,=0.000)。
2.4 跑台运动对CSD大鼠海马DG区BDNF表达的影响
双因素方差分析显示,慢性睡眠剥夺和跑台运动显著影响了海马DG区BDNF个数(F1,39=111.962,=0.000;F1,39=51.621,=0.000)及面积(F1,39=120.822,=0.000;F1,39=53.980,=0.000),然而运动和慢性睡眠剥夺对海马DG区BDNF个数及面积均无交互效应(F1,39=1.382,=0.247;F1,39=1.118,=0.297)。
图3和图6显示,与对照组比较,CSD组大鼠海马DG区BDNF个数(8.18±1.16个)及面积(901.58±124.81μm2)均明显减少(均=0.000),减少幅度分别为33.33%及33.72%;而经过8周跑台运动,与CSD组大鼠比较,CSD运动组大鼠海马DG区BDNF个数(11.09±1.22个)及面积(1221.64±139.59μm2)均明显增加(均=0.000),增加幅度为26.24%、26.19%;与对照组比较,运动组大鼠海马DG区BDNF个数(14.36±1.28个)及面积(1599.98±134.62μm2)均明显增加(均=0.000),增加幅度分别为17.03%、17.61%。
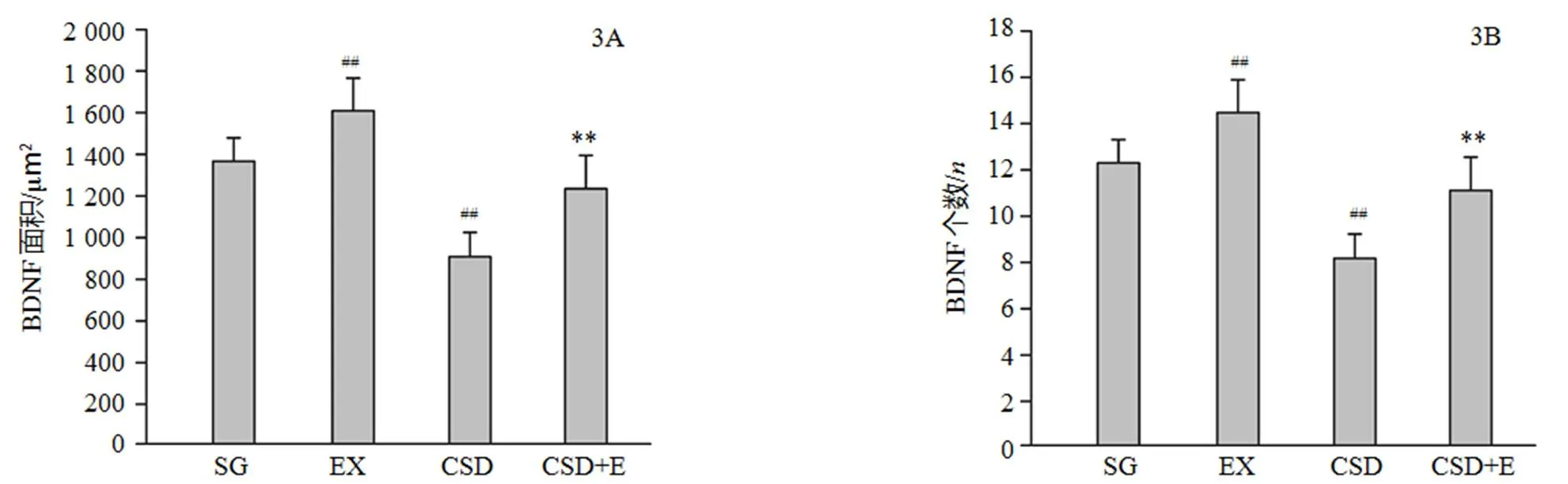
图3 对照组(SG)、运动组(EX)、CSD组及CSD运动组(CSD+E)大鼠海马DG区BDNF比较
Figure 3. Results of BDNF Expression in Hippocampus DG among SG, EX, CSD and CSD+E Groups
注:##<0.01,<0.05,vs SG group;**<0.01,*<0.05,CSD+E vs CSD group。
2.5 跑台运动对CSD大鼠海马DG区TrkB表达的影响
双因素方差分析显示,CSD明显影响了海马DG区TrkB个数(F1,39=64.167,=0.000)及面积(F1,39=58.005,=0.000),而运动显著影响了海马DG区TrkB个数(F1,39=4.804,=0.035),对TrkB面积(F1,39=3.346,=0.076)无明显影响,并且运动和慢性睡眠剥夺对海马DG区BDNF个数及面积均无交互效应(F1,39=2.775,=0.104;F1,39=1.121,=0.297)。
图4和图7显示,与对照组比较,CSD组大鼠海马DG区TrkB个数(7.10±0.99个)及面积(883.28±119.71μm2)均明显减少(均=0.000),减少幅度分别为40.83%及38.45%;而经过8周跑台运动,与CSD组大鼠比较,CSD运动组大鼠海马DG区TrkB个数(9.30±1.94个)及面积(1074.49±223.62μm2)均明显增多(=0.010,=0.049);与对照组比较,运动组大鼠海马DG区TrkB个数(12.30±2.00个)及面积(1486.24±252.02μm2)均无明显差异(=0.712,=0.589)。
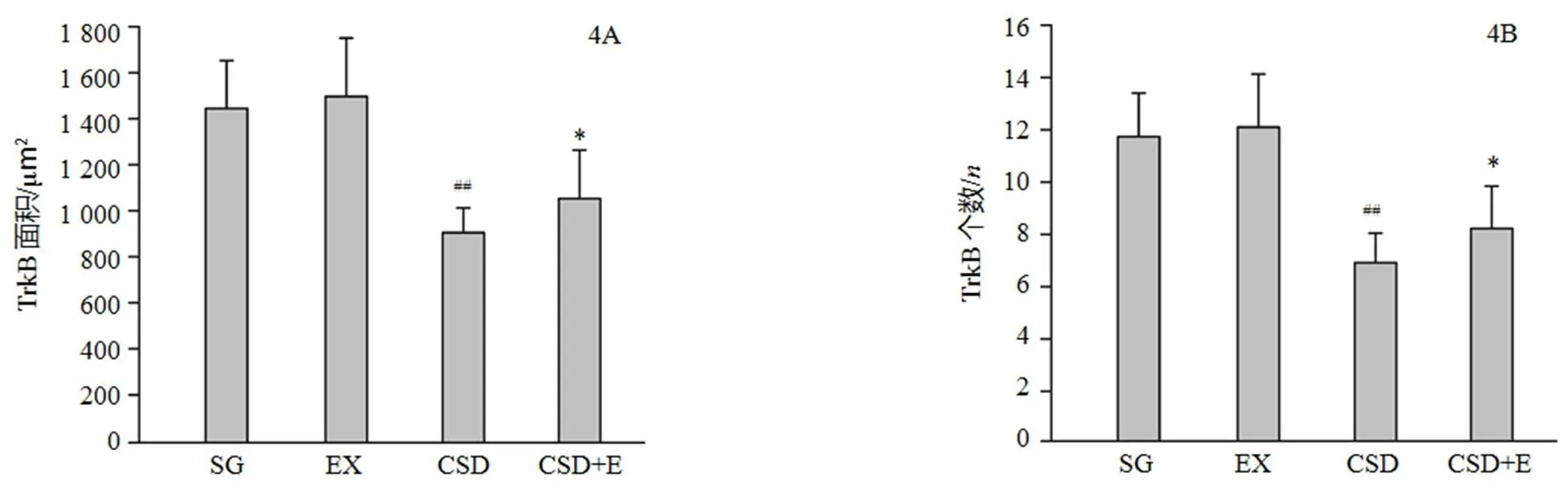
图4 对照组(SG)、运动组(EX)、CSD组及CSD运动组(CSD+E)大鼠海马DG区BDNF及TrkB比较
Figure 4. Results of BDNF and TrkB Expression in Hippocampus DG among SG, EX, CSD and CSD+E Groups
注:##<0.01,vs SG group;*<0.05,CSD+E vs CSD group。

图5 冠状位下海马DG截面图(A,箭头所示)及DG区BDNF及TrkB阳性神经元分布
Figure 5. Coronal Section for Dissection in Hippocampus DG(A, arrow), Distribution of BDNF and TrkB in Hippocampus DG(B-C, 10×10, 10×40)
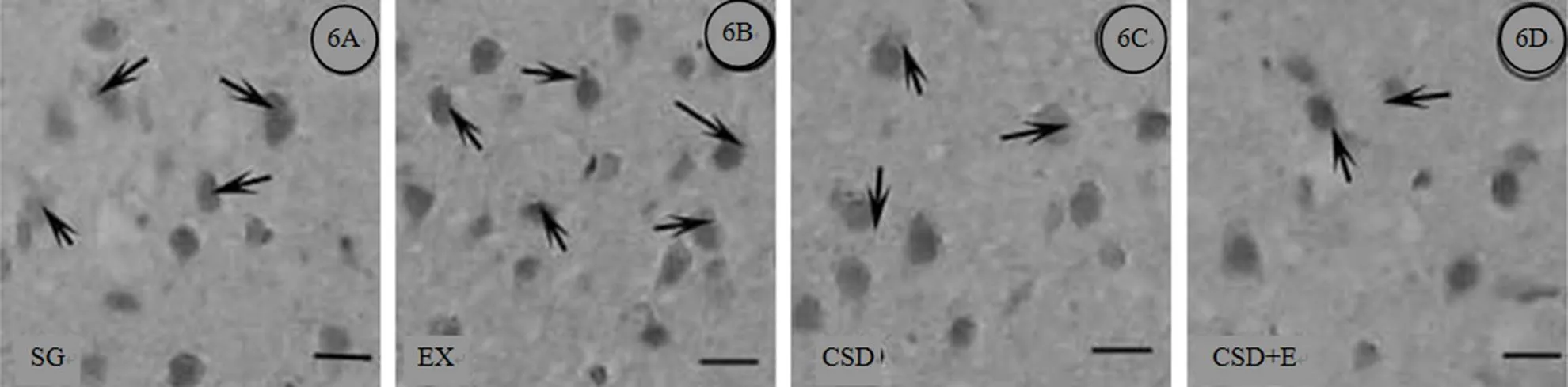
图6 海马DG区BDNF阳性神经元分布的免疫组织化学图
Figure 6. The Distribution of BDNF Immunoreactive Neurons in Hippocampus DG
注:1)CSD组大鼠海马DG区BDNF(→)表达降低;跑台运动8周后CSD+E组大鼠BDNF(→)表达增强;2)bar=50μm(6A-6D);A:对照组(SG);B:运动组(EX);C:慢性睡眠剥夺组(CSD);D:睡眠剥夺运动组(CSD+E)。
Figure 7. The Distribution of TrkB Immunoreactive Neurons in Hippocampus DG
注:1)CSD组大鼠海马DG区TrkB(→)表达降低;跑台运动8周后CSD+E组大鼠TrkB(→)表达与CSD组比较显著增强;2)bar=50μm(7A-7D);A:对照组(SG);B:运动组(EX);C:慢性睡眠剥夺组(CSD);D:睡眠剥夺运动组(CSD+E)。
3 讨论
3.1 跑台运动对慢性睡眠剥夺大鼠焦虑行为及认知功能的影响
在全球范围内,缺乏睡眠已成为一个重要的健康和公共安全问题。临床研究表明,长期睡眠不足会导致健康个体出现一般性和特异性焦虑症状,并且睡眠剥夺患者70%患焦虑症(Babson et al.,2010)。Baum等(2014)发现5天睡眠剥夺(每晚睡眠6.5 h)使青少年的焦虑情绪增加、控制负面情绪的能力下降。另一项研究发现,连续56 h的睡眠剥夺会导致健康个体出现紧张、躁动等焦虑、抑郁情绪及偏执症状(Kahn-Greene et al.,2007)。Manchanda等(2018)通过动物睡眠剥夺模型证实,慢性睡眠剥夺21天(每天剥夺18 h)可导致大鼠焦虑样行为。本研究得到相同结果,大鼠经过8周慢性睡眠剥夺(多平台水环境法,每天剥夺18 h),与对照组比较,CSD组大鼠进入开放臂次数和停留时间显著减少,焦虑指数增加,说明长期睡眠不足可导致大鼠焦虑水平升高。然而有些研究与本研究结果相反,Novati等(2011)研究发现,将幼鼠在旋转滚筒上慢性睡眠剥夺1个月(每天睡眠剥夺20 h)对焦虑样行为没有影响。且Wegner等(2014)最近的一项研究表明,连续3天不完全睡眠剥夺后小鼠表现出类焦虑样行为,如果被剥夺7天小鼠的焦虑样行为显著增强。结合当前的研究可以认为,慢性睡眠剥夺是否引起焦虑样行为可能与CSD诱导模型及持续时间有关。
研究表明,体育锻炼对改善抑郁、焦虑等心理障碍均有积极作用。Youngstedt等(2006)认为焦虑症状改善或许是运动有益于睡眠的可能机制。Pietrelli等(2011)通过高架迷宫实验证实,跑台运动使CSD大鼠开放臂时间显著增加,结果表明运动锻练显著削弱了CSD大鼠的焦虑样行为。本研究得到相同结果,经过8周中等强度跑台运动,CSD运动组大鼠焦虑行为显著削弱,表现为与CSD组大鼠比较,EPM实验中CSD运动组大鼠开放臂次数及时间均显著增加,焦虑指数下降。然而,Lalanza等(2012)通过高架迷宫行为学测试发现,11周跑台运动对CSD小鼠没有抗焦虑作用,研究结果的差异可能与物种、运动频率和运动强度有关。
睡眠对学习记忆能力很重要,在觉醒时被激活的神经元,在非快速眼动(NREM)和快速眼动(REM)睡眠中被重新激活,因此,睡眠可能参与了对空间信息的巩固和编码(Poe et al.,2000)。而多项研究证实,睡眠剥夺对注意力、工作记忆和其他认知任务均会产生不良影响,尤其会削弱记忆的保持及巩固过程。Van等(2003)研究认为,轻度(~3 h/天)和重度(~7 h/天)的睡眠限制持续1~2周会对注意力和认知能力产生不良影响,而Guzman-Marin等(2007)通过动物实验研究发现,少于24 h睡眠剥夺不影响海马神经细胞增值,而≧72 h睡眠限制可能会有累积效应,可降低30%~80% 海马神经细胞增值,最终,通过破坏海马的可塑性和细胞功能导致认知障碍,结果提示,睡眠限制对大鼠认知功能损害呈时间依赖性。Alzoubi等(2017)通过八臂迷宫实验证实,6周慢性睡眠剥夺会损害海马依赖的短时和长时记忆,并且学习之前睡眠剥夺会减少对知识的获取并损害记忆巩固功能。且Yoo等(2007)认为,学习前睡眠缺失会导致情景记忆编码过程中海马活动明显减弱,导致后期记忆能力下降,图像识别能力下降19%。总之,各种形式的睡眠剥夺已被证明会对保留新信息和破坏记忆巩固能力产生不利影响,本研究采用多平台水环境法建立大鼠CSD模型,结果发现,与对照组比较,CSD组大鼠训练达到标准次数及总错误次数显著增多、错误潜伏期显著缩短、第一次错误前正确次数减少,说明慢性睡眠剥夺 8周损害了大鼠海马依赖的空间学习与记忆能力,与前期学者研究结果一致。
临床研究证实,体育锻炼可改善失眠患者睡眠质量,对神经功能具有保护作用。且本课题组前期研究证实,4周跑台运动预干预可通过增强前额叶皮质氧化应激能力改善急性睡眠剥夺(72 h睡眠剥夺)大鼠学习记忆能力。Zielinski等(2013)通过水迷宫实验证实,11周中等强度跑台运动(1 h/天/6天/周)可改善慢性睡眠剥夺引起的小鼠学习记忆障碍。本研究得到相同结果,与CSD组大鼠比较,经过8周跑台运动,八臂迷宫实验中CSD运动组大鼠训练达到标准次数及总错误次数显著减少、错误潜伏期显著延长、第一次错误前正确次数增多。而且8周跑台运动对正常大鼠学习记忆能力也有较大益处,具体表现为与对照组比较,运动组大鼠训练达到标准次数及总错误次数均显著减少,说明跑台运动对正常大鼠及CSD大鼠学习记忆能力均有显著改善。
3.2 跑台运动对CSD大鼠海马炎症因子IL-6和TNF-a的影响
据报道,睡眠不足会增加免疫功能障碍的风险,导致大脑炎症反映增强(Rico-Rosillo et al.,2018),在炎症反应过程中,小胶质细胞被激活,影响细胞因子的释放(促炎因子增加、抗炎因子减少),而细胞因子水平的不平衡被发现是导致抑郁及焦虑的主要原因(Braun et al.,2012)。TNF-a、IL-6属于促炎细胞因子,TNF-a是较早释放的具有多种生物效应的重要促炎细胞因子,可诱发“次级”炎症因子的产生,导致神经元损伤,使机体学习、记忆能力减退(Zhu et al.,2012)。临床及动物实验研究发现,睡眠缺失可增加血液及大脑(海马及前额叶皮质等)炎症标志物IL-6、TNF-α及IL-1β 水平(Manchanda et al.,2018)。前期学者研究证实,短时间睡眠剥夺(1 h和3 h)对雄性成年小鼠大脑IL-1β,TNF-α和IL-6 mRNA水平无显著影响];在另一项实验中,Zielinski等(2013)研究发现,完全睡眠剥夺72 h 大鼠海马回和基底前脑TNF-α 及IL-6水平显著升高。而Wisor等(2011)认为,慢性睡眠剥夺结束后3周海马体中炎症因子IL-1、IL-6、TNF-α 仍呈不同程度升高,结果表明,慢性睡眠剥夺即使在较长时间恢复后,神经炎症因子对大脑损害仍会持续。本研究结果发现,与对照组比较,8周慢性睡眠剥夺使大鼠海马促炎因子IL-6及TNF-α水平显著增加。近期学者研究认为,脑组织IL-1、TNF、及IL-6等炎症因子水平升高可能与情绪和认知功能障碍有关(Manchanda et al.,2018)。并且Souza等(2012)研究认为,TNF-a及IL-6水平升高可增加血脑屏障的通透性,产生氧自由基并引起凋亡蛋白 caspase-3和Bax的表达增高,导致海马神经元凋亡率增加,加速神经细胞的死亡。海马被认为是炎症损伤的大脑区域之一,与学习和记忆密切相关。因此可以认为,本研究CSD大鼠焦虑行为及海马依赖的学习记忆能力下降可能与睡眠不足引起的海马神经促炎因子水平升高导致大脑抗氧化能力下降、引起细胞凋亡甚至死亡,损害海马结构和功能,从而导致CSD大鼠学习记忆能力下降。有学者认为,睡眠剥夺作为一种应激源可激活HPA轴活性增加糖皮质激素过度分泌,在一定程度上可增强促炎因子IL-1、TNF-α及IL-6水平(Rhen et al.,2005)。另外,睡眠剥夺可能会引起大鼠脑不同部位的血脑屏障受到损害尤其是海马体的血脑屏障更具有渗透性从而使促炎细胞因子更容易进入海马体,削弱海马神经发生、损害CSD大鼠认知功能,然而这些指标本实验均未涉及,需要进一步研究证实。
研究认为,体育锻炼可通过抗炎作用起到神经保护作用。Chennaoui等(2015)研究发现,7周跑台运动可减少正常睡眠大鼠海马TNF-α和IL-6蛋白含量,与本研究结果一致。Wannamethee等(2002)对4252名年龄在60到79岁老年男性进行研究发现,体育锻炼与促炎因子呈显著负相关。Gomes等(2013)研究发现,运动锻炼可通过降低海马IL1β/IL10,IL6/IL10及TNFα/IL10 比率降低神经炎症相关疾病的风险。而Chennaoui 等(2015)研究发现,7周跑台运动预干预可减少睡眠剥夺大鼠(24h)海马TNF-α、IL-6蛋白含量,但是对外周TNF-α含量无显著影响。然而有氧运动对慢性睡眠剥夺引起的神经炎症方面的作用还没有得到广泛的研究。本研究发现,与CSD组比较,CSD运动组大鼠跑台运动8周海马促炎因子TNF-α、IL-6水平显著下降,说明此运动具有一定的抗神经炎症作用。因此本研究海马抗炎能力增强在一定程度上可能与跑台运动改善CSD大鼠学习记忆能力及焦虑样行为有关,具体机制需进一步研究。
3.3 跑台运动对CSD大鼠海马DG区BDNF、TrkB表达的影响
睡眠在正常的生理功能中起着关键作用,睡眠不足可能会激活机体应激系统,与焦虑、抑郁及认知功能下降有关。有证据表明,BDNF/TrkB信号通路可调节REM及NREM,并且在睡眠不足导致的相关精神障碍发病机制中起着关键作用(Garner et al.,2018)。BDNF是一种中枢神经营养因子,在整个中枢神经系统都有表达,海马表达尤其丰富,并且强有力的证据表明BDNF在调节睡眠中起着重要作用(Faraguna et al.,2008),但是睡眠剥夺对海马BDNF水平变化的研究存在争议。Fujihara等(2003)研究发现短期非选择性睡眠剥夺可显著增加海马BDNFmRNA表达,但对小脑和脑干BDNF表达无显著影响。而另一项研究发现,8到48 h的睡眠剥夺可导致海马齿状回BDNFmRNA水平下降(Alhaider et al.,2010),且本课题组前期研究发现72 h急性睡眠剥夺可显著降低前额叶皮质及杏仁核BDNF的表达(崔建梅 等,2016)。研究表明,海马DG区在突触可塑性及神经元编码中扮演着关键角色,并且对睡眠剥夺高度敏感。因此本研究聚焦海马DG 区,通过8周慢性睡眠剥夺(每天睡眠剥夺18 h),结果发现,与正常大鼠比较,CSD组大鼠海马齿状回BDNF及TrkB表达显著减少。另外有研究发现,慢性睡眠剥夺21天,大鼠血清皮质醇水平显著增加,并表现出焦虑样行为。而且,Wang等(2018)认为急慢性应激可降低海马DG区BDNF的表达与应激诱导的糖皮质激素水平升高有关,因此可以认为本实验中CSD大鼠焦虑样行为及学习记忆能力下降可能与CSD作为一种应激源抑制海马DG区BDNF和TrkB表达及抑制TrkB磷酸化有关,表明BDNF-TrkB信号通路参与了慢性睡眠剥夺导致的大鼠学习记忆障碍。然而有研究认为,睡眠不足会导致海马体积减小,而不会引起 HPA轴的激活,并且长时间CSD会导致明显的学习障碍,这些障碍并不能通过切除肾上腺来预防,这表明CSD大鼠学习记忆能力下降可能与应激激素无关(Novati et al.,2010; Tiba et al.,2010)。因此针对CSD大鼠BDNF及其受体TrkB水平下降机制需进一步研究。
多数学者研究认为,运动锻炼可以增加与可塑性相关的生长因子的表达,脑源性神经营养因子BDNF与其受体TrkB结合在LTP的诱导及神经发生中发挥重要作用,被认为是运动改善海马依赖的认知功能的重要调节因子(Cotman et al.,2007)。前期研究表明,跑步、游泳等体育活动均可以增加啮齿动物大脑BDNF及TrkB的表达(Radak et al.,2006),然而本研究发现,8周跑台运动显著增加了正常大鼠海马DG区BDNF表达,但对海马DG区TrkB表达无显著影响。Tripp等(2012)通过临床研究发现,重度抑郁症患者杏仁核BDNF的表达减少,而TrkB表达无显著改变,认为BDNF水平变化与其上游及下游通路复杂整合有关。因此,本研究跑台运动对正常大鼠BDNF水平上调可能与此运动激活BDNF上游通路有关,具体机制需进一步研究。
研究认为,适度跑台运动已被证明可以改善睡眠缺失引起的情绪障碍及认知功能下降,而海马BDNF活性增加可能介导这些效应,有助于维持大脑健康和突触可塑性(Zagaar et al.,2013)。Saadati等(2014)发现规律跑台运动可能通过诱导海马BDNF表达而对去卵巢睡眠剥夺大鼠海马相关功能起保护作用。Zagaar等(2013)研究发现,跑台运动预干预4周,可通过上调海马BDNF及P-CREB(环磷腺苷结合蛋白)水平防止24 h完全睡眠剥夺引起的短期记忆和E-LTP损害。本研究结果发现,与CSD组大鼠比较,CSD运动组大鼠海马DG区BDNF 及TrkB表达显著增多。BDNF可以保护中枢神经元免受损伤,通过强迫游泳实验证实,脑室内注射BDNF和TrkB受体激动剂可降低习得性无助大鼠海马CA3及DG的损伤,从而改善大鼠抑郁样行为;此外,当BDNF表达或TrkB信号中断时,抗抑郁药物的疗效会显著降低甚至消失,提示BDNF-TrkB信号通路对抗抑郁药物的治疗效果至关重要(Liu et al., 2010);Zheng等(2018)研究发现,多奈哌齐可通过激活BDNF/TrkB信号通路改善阿尔茨海默氏症引起的认知障碍。因此,本实验中跑台运动改善CSD大鼠学习记忆能力可能与此运动激活海马DG区BDNF/TrkB信号通路有关,BDNF与TrkB结合可以诱导大量突触可塑性相关基因的表达,这些基因可能在结构和功能上启动突触,调节突触稳定性,参与学习记忆的调节,从而增强CSD大鼠的学习记忆能力(Song et al.,2013)。研究证明,促炎细胞因子可抑制脑内BDNF的表达,大鼠脑室内注射TNF-α可抑制大脑皮层及海马BDNF的表达,并且脑室内注射IL-1β可增强海马TNF-α表达,同时会抑制BDNF表达(Zielinski et al.,2014)。Yang等(2017)研究发现,糖尿病大鼠海马环氧酶-2表达增强(其产物前列腺素E是重要的炎症介质)可导致海马慢性炎症损害海马BDNF-TrkB信号通路,与糖尿病大鼠的记忆缺失有关。此外,Xu等(2017)研究认为BDNF预处理可抑制脑膜炎大鼠海马TNF-α、IL-1β及IL-6水平,增加抗炎因子IL-10的表达,从而认为BDNF治疗可能是细菌性脑膜炎的一种潜在的治疗策略。以上研究表明,神经炎症与BDNF-TrkB信号通路相互影响可能在认知功能及情绪障碍的病理发展中发挥重要作用。因此可以推测,跑台运动增强CSD大鼠学习记忆能力及改善焦虑样行为可能与此运动增强海马抗炎能力、激活海马DG区BDNF-TrkB信号通路从而纠正慢性睡眠剥夺诱导的海马功能紊乱起到脑保护作用有关,而神经炎症是否介导了跑台运动对CSD大鼠海马DG区BDNF-TrkB信号通路的激活,需要进一步研究证实。
4 结论
1)8周CSD可导致大鼠焦虑样行为及认知功能下降,海马神经炎症反应加深,海马DG区BDNF及TrkB表达下降。提示,海马可能是CSD引起大鼠行为学改变的作用脑区之一,且这一作用可能是由海马炎症反应加强、海马DG区BDNF-TrkB信号通路下调共同介导的。
跑台运动增强CSD大鼠学习记忆能力及改善焦虑样行为可能与此运动增强海马抗炎能力、激活海马DG区BDNF-TrkB信号通路从而纠正慢性睡眠剥夺诱导的海马功能紊乱起到脑保护作用有关。
崔建梅, 郭燕兰, 赵行瑞, 等. 2016. 运动预干预通过增强杏仁核抗氧化能力及BDNF表达改善睡眠剥夺大鼠焦虑行为[J]. 沈阳体育学院学报, 35(3):79-84.
ABROUS D N, KOEHL M, LE Moal M. 2005. Adult neurogenesis: from precursors to network and physiology[J]. Physiol Rev, 85(2): 523-69.
AIMONE J B, DENG W, GAGE F H, 2011. Resolving new memories: a critical look at the dentate gyrus, adult neurogenesis, and pattern separation[J]. Neuron,70(4):589-96.
ALHAIDER I A, ALEISA A M, TRAN T T, et al.,2010. Caffeine prevents sleep loss-induced deficits in long-term potentiation and related signaling molecules in the dentate gyrus[J]. Eur Neurosci, 31:1368-76.
ALTERMAN T, LUCKHAUPT S E, DAHLHAMER J M, et al.,2013. Prevalence rates of work organization characteristics among workers in the US: data from the 2010 National Health Interview Survey[J]. Am J Ind Med, 56:647-659.
ALZOUBI K H, KHABOUR O F, ALBAWAANA A S, et al.,2016. Tempol prevents chronic sleep -deprivation induced memory impairment[J]. Brain Res Bull, 120:144-50.
ALZOUBI K H, MAYYAS F A, KHABOUR O F, et al.,2016. Chronic Melatonin Treatment Prevents Memory Impairment Induced by Chronic Sleep Deprivation[J]. Mol Neurobiol, 53(5): 3439-3447.
ALZOUBI K H, RABABA'H A M, OWAISI A, et al.,2017. L-carnitine prevents memory impairment induced by chronic REM-sleep deprivation[J]. Brain Res Bull, 131:176-182.
BABSON K A, TRAINOR C D, FELDNER M T, et al.,2010. A test of the effects of acute sleep deprivation on general and specific self-reported anxiety and depressive symptoms: an experimental extension[J]. J Behav Ther Exp Psychiatry, 41(3):297-303.
BAUM K T, DESAI A, FIELD J, et al.,2014. Sleep restriction worsens mood and emotion regulation in adolescents[J]. J Child Psychol Psychiatry, 55(2):180-90.
BESEDOVSKY L, LANGE T, BORN J. 2012. Sleep and immune function[J]. Plug Arch Eur J Physiol, 463(1):121-137.
BRAUN T P, GROSSBERG A J, VELEVA-ROTSE B O, et al.,2012. Expression of myeloid differentiation factor 88 in neurons is not requisite for the induction of sickness behavior by interleukin-1β[J]. J Neuroinflammation, 9:229.
CHEN X, WANG X, TANG L, et al.,2017. Nhe5 deficiency enhances learning and memory via upregulating Bdnf/TrkB signaling in mice[J]. Am J Med Genet B Neuropsychiatr Genet, 174 (8):828-838.
CHENNAOUI M, GOMEZ-Merino D, DROGOU C, et al.,2015. Effects of exercise on brain and peripheral inflammatory biomarkers induced by total sleep deprivation in rats[J]. Inflamm, 12 (1):1-10.
COTMAN C W, BERCHTOLD N C, CHRISTIE L A. 2007. Exercise builds brain health: an interplay of central and peripheral factors[J]. Trends Neurosci,30:467-471.
DE SOUZA L, SMAILI S S, URESHINO R P, et al.,2012. Effect of chronic sleep restriction and aging on calcium signaling and apoptosis in the hippocampus of young and aged animals[J]. Prog Neuropsychopharmacol Biol Psychiatry, 39(1):23-30.
FARAGUNA U, VYAZOVSKIY V V, Nelson A B, et al.,2008. A causal role for brain-derived neurotrophic factor in the homeostatic regulation of sleep[J]. Neurosci, 28(15):4088-95.
FUJIHARA H, SEI H, MORITA Y, et al.,2003. Short-term sleep disturbance enhances brain-derived neurotrophic factor gene expression in rat hippocampus by acting as internal stressor[J]. J Mol Neurosci, 21(3):223-32.
GARNER J M, CHAMBERS J, BARNES A K, et al.,2018. Changes in Brain-Derived Neurotrophic Factor Expression Influence Sleep-Wake Activity and Homeostatic Regulation of Rapid Eye Movement Sleep[J]. Sleep, 41(2): zsx194.
GOMES DA SILVA S, SIMÕES P S, MORTARA R A, et al.,2013. Exercise-induced hippocampal anti-inflammatory response in aged rats[J]. J Neuroinflammation, 10(1):61.
GUZMAN-Marin R, BASHIR T, SUNTSOVA N, et al.,2007. Hippocampal neurogenesis is reduced by sleep fragmentation in the adult rat[J]. Neuroscience, 148(1):325-33.
HURTADO-ALVARADO G, PavóN L, CASTILLO-GARCía S A, et al.,2013. Sleep Loss as a Factor to Induce Cellular and Molecular Inflammatory Variations[J]. Clin Dev Immunol:801341.
KAHN-GREENE E T, KILLGORE D B, KAMIMORI G H, et al.,2007. The effects of sleep deprivation on symptoms of psychopathology in healthy adults[J]. Sleep Med, 8(3):215-21.
KLINE R, WONG E, HAILE M, et al.,2016. Peri-Operative Inflammatory Cytokines in Plasma of the Elderly Correlate in Prospective Study with Postoperative Changes in Cognitive Test Scores[J]. Int J Anesthesiol Res, 4(8):313-321.
KRISHNAN H C, NOAKES E J, LYONS L C, 2016. Chronic sleep deprivation differentially affects short and long-term operant memory in Aplysia[J].Neurobiol Learn Mem, 134 Pt B:349-59.
LALANZA J F, SANCHEZ-ROIGE S, GAGLIANO H, et al.,2012. Physiological and behavioural consequences of long-term moderate treadmill exercise[J]. Psychoneuroendocrinology, 7(11):1745-54.
LEKANDER M, ANDREASSON A N, KECKLUND G, et al.,2013. Subjective health perception in healthy young men changes in response to experimentally restricted sleep and subsequent recovery sleep[J]. Brain Behav Immun, 34(11):43-46.
LIU X, CHAN C B, JANG S W, et al.,2010. A synthetic7,8-dihydroxyflavone derivative promotes neurogenesis and exhibits potent antidepressant effect[J]. J Med Chem, 53(23):8274-86.
MANCHANDA S, SINGH H, KAUR T, et al.,2018. Low-grade neuroinflammation due to chronic sleep deprivation results in anxiety and learning and memory impairments[J]. Mol Cell Biochem, 449(1-2):63-72.
MARKS CA, WAYNER M J, 2005. Effects of sleep disruption on rat dentate granule cell LTP in vivo[J]. Brain Res Bull, 66(2):114-119.
MAZOR A, MATAR M A, KAPLAN Z, et al.,2009. Gender-related qualitative differences in baseline and post-stress anxiety responses are not reflected in the incidence of criterion-based PTSD-like behaviour patterns[J]. World J Biol Psychiatry, 10:856-869.
MONJE M L, TODA H, PALMER T D, 2003. Inflammatory blockade restores adult hippocampal neurogenesis[J]. Science, 302 (5651): 1760-1765.
NOVATI A, HULSHOF H J, KOOKHAAS J M, et al.,2011. Chronic sleep restriction causes a decrease in hippocampal volume in adolescent rats, which is not explained by changes in glucocorticoid levels or neurogenesis[J]. Neuroscience, 190(36):145-55.
NOVATI H J, HULSHOF J M, KOOLHA A S, et al.,2011. Chronic sleep restriction causes a decrease in hippocampal volume in adolescent rats, which is not explained by changes in glucocorticoid levels or neurogenesis[J]. Neuroscience, 190:145-55.
PIETRELLI A, LOPEZ-COSTA J J, GONI R, et al.,2011. Effects of moderate and chronic exercise on the nitrergic system and behavioral parameters in rats[J]. Brain Research, 1389(10):71-82.
POE G R, NITZ D A, MCNAUGHTON B L, et al.,2000. Experience-dependent phase-reversal of hippocampal neuron firing during REM sleep[J]. Brain Res, 855(1):176-80.
RADAK Z, TOLDY A, SZABO Z, et al.,2006. The effects of training and detraining on memory, neurotrophins and oxidative stress markers in rat brain[J]. Neurochem Int, 49(4):387-92.
RHEN T, CIDLOWSKI J A, 2005. Antiinflammatory action of glucocorti coids-newmechan- isms for old drugs[J]. N Engl J Med, 353:1711-1723.
RICO-ROSILLO M G, VEGA-ROBLEDO G B, 2018. Sleep and immune system[J]. Rev Alerg Mex, 65(2):160-170.
RIMES R R, de SOUZA MOURA A M, LAMEGO M K, et al.,2015. Effects of Exercise on Physical and Mental Health, and Cognitive and Brain Functions in Schizophrenia: Clinical and Experimental Evidence[J]. CNS Neurol Disord Drug Targets, 14(10):1244-54.
RINGEL B L, SZUBA M P, 2001. Potential mechanisms of the sleep therapies for depression[J]. Depress Anxiety, 14(1):29-36.
SAADATI H, SHEIBANI V, ESMAEILI-MAHANI S, et al.,2014. Prior regular exercise reverses the decreased effects of sleep deprivation on brain-derived neurotrophic factor levels in the hippocampus of ovariectomized female rats[J]. Regul Pept, (194-195): 11-5.
SONG C, ZHANG Y, DONG Y, 2013. Acute and subacute IL-1beta administrations differentially modulate neuroimmune and neurotrophic systems: possible implications for neuroprotection and neurodegeneration[J]. J Neuroinflammation, 10:59.
TIBA P A, OLIVEIRA M G, ROSSI V C, et al.,2008. Glucocorticoids are not responsible for paradoxical sleep deprivation-induced memory impairments[J]. Sleep, 31:505-515.
TRIPP A, OH H, GUILLOUX J P, et al.,2012. Brain-derived neurotrophic factor signaling and subgenual anterior cingulate cortex dysfunction in major depressive disorder[J]. Am J Psychiatry, 169(11):1194-202.
VAN DONGEN H P, MAISLIN G, MULLINGTON J M, et al.,2003. The cumulative cost of additional wakefulness: dose-response effects on neurobehavioral functions and sleep physiology from chronic sleep restriction and total sleep deprivation[J]. Sleep, 26(2):117-26.
VOLLERT C, ZAGAAR M, HOVATTA I, et al.,2011. Exercise prevents sleep deprivation -associated anxiety-like behavior in rats: potential role of oxidative stress mechanisms[J]. Behav Brain Res, 224(2):233-40.
WANG C, GAN D, WU J, et al.,2018. Honokiol Exerts Antidepressant Effects in Rats Exposed to Chronic Unpredictable Mild Stress by Regulating Brain Derived Neurotrophic Factor Level and Hypothalamus-Pituitary-Adrenal Axis Activity[J]. Neurochem Res, 43(8):1519 -1528.
WANNAMETHEE S G, LOWE G D, WHINCUP P H, et al.,2002. Physical activity and hemostatic and inflammatory variables in elderly men[J]. Circulation, 105 (15):1785-1790.
WEGNER M, HELMICH I, MACHADO S, et al.,2014. Effects of exercise on anxiety and depression disorders: review of meta- analyses and neurobiological mechanisms[J]. CNS Neurol Disord Drug Targets, 13(6):1002-14.
WISOR J P, SCHMIDT M A, CLEGERN W C, 2011. Evidence for neuroinflammatory and microglial changes in the cerebral response to sleep loss[J]. Sleep, 34(3):261-2.
XU D, LIAN D, WU J, et al.,2017. Brain-derived neurotrophic factor reduces inflammation and hippocampal apoptosis in experimental Streptococcus pneumoniae meningitis[J]. J Neuroi -nflammation, 14(1):156.
YANG Y, GAO L, 2017. Celecoxib Alleviates Memory Deficits by Downregulation of COX-2 Expression and Upregulation of the BDNF-TrkB Signaling Pathway in a Diabetic Rat Model[J]. J Mol Neurosci, 62(2):188-198.
YEHUDA S, SREDNI B, CARRASSO R L, et al.,2009. REM sleep deprivation in rats results in inflammation and interleukin-17 elevation[J]. JInterferon Cytokine Res, 29(7):393-8.
YOO S S, HU P T, GUJAR N, et al.,2007. A deficit in the ability to form new human memories without sleep[J]. Nat Neurosci, 10:385-392.
YOUNGSTEDT S D, KLINE C E, 2006. Epidemiology of exercise and sleep[J]. Sleep and Biological Rhythms, (3):215-221.
ZAGAAR M, DAO A, ALHAIDER I, et al.,2013. Regular treadmill exercise prevents sleep deprivation-induced disruption of synaptic plasticity and associated signaling cascade in the dentate gyrus[J]. Mol Cell Neurosci, 56:375-83.
ZAGAAR M, DAO A, LEVINE A, et al.,2013. Regular exercise prevents sleep deprivation associated impairment of long-term memory and synaptic plasticity in the CA1 area of the hippocampus[J]. Sleep, 36(5):751-61.
ZHENG H, NIU S, ZHAO H, et al.,2018. Donepezil improves the cognitive impairment in a tree shrew model of Alzheimer's disease induced by amyloid-β1-40 via activating the BDNF/TrkB signal pathway[J]. Metab Brain Dis, 33(6):1961-1974.
ZHU B, DONG Y, XU Z, et al.,2012. Sleep disturbance induces neuroinflammation and impairment of learning and memory[J]. Neurobiol Dis, 48(3):348-55.
ZIELINSKI M R, DAVISB J M, FADEL J R, et al.,2013. Influence of chronic moderate sleep restriction and exercise on inflammation and carcinogenesis in mice[J]. Behavioural Brain Research, 250: 74-80.
ZIELINSKI M R, KIM Y, KARPOVA S A, et al.,2014. Chronic sleep restriction elevates brain interleukin-1 beta and tumor necrosis factor-alpha and attenuates brain-derived neurotrophic factor expression[J]. Neurosci Lett, 580:27-31.
ZIELINSKI M R, KRUEGER J M, 2011. Sleep and innate immunity[J]. Front Biosci (Schol Ed), 3:632-642.
Effects of Treadmill Exercise on Behavior Changes, Hippocampal Inflammation and BDNF/TrkB Pathway in the Hippocampus Dentate Gyrus ofChronic Sleep Deprived Rats
CUI Jianmei1*, GUO Yanlan1, LI Zhonghua1, Yangjie1, YU Fang1, LI Hongtao2, SU Xiaoyun3
: Physical exercise is known to improve the cognitive function decline and emotional disorders induced by chronic sleep deprivation (CSD). Therefore, the aim of this study was to examine the effects of 8 weeks treadmill exercise on CSD induced spatial memory and anxiety-like behavior by measuring hippocampus inflammatory biomarkers levels (IL-6 and TNF-α) and hippocampus DG (dentate gyrus) BDNF and TrkB expression levels.: 44 rats were randomly allocated into either a sedentary control group (SG), an exercise group (EX), a chronic sleep deprived group (CSD), or a CSD+exercise group (CSD+E). The sleep deprivation was induced by using modified multiple platform method (18 h/day, for 8 weeks) in CSD and CSD+E groups. Simultaneously, the rats in EX and CSD+E groups were conducted treadmill exercise training for 8 weeks (1 h/day, 6 d/week). Thereafter, the anxiety-related behavior was assessed with the elevated-plus maze (EPM), and the spatial learning and memory were assessed by using the eight arm maze test (ERM). Additionally, the hippocampus inflammatory biomarkers (IL-6 and TNF-α) and hippocampus DG BDNF and TrkB expression levels were measured.: 1) Compared to the sedentary control rats, the latency of memory error was shorted in CSD rats, the numbers of achieving training standard and total memory errors were significantly increased (<0.01, respectively); in addition, the correct numbers before the first error was decreased (<0.05) in the ERM test. In the EPM test, the time and entries of open arm was significantly decreased in CSD rats by comparing with SG group, and the anxiety index was increased (<0.01, respectively); the TNF-α and IL-6 concentrations in hippocampus were increased (<0.01), and the expression levels of BNDF and TrkB in hippocampus DG were decreased (<0.01). 2) 8 week treadmill exercise training was significantly attenuated anxiety-related behavior and prevented spatial learning and memory impairment; the levels of IL-6 and TNF-α in hippocampus were decreased; moreover, the expression levels of BDNF and TrkB in hippocampus DG were significantly increased after exercise training.: Moderate-intensity treadmill exercise improved the learning and memory ability and attenuate anxiety like behavior in the CSD rats. The possible mechanisms might be related to the exercise preventing pro-inflammatory responses in hippocampus, and increasing BDNF and TrkB expression in hippocampus DG and improving the nerve protective effect via BDNF/TrkB pathway.
2018-11-07;
2019-06-06
山西省自然科学基金项目(2014011041-6)
崔建梅(1972-),女,副教授,硕士,主要研究方向为运动与慢性病, E-mail: cuijm224@qq.com。
G840.7
A
1000-677X(2019)06-0062-11
10.16469/j.css.201906008

