间歇运动干预自发性高血压大鼠病理性心脏肥大:运动强度与健康效应的关系
孟宪欣,管泽毅,葛吉生,王希柳,秦永生,王大宁,彭 朋*
间歇运动干预自发性高血压大鼠病理性心脏肥大:运动强度与健康效应的关系
孟宪欣1,管泽毅1,葛吉生1,王希柳1,秦永生2,王大宁2,彭 朋2*
(1.青岛大学 体育学院,山东 青岛 266071;2.中国人民武装警察部队后勤学院 卫生勤务系,天津 300309)
:体力活动的健康促进效应与运动强度呈现剂量-反应关系。中低强度持续有氧运动已成为诸多慢性非传染性疾病患者(包括但不限于心力衰竭、高血压、糖尿病、肥胖等)一级和二级预防的重要策略,然而间歇运动尤其是高强度间歇运动(HIIT)的疗效(特别对心血管疾病患者)仍存在争议。:对比长期不同强度间歇运动对自发性高血压大鼠(SHR)病理性心脏肥大的作用并在心脏形态、结构、功能和分子等层面分析其调控机制,探讨运动强度与健康效应的关系,为制定针对心血管疾病患者的最佳运动康复处方提供循证依据和有效方法。:45只雄性SHR随机分为安静对照组(SHR-SED)、中等强度间歇运动组(SHR-MIIT)和HIIT组(SHR-HIIT),同时将15只年龄、性别相匹配的Wistar-Kyoto大鼠作为正常血压组(WKY)。WKY和SHR-SED组动物保持安静状态,SHR-MIIT、SHR-HIIT组分别进行18周MIIT或HIIT。末次实验后48 h利用无创血压仪测定尾动脉血压,超声心动图检测心脏结构与功能,H&E和Masson染色进行组织病理学观察并分别获取心肌细胞横断面积(CSA)和间质胶原容积分数(CVF),RT-PCR法检测心肌胚胎基因[心房钠尿肽(ANP)、脑钠肽(BNP)和β-肌球蛋白重链(β-MHC)]mRNA表达量,Western blot法检测病理性[钙调神经磷酸酶/活化T细胞核因子(Cn/NFAT)]和生理性[磷脂酰肌醇-3激酶/Akt(PI3-K/Akt)]心脏肥大信号途径各蛋白表达量。:1)心脏形态与结构:SHR-SED组左心室出现向心性肥大(心腔缩窄、室壁增厚、CSA升高),CVF增加(<0.05);SHR-MIIT组左心室发生离心性肥大(心腔扩张、室壁厚度),CVF下降(<0.05);SHR-HIIT组心脏同样发生离心性肥大,但心腔扩张同时室壁变薄,CVF进一步增加(<0.05)。2)心功能:SHR-SED组左心室射血分数(LVEF)下降(<0.05);与SHR-SED组比较,SHR-MIIT组LVEF升高(<0.05),而SHR-HIIT组则进一步下降(<0.05)。3)胚胎基因表达:SHR-SED组ANP、BNP和β-MHC mRNA表达量均上调(<0.05);与SHR-SED组比较,SHR-MIIT组各胚胎基因表达量均下降(<0.05),SHR-HIIT组BNP和β-MHC升高(<0.05)。4)心脏肥大信号分子蛋白表达:SHR-SED组CnAβ升高(<0.05)、p-NFATc3/t-NFATc3比值降低(<0.05),PI3-K(p110α)和p-Akt/t-Akt比值无显著性变化(>0.05);与SHR-SED组比较,SHR-MIIT组CnAβ下降(<0.05),p-NFATc3/t-NFATc3比值、PI3-K(p110α)和p-Akt/t-Akt比值升高(<0.05),SHR-HIIT组CnAβ、PI3-K(p110α)和p-Akt/t-Akt比值升高(<0.05),p-NFATc3/ t-NFATc3比值下降(<0.05)。:长期间歇运动对高血压的健康效应存在运动强度依赖性,MIIT诱导SHR心脏由病理性肥大向生理性肥大转变并改善心功能,而HIIT则加重心脏重塑并加速心力衰竭进展,其机制与不同强度间歇运动对心肌胶原代谢、胚胎基因表达以及Cn/NFAT和PI3-K/Akt信号通路的调控存在差异有关。因此,中等强度运动仍然是高血压患者临床康复的最佳方式,HIIT的安全性和有效性有待进一步证实。
间歇运动;运动强度;自发性高血压大鼠;心脏肥大;心脏重塑
心脏肥大是高血压患者心脏重塑的主要外在表现,因心肌细胞体积增大和/或细胞外基质(extracellular matrix,ECM)增多所致,最终导致心功能失代偿以及心力衰竭,属于“病理性心脏肥大”(Shenasa et al.,2017)。相反,运动员经历长期规律训练同样可发生心脏肥大,但心功能增强、运动能力提高,称为“运动员心脏”,隶属“生理性心脏肥大”(Bessem et al.,2018)。病理性与生理性心脏肥大具有本质区别,其形成机制与不同信号途径激活有关(Nakamura et al.,2018),钙调神经磷酸酶/活化T细胞核因子(calcineurin/nuclear factor of activation T cell,Cn/NFAT)和磷脂酰肌醇-3激酶/Akt(phosphoinositide 3-kinase/Akt,PI3-K/Akt)分别是介导两种心脏肥大的主要信号转导通路。
中低强度持续有氧运动(以下简称“有氧运动”)是高血压临床运动康复的主要形式且已成为多种慢性非传染性疾病(包括但不限于心力衰竭、高血压、糖尿病、肥胖等)患者一级和二级预防的重要策略(Swift et al.,2013)。越来越多的证据显示出运动对健康以及生活方式疾病的良好作用(Swift et al.,2013),因此个性化运动处方成为亟待解决的课题。研究证实(Hussain et al.,2016),体力活动的健康促进作用与运动强度呈现剂量-反应关系,高强度运动的心脏健康效应是中等强度的2倍。然而针对竞技运动员(Mousavi et al.,2009)以及实验动物(Kaleta et al.,2017)的研究亦发现,长期高强度运动可引起心脏病理性重塑并诱发心血管不良事件。因此,运动的健康效应存在“强度阈值”,超出这一阈值则造成适应不良。
间歇运动是近年来竞技体育界与大众健身领域新兴的运动方式,按照强度可分为中等强度间歇运动(moderate-intensity interval training,MIIT)和高强度间歇运动(high-intensity interval training,HIIT),其中MIIT的作用较为肯定(Batacan et al.,2014; Borges et al.,2014),而HIIT对心脏(尤其是病理状态下)的作用尚存在争议(范朋琦 等,2018;王增喜 等,2018; Hafstad et al.,2013; Holloway et al.,2015; Lu et al.,2015; Novoa et al.,2017)。因此,本研究通过设计两种不同强度间歇运动(即MIIT和HIIT),旨在对比长期(18周)间歇运动对SHR心脏肥大的作用并在心脏形态、结构、功能和分子等层面分析其调控机制,探讨运动强度与健康效应的关系。我们假设,不同强度间歇运动均可改善SHR病理性心脏肥大并抑制心脏重塑,HIIT的效果理应更为显著。
1 研究对象与方法
1.1 实验动物与分组
45只12周龄SPF级雄性SHR,体质量(220±18) g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2018-0027。将实验动物随机分为安静对照组(SHR-sedentary,SHR-SED,=15)、MIIT组(SHR-MIIT,=15)和HIIT组(SHR-HIIT,=15),同时以15只同龄雄性Wistar-Kyoto大鼠作为正常血压组(WKY)。动物饲养环境:温度20~22℃,1个标准大气压,相对湿度50%~60%,12:12 h明暗周期,分笼饲养(3只/笼),自由进食水。
大鼠适应环境1周后开始正式实验。WKY和SHR-SED组动物保持安静状态,SHR-MIIT、SHR-HIIT分别进行18周MIIT或HIIT。在实验过程中,由于拒跑、意外死亡等原因,共剔除6只大鼠,因此最终样本量=54,其中WKY组(=15)、SHR-SED组(=15)、SHR-MIIT组(=13)和SHR-HIIT组(=11)。
1.2 运动方案
大鼠先进行5天跑台适应性训练(速度:10~15 m/ min,坡度:0°,时间:30 min/天),随后参照课题组前期建立的方法(范朋琦等,2018)测定大鼠运动能力:起始负荷为5 m/min,每2 min增加1.5 m/min,直至力竭(坡度始终为0°),记录峰值跑速(peak running velocity,PRV)。
根据Hoydal等(2007)建立的大鼠跑速与最大摄氧量(maximal oxygen uptake,V̇O2max)关系以及课题组前期研究(范朋琦等,2018)制定跑台运动方案(表1),运动强度、运动时间、完成组数以及运动频率逐渐递增。分别于第4、8、12和16周重新测定PRV以及时调整运动强度(跑速)。

表1 18周运动方案
注:[5×(60% PRV×1 min+40% PRV×1 min)]×3表示以60% PRV运动1 min后以40% PRV运动1 min,依次交替重复5个循环,3周/次,其他方案以此类推。
1.3 血压以及心脏结构与功能测定
每周训练前以及末次训练后48 h,采用智能无创血压测量仪(BP-2010E,日本Softron Biotechnology公司)以Tail-Cuff法测定大鼠尾动脉血压,方法为:先将大鼠放入固定器中,随后将固定器和大鼠尾部放置在预热的加热板上稳定3 min,通过气囊自动加压阻断动脉血流,读取软件显示的收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP),连续测定3次,取均值。
末次血压测定后称量体质量(body mass,BM),随后腹腔注射戊巴比妥钠(0.1 mg/kg)麻醉动物并取仰卧位固定,胸部备皮,用高分辨率小动物超声影像系统(Vevo 3100,加拿大VisualSonics公司)检测心脏结构和功能,探头频率为14 MHz,(取胸骨旁左心室短轴切面进行测量)取左心室乳头肌水平进行二维短轴扫描(M超),扫描速度100 mm/s。检测参数包括:左心室舒张末期直径(left ventricular end-diastolic diameter LVEDD)、左心室收缩末期直径(left ventricular end- systolic diameter,LVESD)、左心室壁厚度(left ventricular wall thickness,LVWT)和左心室射血分数(left ventricular ejection fraction,LVEF)。
1.4 大鼠取材
超声检测后处死动物,取出心脏后称重(心脏质量,heart mass,HM),迅速分离左心室(保留室间隔和左心室游离壁)并称重(左心室质量,left ventricular mass,LVM),分别计算与体质量的比值作为心脏质量指数(heart mass index,HMI)和左心室质量指数(left ventricular mass index,LVMI)。在左心室最大横径处横切将其分为两部分,一部分用于心肌病理组织学观察,另一部分用锡纸包裹投入液氮并迅速转移至-80℃低温冰箱冻存待测。分离肾上腺和胸腺并称重,分别计算与体质量的比值作为肾上腺质量指数和胸腺质量指数(代表慢性应激参数),以检测是否发生肾上腺肥大和胸腺萎缩。
1.5 心肌病理组织学观察
于心脏横切面取厚度为2 mm组织,用4%多聚甲醛溶液固定24 h,石蜡包埋并利用病理切片机(RM2255,德国徕卡仪器有限公司)制作5 μm切片。用苏木素-伊红(hematoxylin and eosin,H&E)染色心肌细胞,倒置相差显微镜(IX71,日本Olympus公司)下选取10个视野,观察细胞排列、细胞核以及细胞形态等情况,用图像分析软件(Image Pro Plus 6.0,美国Media Cybernetics公司)测量心肌细胞横断面积(cross-sectional area,CSA)。用Masson染色胶原纤维,测量结缔组织面积与所测视野面积的比值作为间质胶原容积分数(collagen volumetric fraction,CVF),测量仪器、方法以及软件同H&E染色。
1.6 胚胎基因mRNA表达检测
RT-PCR法测定胚胎基因mRNA表达量,包括心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)和β-肌球蛋白重链(β-myosin heavy chain,β-MHC)。取30 mg心肌组织按照Trizol试剂盒(武汉博士德生物工程有限公司)说明提取总RNA,逆转录获取cDNA,随后利用实时荧光定量PCR仪(7500型,美国ABI公司)进行RT-PCR,引物序列见表2。反应体系为20 μL:上游和下游引物各0.4 μL,cDNA 2.0μL,SYBRTM-Green PCR Master-Mix 10 μL,dd H2O 7.2 μL。反应条件:95℃预变性5 min;94℃变性20 s、60℃退火20 s、72℃延伸10 s,共40个循环。记录循环阈值(Ct),以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,采用2-∆∆Ct法分析mRNA含量并以各组与WYK组的比值作为相对表达量。

表2 引物序列
1.7 蛋白表达水平检测
采用Western blot法检测心肌蛋白表达量,包括CnAβ(Cn的催化亚基)、NFATc3(包括t-NFATc3和p-NFATc3)、PI3-K(p110α)(PI3-K的催化亚基)和Akt(包括t-Akt和p-Akt)(注:t-表示蛋白总量,p-表示该蛋白的磷酸化形式)。取100 mg心肌组织匀浆裂解后,4℃、13 000 rpm离心30 min,BCA法测定总蛋白浓度。取10 μg蛋白样品在垂直电泳仪上经12% SDS-PAGE分离后,转移至PVDF膜上。兔抗鼠一抗(CnAβ,1:500;t-NFATc3,1:250;p-NFATc3,1:500;PI3-K(p110α),1:500;t-Akt,1:250;p-Akt,1:250;GAPDH,1:1 000)4℃静置孵育过夜,TBST洗涤3次后加入二抗(辣根过氧化物酶标记的羊抗兔IgG,1:5 000)37℃孵育1 h,TBST充分洗涤后,使用ECL发光成像,X线胶片压片曝光,利用凝胶成像系统(ChemiDoc XRS,美国BIO-RAD公司)拍摄并扫描各条带灰度值。GAPDH为内参蛋白,以各组与WYK组的比值作为蛋白相对表达量。
1.8 统计学处理与分析
使用SPSS 20.0进行统计学处理与分析。所有数据用“均数±标准差”表示,血压的时程变化使用重复测量的方差分析,4组间比较使用单因素方差分析(one-way ANOVA),多重比较采用检验。统计学意义定为α=0.05。
2 结果
2.1 血压的时程动态变化
血压的时程动态变化见图1、图2。与训练前(第0周)比较,WYK组SBP和DBP无显著性变化(>0.05),SHR-SED组逐渐升高(<0.05),SHR-MIIT组逐渐下降(<0.05),SHR-HIIT组先下降后升高。与SHR-SED组比较,SHR-MIIT组和SHR-HIIT组在前10~11周逐渐下降(<0.05),随后SHR-MIIT组持续下降(<0.05),而SHR-HIIT组SBP在第11~15周、DBP在12~18周时无显著性差异(>0.05),SBP在第16~18周显著性升高(<0.05)。
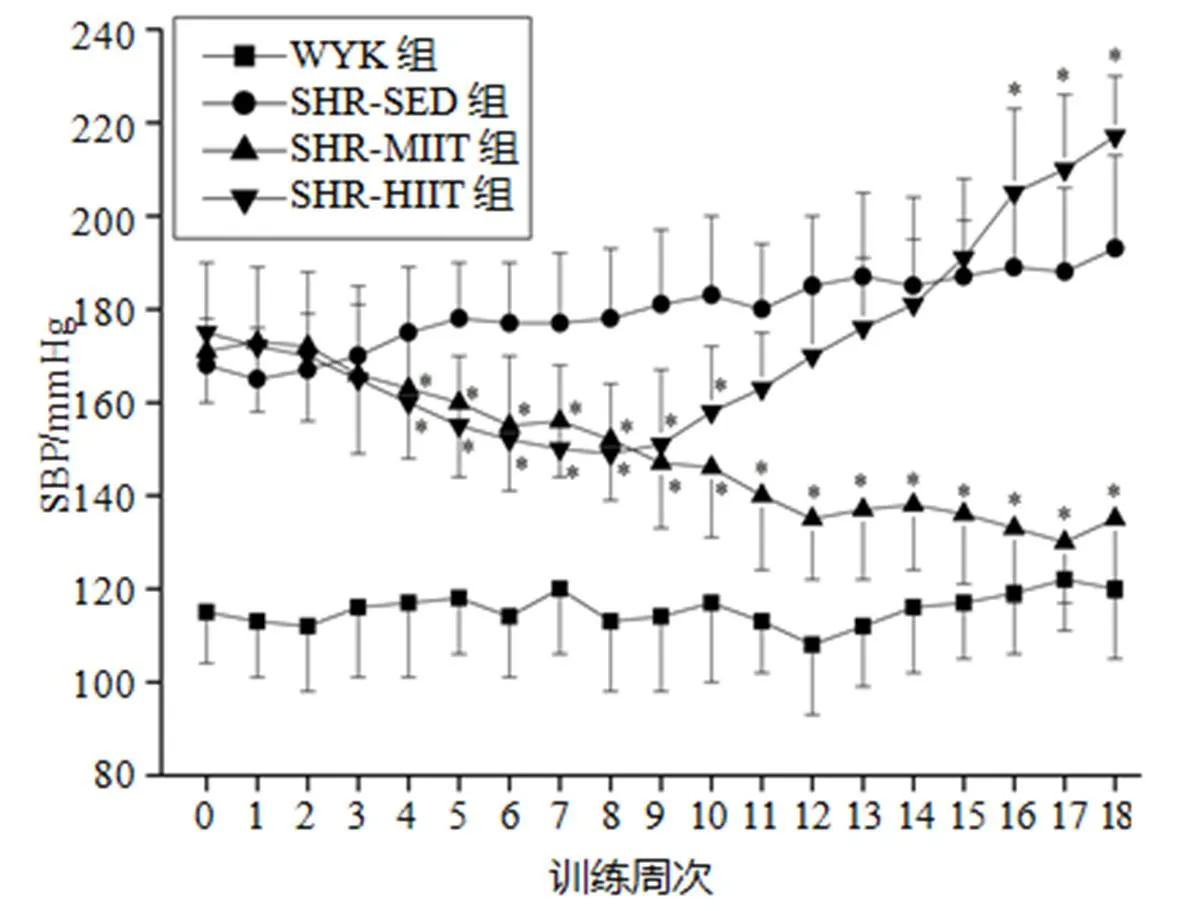
图1 训练期间SBP的时程变化
Figure 1. Time Course Variation of SBP during Training
注:*<0.05,与SHR-SED组比较,下同。
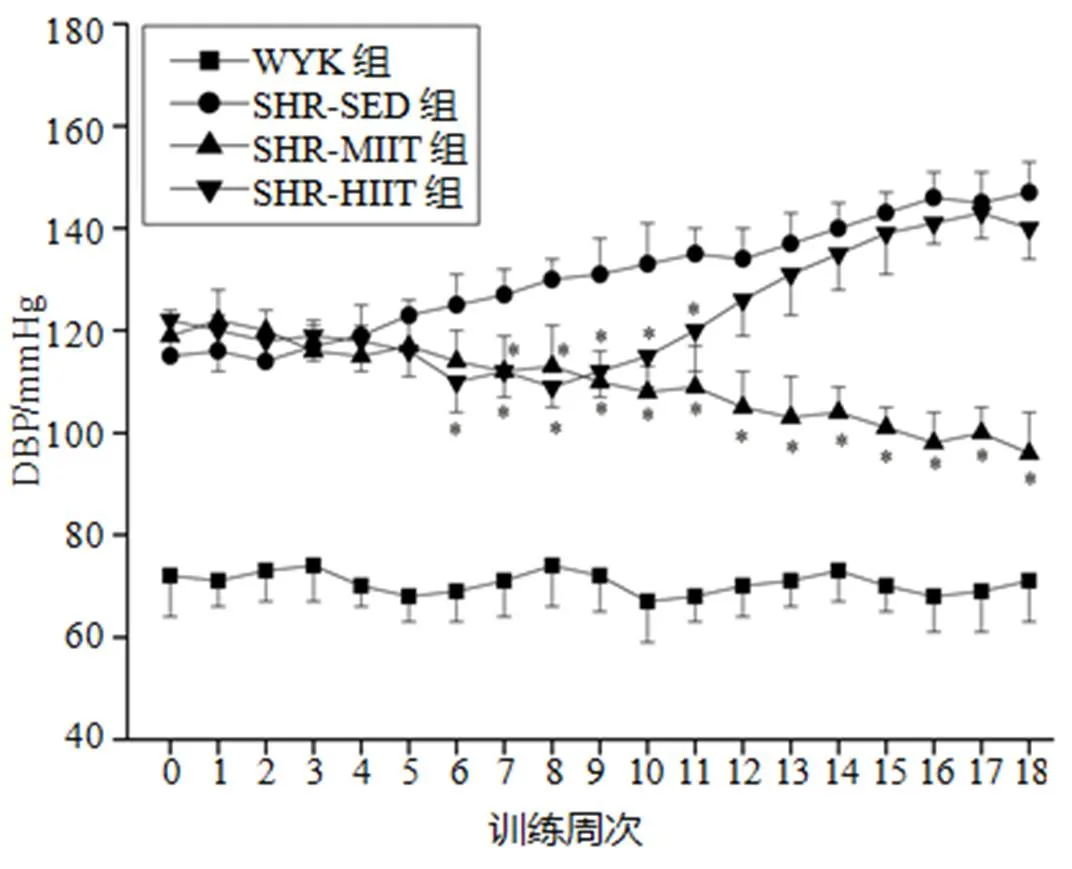
图2 训练期间DBP的时程变化
Figure 2. Time Course Variation of DBP during Training
2.2 心脏结构与功能
通过计量学与超声检测观察心脏结构与功能(表3),结果显示:与WYK组比较,SHR-SED组BM、LVEDD和LVEF下降(<0.05),HM、HMI、LVM、LVMI和LVWT升高(<0.05);与SHR-SED组比较,SHR-MIIT组HM、HMI、LVM和LVMI无显著性差异(>0.05),LVEDD、LVWT和LVEF升高(<0.05),SHR-HIIT组HM、HMI、LVM、LVMI、LVEDD和LVESD升高(<0.05),LVEF下降(<0.05);与SHR-MIIT组比较,SHR-HIIT组HM、HMI、LVM、LVMI、LVEDD和LVESD升高(<0.05),LVWT和LVEF降低(<0.05)。

表3 心脏结构与功能
注:*<0.05,与WKY组比较;#<0.05,与SHR-SED组比较;&<0.05,与SHR-MIIT组比较。
2.3 心肌H&E染色
图3显示,胞浆呈红色,胞核呈蓝色。WYK组心肌细胞形态正常,结构完整,排列规则紧凑,细胞核染色清晰、分布均匀;SHR-SED组心肌细胞肿胀肥大,排列稀疏并伴有肌纤维断裂,细胞核分布杂乱;SHR-MIIT组心肌细胞较SHR-SED组排列致密有序;SHR-HIIT组心肌细胞排列更为紊乱、疏松,肌纤维断裂程度加重或出现融合。
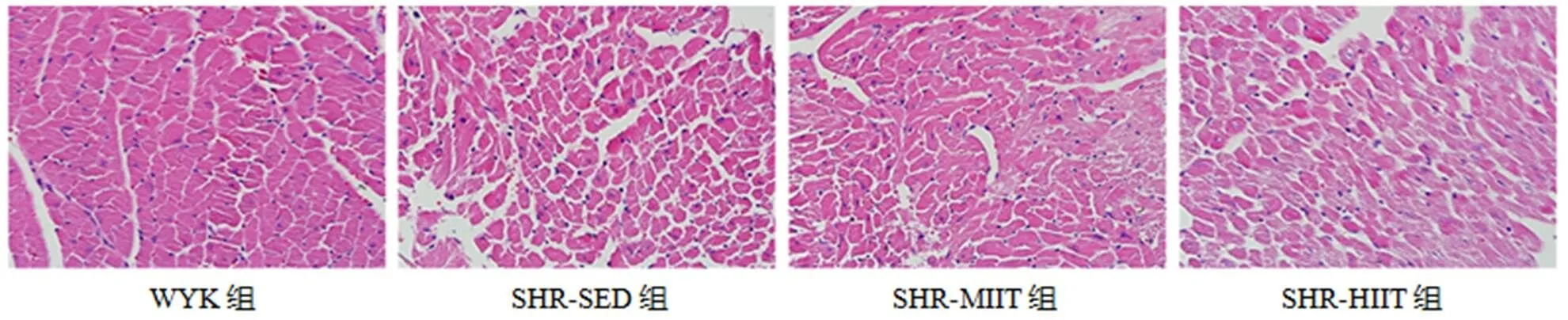
图3 心肌H&E染色
Figure 3. Myocardial H&E Staining (×400)
与WYK组比较,SHR-SED、SHR-MIIT和SHR-HIIT组均显著性升高(<0.05),后3组间比较无显著性差异(>0.05,图4)。

图4 各组心肌细胞CSA
Figure 4. The CSA of Myocardial Cell in Each Group
注:*<0.05,与WKY组比较。
2.4 心肌Masson染色
图5显示,心肌细胞呈红色,胶原纤维呈蓝色。WYK组心肌肌束间有极少量胶原纤维;SHR-SED组心肌肌束间隙不同程度增大,间质可见明显纤维化改变及胶原沉积;与SHR-SED组比较,SHR-MIIT组纤维化程度明显减轻,SHR-HIIT组则进一步加重。
与WYK组比较,SHR-SED、SHR-MIIT和SHR-HIIT组均显著性升高(<0.05);与SHR-SED组比较,SHR-MIIT组下降(<0.05),SHR-HIIT组升高(<0.05);与SHR-MIIT组比较,SHR-HIIT组升高(<0.05,图6)。
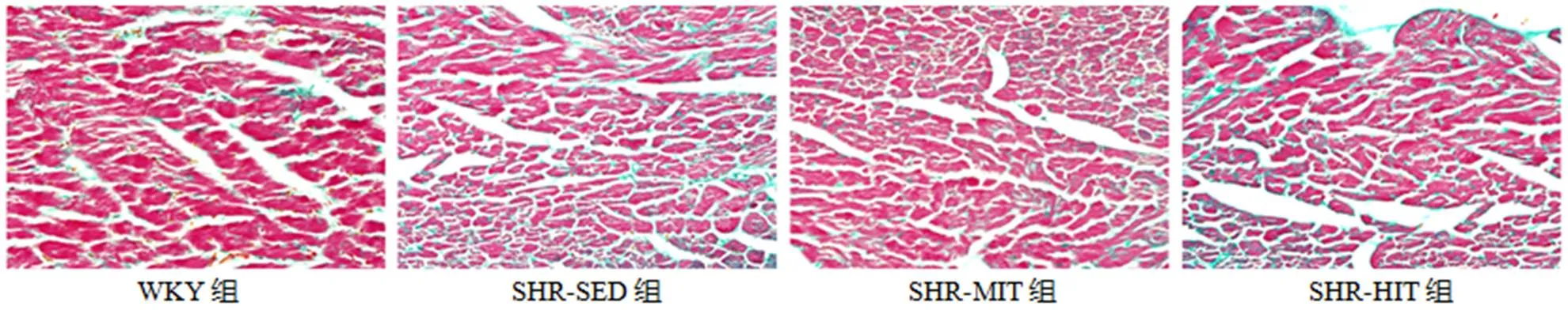
图5 心肌Masson染色
Figure 5. Myocardial Masson Staining (×400)
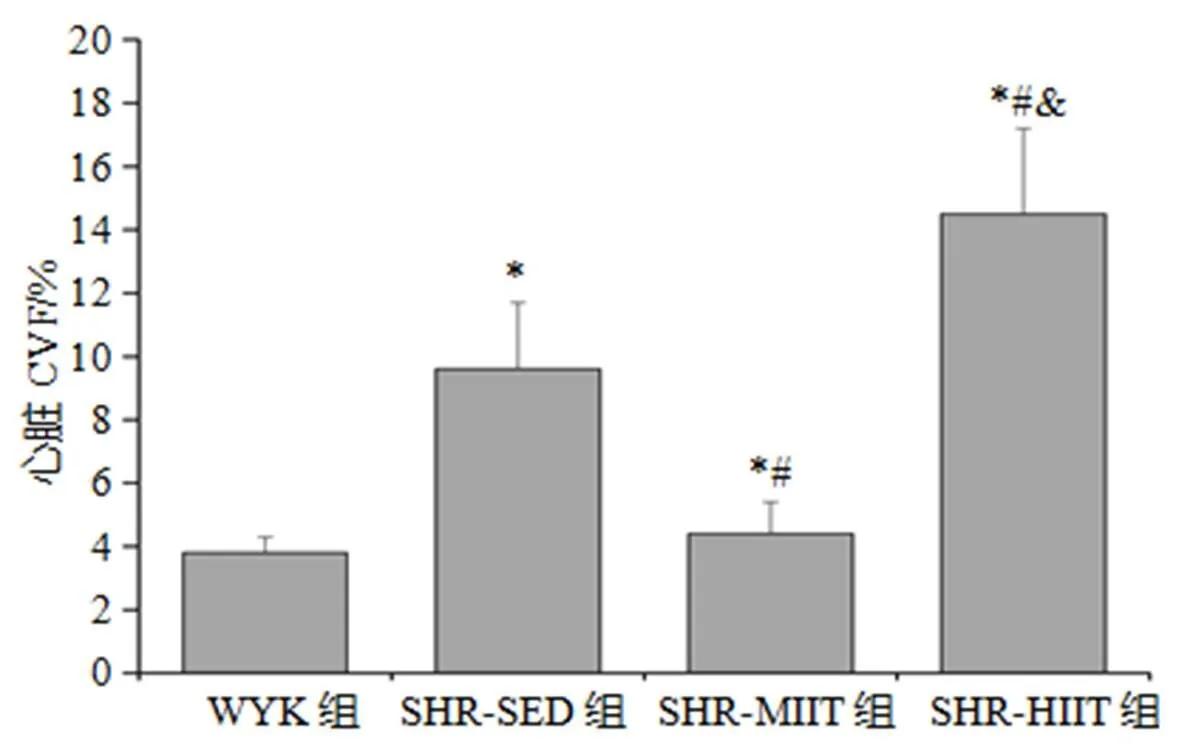
图6 各组心脏CVF
Figure 6. Cardiac CVF of Each Group
注:*<0.05,与WKY组比较;#<0.05,与SHR-SED组比较;&<0.05,与SHR-MIIT组比较,下同。
2.5 胚胎基因表达
通过RT-PCR检测胚胎基因mRNA表达量发现(图7):与WYK组比较,SHR-SED和SHR-HIIT组ANP、BNP和β-MHC mRNA表达量均显著性升高(<0.05);与SHR-SED组比较,SHR-MIIT组各胚胎基因表达量均下降(<0.05),SHR-HIIT组BNP和β-MHC升高(<0.05);与SHR-MIIT组比较,SHR-HIIT组各胚胎基因均升高(<0.05)。
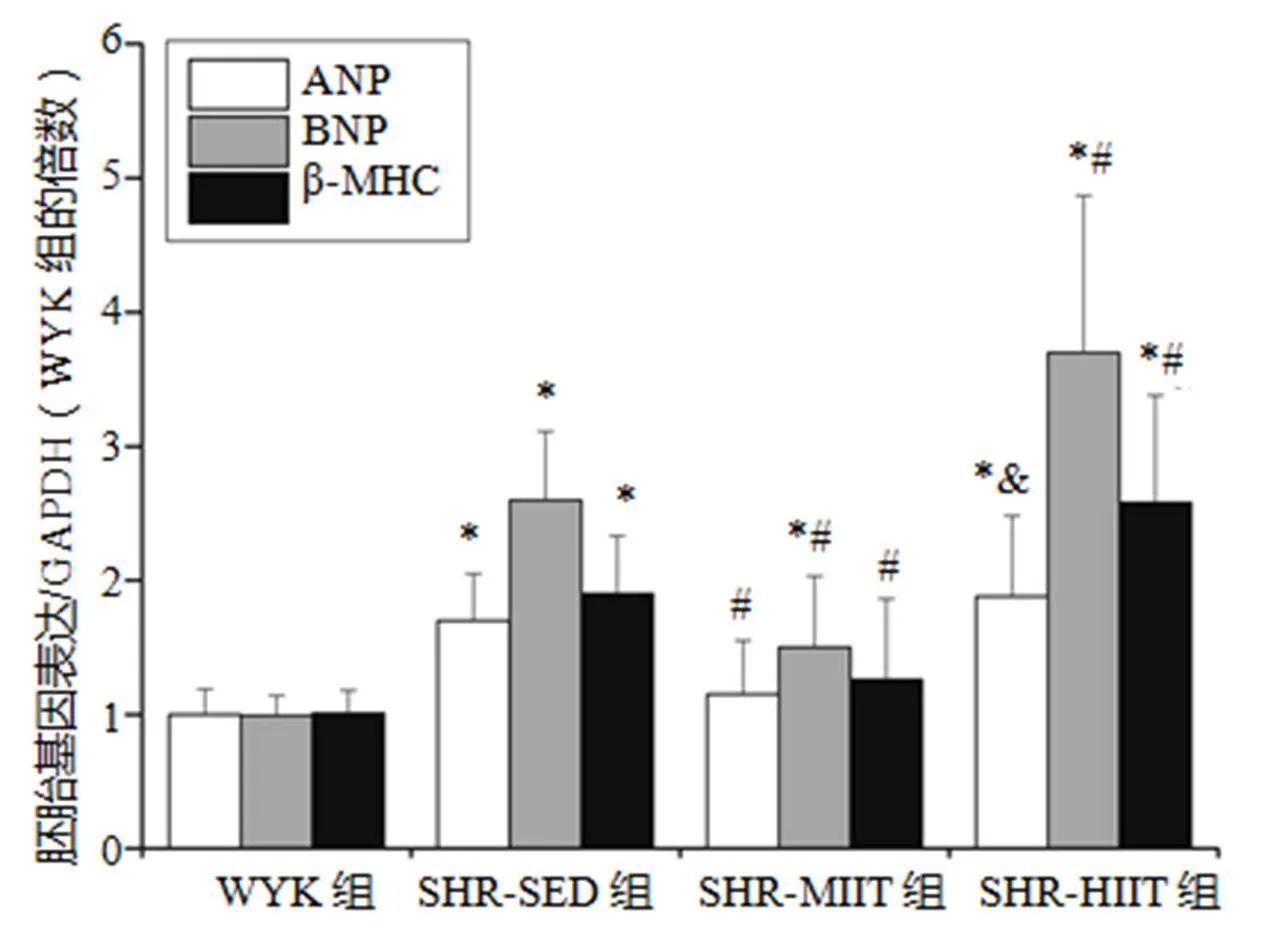
图7 各组胚胎基因表达
Figure 7. Fetal Genes Expression of Each Group
2.6 心脏肥大信号通路蛋白表达
利用Western blot检测心脏肥大信号通路中各蛋白表达量,结果发现:
CnAβ:与WYK组比较,SHR-SED和SHR-HIIT组升高(<0.05);与SHR-SED组比较,SHR-MIIT组下降(<0.05),SHR-HIIT组升高(<0.05);与SHR-MIIT组比较,SHR-HIIT组升高(<0.05,图8)。
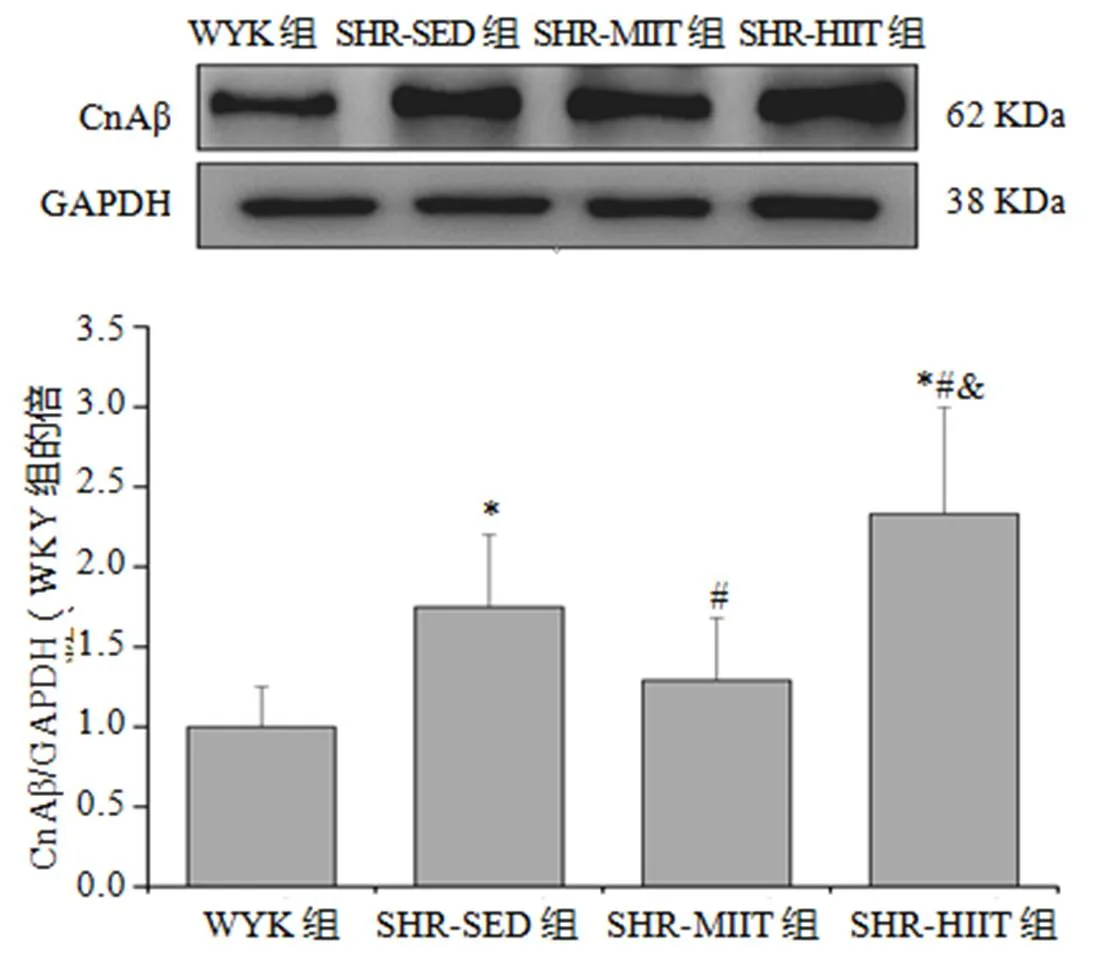
图8 各组CnAβ蛋白表达量
Figure 8. CnAβ Protein Expression of Each Group
t-NFATc3:t-NFATc3在各组间均无显著性差异(>0.05)。t-NFATc3和p-NFATc3/t-NFATc3比值:与WYK组比较,SHR-SED和SHR-HIIT组降低(<0.05);与SHR-SED组比较,SHR-MIIT组升高(<0.05),SHR-HIIT组降低(<0.05);与SHR-MIIT组比较,SHR-HIIT组降低(<0.05,图9a、图9b)。

Figure 9. NFATc3 Protein Expression of Each Group
PI3-K(p110α):与WYK组比较,SHR-SED组无显著性差异(>0.05),SHR-MIIT和SHR-HIIT组升高(<0.05);与SHR-SED组比较,SHR-MIIT和SHR-HIIT组升高(<0.05);与SHR-MIIT组比较,SHR-HIIT组无显著性差异(>0.05,图10)。

图10 各组PI3-K(p110α)蛋白表达量
Figure 10. PI3-K(p110α) Protein Expression of Each Group
t-Akt:t-Akt在各组间均无显著性差异(>0.05)。t-Akt和p-Akt/t-Akt比值:与WYK组比较,SHR-SED组无显著性差异(>0.05),SHR-MIIT和SHR-HIIT组升高(<0.05);与SHR-SED组比较,SHR-MIIT组和SHR-HIIT组升高(<0.05);与SHR-MIIT组比较,SHR-HIIT组升高(<0.05,图11a、图11b)。
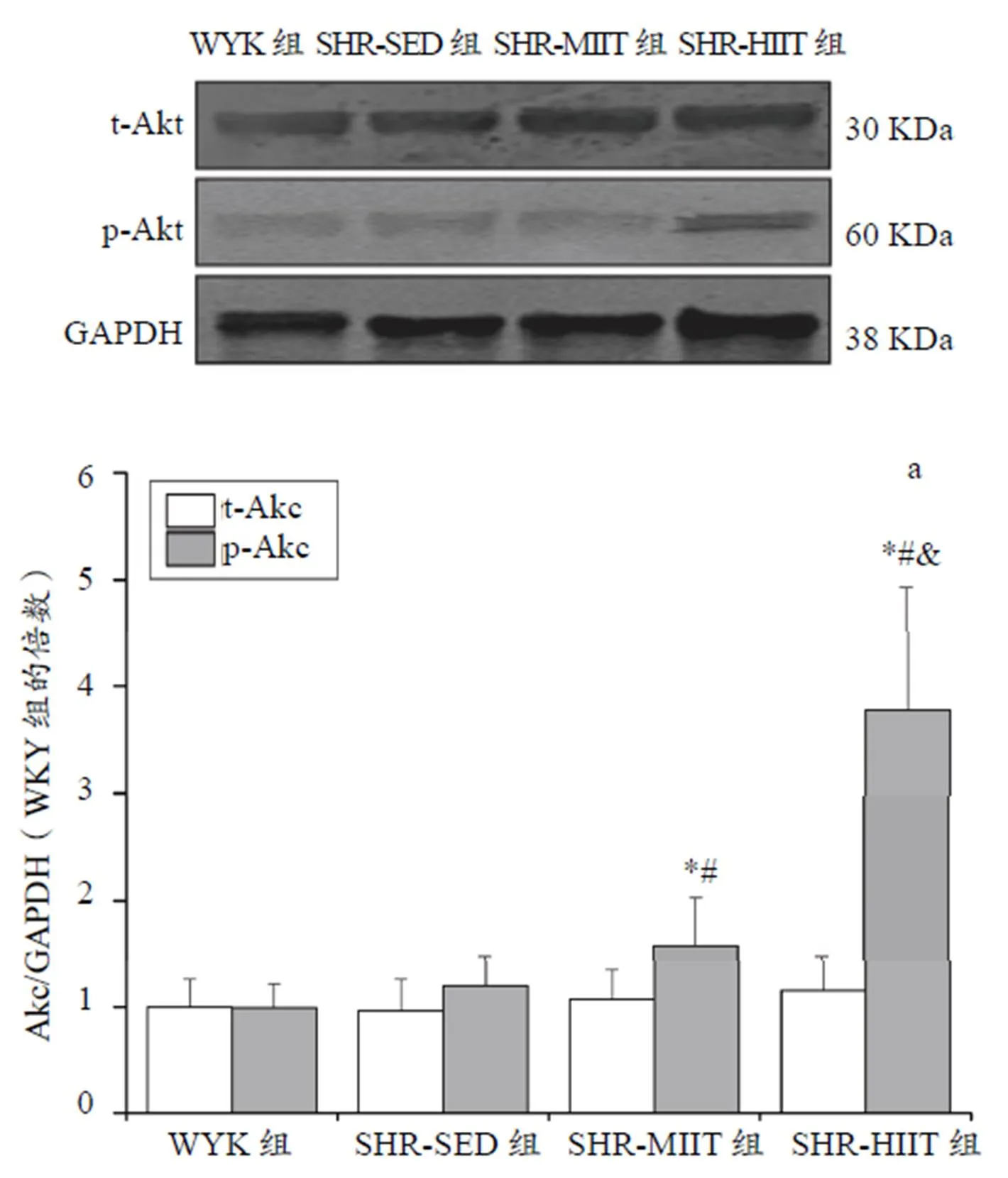
Figure 11. Akt Protein Expression of Each Group
2.7 肾上腺和胸腺质量指数
与WYK组比较,SHR-SED和SHR-HIIT组肾上腺质量指数增加(<0.05)、胸腺质量指数降低(<0.05);与SHR-SED组比较,SHR-MIIT组肾上腺质量指数下降(<0.05)、胸腺质量指数升高(<0.05),SHR-HIIT组肾上腺质量指数增加(<0.05)、胸腺质量指数降低(<0.05);与SHR-MIIT组比较,SHR-HIIT组肾上腺质量指数增加(<0.05)、胸腺质量指数降低(<0.05,图12、图13)。

图12 各组肾上腺质量指数
Figure 12. Adrenal Mass Index of Each Group
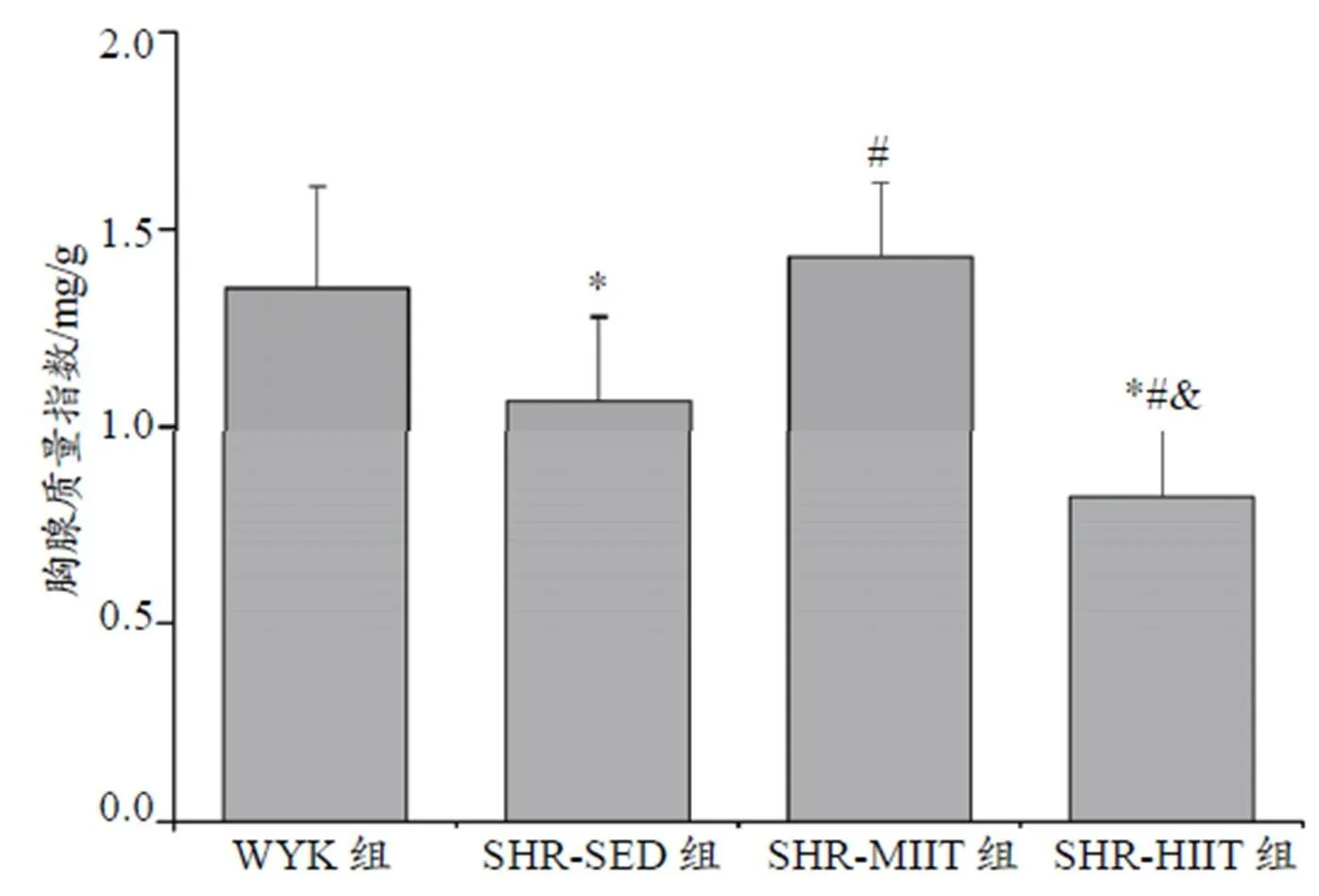
图13 各组胸腺的质量指数
Figure 13. Thymic Mass Index of Each Group
3 讨论
3.1 不同强度间歇运动对SHR心脏形态、结构和功能的影响
病理性心脏肥大是高血压患者最常见的并发症和最重要的心血管危险因素,其严重程度与心血管不良事件(心肌梗塞、心律失常、心力衰竭等)发生率增加以及预后不良密切相关(Shenasa et al.,2017)。在本研究中,SHR-SED组心脏质量和心肌细胞CSA增加、心室壁增厚、心腔容积缩窄,即心脏形态与结构上发生向心性肥大。心脏肥大最初对于过高的室壁应力具有代偿作用,有利于增加心肌收缩力以维持心功能,但伴随高血压进程,肥大的心肌需氧量增加造成心肌缺血,细胞表型发生改变,即胚胎基因(ANP、BNP和β-MHC)激活以及心肌纤维化(CVF增加),最终导致心功能下降以及心力衰竭。由于胚胎基因编码的胎儿型蛋白质功能低下,因而造成心脏表型由成熟的“收缩状态”向“胚胎型合成状态”转变,加之细胞凋亡使得参与肌肉收缩的心肌细胞数量减少,因此心肌收缩力下降(Dzudie et al.,2017)。心肌发生纤维化则导致心脏硬度增加以及心室壁顺应性下降(Li et al.,2017),进而影响心脏舒缩功能;此外心肌纤维化还可增加心肌电不均一性,易引发室性心律失常,是心血管疾病患者心源性猝死的重要原因(Nadruz et al.,2015)。
经过18周运动后,MIIT并未对心脏质量(HM、HMI、LVM和LVMI)和细胞体积(CSA)产生影响,但心腔容积和室壁厚度成比例增加(LVEDD和LVWT均升高),提示心脏由“向心性肥大”转变为“离心性肥大”,与施曼莉等(施曼莉 等,2015)采用有氧运动方式干预心肌梗塞后心力衰竭大鼠的研究结果类似。由于SHR-MIIT组胚胎基因过表达得到抑制(ANP、BMP和β-MHC mRNA下调)、心肌纤维化减轻(CVF下降),同时血液动力学(血压下降)和心功能改善(LVEF升高),因此MIIT诱导的心脏“离心性肥大”属“生理性肥大”。有关长跑、游泳等耐力项目运动员的研究发现(Lovic et al.,2017),长期有氧运动可引起心腔扩张、心壁增厚、心脏体积增加,心脏舒缩功能提高,与本研究针对SHR的结果基本一致,其机制与运动时容量负荷(心脏前负荷)增加造成肌节串联性增生有关(Bessem et al.,2018)。Xu等(2015)的研究同样证实,运动预适应形成的生理性心脏肥大可减轻随后压力过负荷诱导的病理性心脏肥大以及心力衰竭程度。因此推测,运动诱导的生理性心脏肥大与高血压引起的病理性肥大在大鼠MIIT过程中同时存在并相互作用,最终前者的有益效应抵消了后者的不良影响,心脏由病理性肥大向生理性肥大转变,同时心功能增强、心力衰竭进程得到延缓。
HIIT是一种更具效率的训练模式,据报道,3次/周,共2周的HIIT即可改善健康无训练经历者(Jacobs et al., 2013)、2型糖尿病患者(Little et al.,2014)甚至竞技运动员(Christensen et al.,2011)的运动能力,与有氧运动产生类似的骨骼肌适应,然而其对心脏(尤其是病理状态下)的作用尚存在争议。研究证实,HIIT能够减轻糖尿病心肌病(Novoa et al.,2017)、肥胖(Hafstad et al.,2013)以及心肌梗塞后心力衰竭大鼠(Lu et al.,2015)病理性心脏肥大并抑制心脏重塑。然而王增喜等(2018)最近的一项研究显示,健康大鼠HIIT至第6周出现暂时性病理性心脏肥大及心功能下降,第10周时恢复;Holloway等(2015)发现,4周HIIT加重高盐饮食诱导的高血压大鼠心脏重塑。基于王增喜等(2018)的结果,我们提出以下质疑:在Holloway等(2015)的研究中,4周HIIT后心脏重塑加重是一过性变化还是永久性损害?若属于一过性,则延长干预时间心脏适应不良可得到逆转,若属不可逆,延长训练周期将进一步造成心功能恶化。课题组前期研究发现(范朋琦 等,2018),8周HIIT能够抑制SHR病理性心脏肥大并提高心功能,初步支持“一过性”观点。然而该研究(范朋琦 等,2018)与Holloway等(2015)在高血压造模以及HIIT方案等方面存在显著差异,因此长期HIIT的效果尚不确定。本研究将运动时间延长至18周(相当于人类运动10年),结果发现,SHR-HIIT组心脏质量增加,形态学上虽然同样发生离心性肥大,但心腔扩张同时室壁变薄、心肌纤维化加剧,此改变可导致室壁应力大幅增加;此外胚胎基因表达上调是病理性心脏肥大发生的重要机制,同时也是心力衰竭进展与预后的重要标志物(Dirkx et al., 2013)。上述结果提示,长期HIIT诱导病理性心脏肥大进一步加重并促进心力衰竭进展,与Holloway等(2015)利用4周HIIT、Schultz等(2007)和黄凯(2015)等采用长期自主跑轮运动以及Benito等(2011)让大鼠进行长期高强度跑台运动的研究结果一致。结合课题组前期的研究[即8周HIIT改善SHR心脏重塑(范朋琦 等,2018)]推测,HIIT对SHR的心脏效应存在“一过性”特点。这一现象可用心脏的代偿能力与运动负荷的交互作用来解释。本研究采用运动负荷逐级递增的方式制定HIIT方案,前8周负荷较低、SHR心脏代偿能力较强,运动诱导的炎症反应、氧化应激、低氧等信号途径轻度激活并介导心脏生理性适应(Boutcher et al.,2017)。然而运动仅能延缓而非逆转高血压心力衰竭进程,心脏重塑依然在隐匿中进行,心功能较健康大鼠缓慢降低,加之后10周运动负荷较大超过了心脏代偿能力,上述信号途径持续激活并产生大量有害物质(炎症因子、自由基等),进而发生适应不良(Pingitore et al., 2015)。18周HIIT期间血压的时程动态变化表现出的“双相反应”特征(SBP和DBP均先下降后升高)也间接证实了上述推断。此外,运动负荷过重可造成动物心理应激以及肠道菌群失衡(Yuan et al.,2018),后者则是高血压进展的重要原因(Barna et al.,2018)。由此推测,反复高强度运动作为慢性应激源致使大鼠长期处于身体和心理的双重应激状态中,通过诱导肠道菌群失衡加重SHR心脏重塑,本研究中SHR-HIIT组出现肾上腺肥大和胸腺萎缩也说明了这一点。总之,长期HIIT促进SHR心脏重塑并加速心力衰竭进程,同时心血管不良事件以及并发症的发生率将显著增加。
3.2 不同强度间歇运动对心脏肥大信号途径的影响
病理性和生理性心脏肥大在形态、结构、功能以及细胞表型存在显著差异,其根源是不同性质刺激源激活细胞内不同信号转导通路、进而诱导不同基因表达造成的。在本研究中,SHR-SED组CnAβ表达上调,p-NFATc3/ NFATc3比值下降(表示NFATc3去磷酸化增加),但PI3-K(p110α)和p-Akt/t-Akt比值无显著性变化,提示高血压诱导病理性心脏肥大信号途径激活,而生理性途径并未受影响,与Wilkins等(2004)的结果一致。
18周运动后,与SHR-SED组比较,SHR-MIIT组CnAβ蛋白表达量下调,而p-NFATc3/NFATc3比值增加,说明长期MIIT能够抑制Cn/NFAT信号通路,这与Garciarena等(2009)持续游泳耐力训练(90 min/天,5天/周,共60天)以及贾祁等(2018)中等强度持续跑台运动(20 m/min,60 min/天,5天/周,共60天)的研究结果一致。Konhilas等(2006)以肥厚性疾病、Oliveira等(2009)以心力衰竭以及Nicholson等(2013)以缺血-再灌注损伤为模型同样发现,有氧运动能够抑制心肌细胞内NFATc3核移位并降低促肥大基因的表达量。此外,我们还发现,SHR-MIIT组PI3-K(p110α)和p-Akt/t-Akt比值增加,提示生理性心脏肥大信号途径激活,与Miyachi等(2009)、Sagara等(2012)和McMullen等(2007)以游泳运动方式的研究结果类似。然而Garciarena等(2009)却发现,60天游泳运动对PI3-K/Akt信号通路无明显影响,可能与干预时间较短有关。动物实验表明(McMullen et al.,2007; Yeves et al., 2018),PI3-K/Akt信号通路激活对病理状态下的心肌细胞起保护作用,激活PI3-K/Akt可通过阻断G蛋白偶联受体途径而抑制Cn/NFAT活性,故推测SHR-MIIT组Cn/NFAT途径受抑可能是运动激活PI3-K/Akt引起的间接效应。因此,MIIT通过激活生理性并抑制病理性心脏肥大信号途径促使SHR心脏由病理性肥大向生理性肥大转变。
廖兴林等(2009)的研究显示,大鼠反复力竭运动后心肌中Cn表达上调,而Yeves等(2014)则证实中等强度游泳运动则对Cn无明显影响,提示Cn对运动的应答存在强度依赖性。由于HIIT强度明显高于MIIT,因此诱导Cn/NFAT途径激活。有趣的是,HIIT同时又上调PI3-K/Akt活性,说明病理性和生理性信号途径同时被活化,但由于后者的作用无法代偿前者的不良影响,因此最终走向心力衰竭。值得注意的是,SHR-HIIT组PI3-K(p110α)表达量较SHR-MIIT组无显著性差异,但p-Akt/t-Akt却显著升高(约3倍),提示尚存在其他上调Akt的途径。研究显示,激活PI3-K/Akt信号途径既可诱导生理性(Matsui et al.,2002; Shiojima et al.,2002)又能导致病理性(Condorelli et al.,2002)心脏肥大,其效应主要取决于Akt上调的幅度(O'Neill et al.,2005)。因此推测,Akt过度激活在HIIT过程中可能扮演了病理性刺激的角色,与Cn/NFAT途径协同作用促进病理性心脏重塑进一步加剧。
4 结论与临床意义
长期MIIT诱导SHR心脏由病理性肥大向生理性肥大转变并改善心功能,而HIIT则加重心脏重塑并加速心力衰竭进程,其机制与不同强度间歇运动对心肌胶原代谢、胚胎基因以及Cn/NFAT和PI3-K/Akt信号通路的调控存在差异有关。
本研究结果对于指导高血压患者运动康复具有一定临床意义。本研究发现,间歇运动对高血压的健康效应存在运动强度依赖性,大强度运动可能存在一个安全上限(即“强度阈值”),心血管疾病患者尤其是体适能水平较低者使用HIIT方案应持谨慎态度。由于体适能水平与运动中心血管不良事件发生率呈反比(Thompson et al.,2007),故开始HIIT前需要进行一段时间有氧运动或MIIT作为预适应(Gillen et al., 2014)并加强运动中的医务监督。因此,中等强度运动(无论是持续运动还是间歇运动)仍然是高血压患者运动康复的最佳方式,HIIT的安全性和有效性则需要更多证据支持。
范朋琦,秦永生,彭朋,2018.不同运动方式对自发性高血压大鼠心脏重塑和运动能力的影响[J].现代预防医学,45(23):4341-4345.
黄凯,彭朋,李晓霞,2015.长期自主跑轮运动对心肌梗死大鼠心肌重塑的影响[J].武警后勤学院学报(医学版),24(5):337-341.
贾祁,李丼,石丼君,等,2018. CaN/NFAT信号通路在有氧运动改善高血压心肌肥大中的作用[J].体育科学,38(12):45-52.
廖兴林,常芸,高晓嶙,等,2009.力竭运动后不同时相大鼠心肌CnAβ的变化[J].中国运动医学杂志,28(4):388-390.
施曼莉,李晓霞,2015.有氧运动对慢性心力衰竭大鼠病理性心脏肥大的影响[J].体育学刊,22(3):127-134.
王增喜,李洁,王悦,2018.高强度间歇训练对大鼠心肌线粒体呼吸链复合体活性的影响[J].中国运动医学杂志,37(4):315-322.
BARNA I, NYÚL D, SZENTES T, et al., 2018. Review of the relation between gut microbiome, metabolic disease and hypertension[J]. Orv Hetil, 159(9): 346-351.
BATACAN R B, DUNCAN M J, DALBO V J, et al., 2016. Light-intensity and high-intensity interval training improve cardiometabolic health in rats[J]. Appl Physiol Nutr Metab, 41(9): 945-952.
BENITO B, GAY-JORDI G, SERRANO-MOLLAR A, et al., 2011. Cardiac arrhythmogenic remodeling in a rat model of long-term intensive exercise training[J]. Circulat, 123(1): 13-22.
BESSEM B, DE BRUIJN M C, NIEUWLAND W, et al., 2018. The electrocardiographic manifestations of athlete's heart and their association with exercise exposure[J]. Eur J Sport Sci, 18(4): 587-593.
BORGES J P, MASSON G S, TIBIRICA E, et al., 2014. Aerobic interval exercise training induces greater reduction in cardiac workload in the recovery period in rats[J]. Arq Bras Cardiol, 102(1): 47-53.
BOUTCHER Y N, BOUTCHER S H, 2017. Exercise intensity and hypertension: what's new?[J]. J Hum Hypertens, 31(3): 157-164.
CHRISTENSEN P M, KRUSTRUP P, GUNNARSSON T P, et al., 2011. VO2 kinetics and performance in soccer players after intense training and inactivity[J]. Med Sci Sports Exerc, 43(9): 1716-1724.
CONDORELLI G, DRUSCO A, STASSI G, et al., 2002. Akt induces enhanced myocardial contractility and cell size in vivo in transgenic mice[J]. Proc Natl Acad Sci, 99(19): 12333-12338.
DIRKX E, DA C M P A, DE WINDT L J, 2013. Regulation of fetal gene expression in heart failure[J]. Biochim Biophys Acta, 1832(12): 2414-2424.
DZUDIE A, DZEKEM B S, KENGNE A P, 2017. NT-pro BNP and plasma-soluble ST2 as promising biomarkers for hypertension, hypertensive heart disease and heart failure in sub-Saharan Africa[J]. Cardiovasc J Afr, 28(6): 406-407.
GARCIARENA C D, PINILLA O A, NOLLY M B, et al., 2009. Endurance training in the spontaneously hypertensive rat: Conversion of pathological into physiological cardiac hypertrophy[J]. Hypertension, 53(4): 708-714.
GILLEN J B, GIBALA M J, 2014. Is high-intensity interval training a time-efficient exercise strategy to improve health and fitness?[J]. Appl Physiol Nutr Metab, 39(3): 409-412.
HAFSTAD A D, LUND J, HADLER-OLSEN E, et al., 2013. High- and moderate-intensity training normalizes ventricular function and mechanoenergetics in mice with diet-induced obesity[J]. Diabetes, 62(7): 2287-2294.
HOLLOWAY T M, BLOEMBERG D, SILVA M L D, et al., 2015. High intensity interval and endurance training have opposing effects on markers of heart failure and cardiac remodeling in hypertensive rats[J]. PLoS One, 10(3): e0121138.
HOYDAL M A, WISLOFF U, KEMI O J, et al., 2007 Running speed and maximal oxygen uptake in rats and mice: Practical implications for exercise training[J]. Eur J Cardiovasc Prev Rehabil, 14(6): 753-760.
HUSSAIN S R, MACALUSO A, PEARSON S J, 2016. High-intensity interval training versus moderate-intensity continuous training in the prevention/management of cardiovascular disease[J]. Cardiol Rev, 24(6): 273-281.
JACOBS R A, FLÜCK D, BONNE T C, et al., 2013. Improvements in exercise performance with high-intensity interval training coincide with an increase in skeletal muscle mitochondrial content and function[J]. J Appl Physiol (1985), 115(6): 785-793.
KALETA A M, LEWICKA E, DABROWSKA-KUGACKA A, et al., 2017. Intensive exercise and its effect on the heart: Is more always better?[J]. Cardiol J, 24(2): 111-116.
KONHILAS J P, WATSON P A, MAASS A, et al., 2006. Exercise can prevent and reverse the severity of hypertrophic cardiomyopathy[J]. Circ Res, 98(4): 540-548.
LI S, GUPTE A A, 2017. The role of estrogen in cardiac metabolism and diastolic function[J]. Methodist Debakey Cardiovasc J, 13(1): 4-8.
LITTLE J P, GILLEN J B, PERCIVAL M E, et al., 2011. Low-volume high-intensity interval training reduces hyperglycemia and increases muscle mitochondrial capacity in patients with type 2 diabetes[J]. J Appl Physiol (1985), 111(6): 1554-1560.
LOVIC D, NARAYAN P, PITTARAS A, et al., 2017. Left ventricular hypertrophy in athletes and hypertensive patients[J]. J Clin Hypertens (Greenwich), 19(4): 413-417.
LU K, WANG L, WANG C, et al., 2015. Effects of high-intensity interval versus continuous moderate-intensity aerobic exercise on apoptosis, oxidative stress and metabolism of the infarcted myocardium in a rat model[J]. Mol Med Rep, 12(2): 2374-2382.
MATSUI T, LI L, WU J C, et al., 2002. Phenotypic spectrum caused by transgenic overexpression of activated Akt in the heart[J]. J Biol Chem, 277(25): 22896-22901.
MCMULLEN J R, AMIRAHMADI F, WOODCOCK E A, et al., 2007. Protective effects of exercise and phosphoinositide 3-kinase (p110alpha) signaling in dilated and hypertrophic cardiomyopathy[J]. Proc Natl Acad Sci U S A, 104(2): 612-617.
MIYACHI M, YAZAWA H, FURUKAWA M, et al., 2009. Exercise training alters left ventricular geometry and attenuates heart failure in dahl salt-sensitive hypertensive rats[J]. Hypertension, 53(4): 701-707.
MOUSAVI N, CZARNECKI A, KUMAR K, et al., 2009. Relation of biomarkers and cardiac magnetic resonance imaging after marathon running[J]. Am J Cardiol, 103(10): 1467-1472.
NADRUZ W, 2015. Myocardial remodeling in hypertension[J]. J Hum Hypertens, 29(1): 1-6.
NAKAMURA M, SADOSHIMA J, 2018. Mechanisms of physiological and pathological cardiac hypertrophy[J]. Nat Rev Cardiol, 15(7): 387-407.
NICHOLSON C K, LAMBERT J P, CHOW C W, et al., 2013. Chronic exercise downregulates myocardial myoglobin and attenuates nitrite reductase capacity during ischemia-reperfusion[J]. J Mol Cell Cardiol, 64: 1-10.
NOVOA U, ARAUNA D, MORAN M, et al., 2017. High-intensity exercise reduces cardiac fibrosis and hypertrophy but does not restore the nitroso-redox imbalance in diabetic cardiomyopathy [J/OL]. Oxid Med Cell Longev, https://doi.org/10.1155/2017/ 7921363.
OLIVEIRA R S, FERREIRA J C, GOMES E R, et al., 2009. Cardiac anti-remodelling effect of aerobic training is associated with a reduction in the calcineurin/NFAT signalling pathway in heart failure mice[J]. J Physiol, 587(Pt 15): 3899-3910.
O'NEILL B T, ABEL E D, 2005. Akt1 in the cardiovascular system: friend or foe?[J]. J Clin Invest, 115(8): 2059-2064.
PINGITORE A, LIMA GP, MASTORCI F, et al., 2015. Exercise and oxidative stress: potential effects of antioxidant dietary strategies in sports[J]. Nutrition, 31(7-8): 916-922.
SAGARA S, OSANAI T, ITOH T, et al., 2012. Overexpression of coupling factor 6 attenuates exercise-induced physiological cardiac hypertrophy by inhibiting PI3K/Akt signaling in mice[J]. J Hypertens, 30(4): 778-786.
SCHULTZ R L, SWALLOW J G, WATERS R P, et al., 2007. Effects of excessive long-term exercise on cardiac function and myocyte remodeling in hypertensive heart failure rats[J]. Hypertension, 50(2): 410-416.
SHENASA M, SHENASA H, 2017. Hypertension, left ventricular hypertrophy, and sudden cardiac death[J]. Int J Cardiol, 237: 60-63.
SHIOJIMA I, YEFREMASHVILI M, LUO Z, et al., 2002. Akt signaling mediates postnatal heart growth in response to insulin and nutritional status[J]. J Biol Chem, 277(40): 37670-37677.
SWIFT D L, LAVIE C J, JOHANNSEN N M, et al., 2013. Physical activity, cardiorespiratory fitness, and exercise training in primary and secondary coronary prevention[J]. Circ J, 77(2): 281-292.
THOMPSON P D, FRANKLIN B A, BALADY G J, et al., 2007. Exercise and acute cardiovascular events placing the risks into perspective: A scientific statement from the American Heart Association Council on Nutrition, Physical Activity, and Metabolism and the Council on Clinical Cardiology[J]. Circulation, 115(17): 2358-2368.
WILKINS B J, DAI Y S, BUENO O F, et al., 2004. Calcineurin/NFAT coupling participates in pathological, but not physiological, cardiac hypertrophy[J]. Circ Res, 94(1): 110-118.
XU T, TANG H, ZHANG B, et al., 2015. Exercise preconditioning attenuates pressure overload-induced pathological cardiac hypertrophy[J]. Int J Clin Exp Pathol, 8(1): 530-540.
YEVES A M, BURGOS J I, MEDINA A J, et al., 2018. Cardioprotective role of IGF-1 in the hypertrophied myocardium of the spontaneously hypertensive rats: A key effect on NHE-1 activity[J]. Acta Physiol (Oxf), 224(2): e13092.
YEVES A M, VILLA-ABRILLE M C, PÉREZ NG, et al., 2014. Physiological cardiac hypertrophy: Critical role of AKT in the prevention of NHE-1 hyperactivity[J]. J Mol Cell Cardiol, 76: 186-195.
YUAN X, XU S, HUANG H, et al., 2018. Influence of excessive exercise on immunity, metabolism, and gut microbial diversity in an overtraining mice model[J]. Scand J Med Sci Sports, 28(5): 1541-1551.
Interval Training Modulates Pathological Cardiac Hypertrophy in Spontaneously Hypertensive Rats: Relationship between Exercise Intensity and Health Effect
MENG Xianxin1, GUAN Zeyi1, GE Jisheng1, WANG Xiliu1, QIN Yongsheng2, WANG Daning2, PENG Peng2*
: To compare the effects of long-term interval training with different intensities on pathological cardiac hypertrophy in spontaneously hypertensive rats (SHR), and explore the relationship between exercise intensity and health effect.: Forty-five male SHR were randomly divided into a sedentary group (SHR-SED), a moderate-intensity interval training group (SHR-MIIT), or a HIIT group (SHR-HIIT); another fifteen age- and sex- matched Wistar-Kyoto (WYK) rats were set as a normotensive group. Rats in SHR-MIIT and SHR-HIIT groups were performed 18 weeks of MIIT or HIIT training, respectively, and WYK and SHR-SED groups were keep sedentary during experiment. 48 hours after the last training, the caudal artery pressure was measured by using non-invasive blood pressure tester; the cardiac structure and function were detected by using echocardiogram; the myocardial cross sectional area (CSA) and interstitial collagen volumetric fraction (CVF) were obtained by H&E and Masson staining; RT-PCR was used to measure the mRNA levels of atrial natriuretic peptide (ANP), brain natriuretic peptide (BNP) and β-myosin heavy chain (β-MHC); Western blotting was used to measure the protein levels of calcineurin/nuclear factor of activation T cell (Cn/NFAT) and phosphoinositide 3-kinase/Akt (PI3-K/Akt).: (1) cardiac morphology and structure: the left ventricle was concentric hypertrophy (i.e., cardiac chamber was constricted, ventricular wall was thickened, CSA was increased) and the CVF was increased (<0.05) in SHR-SED group; the left ventricle was eccentric hypertrophy (i.e., cardiac chamber was dilatated, ventricular wall was thickened) and the CVF was reduced (<0.05) in SHR-MIIT group; the SHR-HIIT group was eccentric hypertrophy as well, but the cardiac chamber was dilated and ventricular wall was thinner, the CVF was further increased (<0.05). (2) cardiac function: the left ventricular ejection fraction (LVEF) was decreased (<0.05) in SHR-SED group; the LVEF was raised (<0.05) in SHR-MIIT group but decreased (<0.05) in SHR-HIIT group compared with SHR-SED group. (3) fetal genes expression: the mRNA levels of ANP, BNP and β-MHC was up-regulated (<0.05) in SHR-SED group; compared with SHR-SED group, all genes were down-regulated (<0.05) in SHR-MIIT group while BNP and β-MHC was up-regulated (<0.05) in SHR-HIIT group. (4) protein expression of cardiac hypertrophy: the CnAβ was increased (<0.05) and the p-NFATc3/t-NFATc3 ratio was decreased (<0.05), but the PI3-K(p110α) and p-Akt/t-Akt ratio showed no significant difference (>0.05) in SHR-SED group; compared with SHR-SED group, the CnAβ was reduced (<0.05), and the p-NFATc3/t-NFATc3 ratio, PI3-K(p110α) and p-Akt/t-Akt ratio were raised (<0.05) in SHR-MIIT group; in addition, the CnAβ, PI3-K(p110α) and p-Akt/t-Akt ratio were increased (<0.05), the p-NFATc3/t-NFATc3 ratio was decreased (<0.05) in SHR-HIIT group.: The health effect of long-term interval training on hypertension was dependent on exercise intensity, the MIIT can transform the pathological into physiological hypertrophy to improve the cardiac function, but the HIIT exacerbated cardiac remodeling and accelerate heart failure in SHR. The mechanism was considered to be related to the different regulation of interval training on myocardial collagen metabolism, fetal genes expression as well as the regulation of Cn/NFAT and PI3-K/Akt. Therefore, moderate intensity exercise is still an optimal mode for hypertension patients to rehabilitation in clinical, however, the security and efficiency of HIIT should be further verified.
exercise
2018-07-10;
2019-05-21
天津市自然科学基金项目(17JCYBJC274002)
孟宪欣(1979-),男,副教授,硕士,主要研究方向为运动训练与健康促进, E-mail: mengxianxin1999@126.com。
彭朋(1978-),男,讲师,博士,主要研究方向为运动医学, E-mail: doctorpeng2006@126.com。
G804.7
A
1000-677X(2019)06-0073-10
10.16469/j.css.201906009

