俄罗斯鲟补体C7基因的克隆及表达分析
孙梦洁 陈亚东 高 杰 江炎亮 张 雪 佘定懿 许式见 胡 谋赵爱云 沙珍霞,
(1. 青岛大学生命科学学院, 青岛 266071; 2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 青岛266235; 3. 中国水产科学研究院黄海水产研究所农业部海洋渔业可持续发展重点实验室, 青岛 266071; 4. 中国水产科学研究院农业农村部水生动物基因组学重点实验室, 北京 100141; 5. 杭州千岛湖鲟龙科技股份有限公司, 杭州 311700)
补体系统是迄今所知生物体内最复杂的一个限制性蛋白水解系统, 在先天性免疫中起重要作用,在获得性免疫被激活之前能抵抗细菌和病毒的入侵[1]。鱼类补体通过经典途径、替代途径、凝集素途径激活, 形成环状成孔的膜攻击复合物(Membrane attack complex, MAC)[2], 其抵抗细菌的免疫保护取决于MAC的杀菌活性。MAC由C5b、C6、C7、C8和C9聚集形成, 首先, C5可以分解为小片段的C5a和C5b, C5a是一种重要的炎症介质, 不溶于液相, 而C5b和C6在激活细胞附近通过亚稳结合位点, 形成稳定的C5b-6二聚体[3]。然后, C5b-6自发地与C7结合形成C5b-7三聚体, 从而使中间产物暴露出膜结合位点, 并产生一个短暂的高亲和性脂结合位点, 该结合位点可以非特异性地与周围的靶细胞结合并插入到其细胞膜中。结合到膜上的C5b-7可以与C8结合, 最终与C9结合形成跨膜复合体。其中, C7是形成MAC的关键, 在细胞裂解、宿主防御、促进炎症中起主要作用。
俄罗斯鲟(Acipenser gueldenstaedti), 隶属于硬骨鱼纲(Osteichthyes), 辐鳍亚纲(Actinopterygii), 软骨硬鳞总目(Chondrostei), 鲟形目(Acipenseriformes), 是生存至今的古老种群之一, 也是个体最大、寿命最长的淡水鱼[4]。其鱼子酱具有较高的营养价值和经济价值, 俗称“黑黄金”。然而, 在养殖过程中频繁发生的病害问题对俄罗斯鲟养殖业造成了一定的经济损失[5]。其中, 俄罗斯鲟病害尤以败血症为甚, 危害较大的细菌性病原主要是嗜水气单胞菌(Aeromonas hydrophila)等。
随着渔业生产越来越强调绿色、生态、可持续的发展道路, 免疫增强剂等在水产养殖中得到越来越多的应用。其中壳寡糖具有分子量小、生物相容性好、生物降解性好等优点, 并且具有广谱抗菌活性, 可以提高机体免疫力, 对肠道菌群分布也有重要影响[6,7], 特别适合作为水产动物的饲料添加剂, 以预防和控制疾病。在基础饲料中添加适量的壳寡糖可以显著提高吉富罗非鱼幼鱼(Oreochromis niloticus)[8]、大菱鲆(Scophthalmus maximus)[9]、虹鳟幼鱼(Oncorhynchus mykiss)[10]、锦鲤(Cyprinus carpio koi)[11]等免疫调节能力。鉴于俄罗斯鲟补体C7基因的研究未见相关报道, 本实验拟对俄罗斯鲟补体C7基因(AgC7)进行克隆鉴定, 分析其在健康组织、壳寡糖刺激后的组织及细菌感染的免疫组织中的表达变化, 揭示AgC7基因与俄罗斯鲟免疫的相关性, 为俄罗斯鲟健康养殖提供理论依据。
1 材料与方法
1.1 实验用鱼、壳寡糖饲料和病原菌
健康俄罗斯鲟[体重(450.0±10.0) g, 体长(47.5±2.5) cm, 鱼龄12个月左右]由浙江杭州千岛湖鲟龙科技股份有限公司衢州鲟龙水产食品科技开发有限公司提供; 壳寡糖为衢州鲟龙水产食品科技开发有限公司惠赠(购自青岛市诺玛科生物技术有限公司); 基础饲料由天邦食品股份有限公司宁波分公司提供; 实验所用的嗜水气单胞菌为本实验室从俄罗斯鲟病鱼个体中分离获得, 并根据其形态特征、生理生化特性及16S rRNA基因序列进行了鉴定。
1.2 饲喂实验
俄罗斯鲟在户外带有遮阳棚的水泥养殖池(直径4.0 m, 深度1.8 m, 水深0.8 m)中进行流水养殖, 养殖用水引自乌溪江, 水温保持(22±3)℃。实验开始前用基础饲料饲喂俄罗斯鲟10d, 以消除环境胁迫,壳寡糖饲料饲喂组(以下均简称为实验组)和普通饲料饲喂组(以下均简称为对照组)各设3个平行组, 每组100条鱼, 按照3.00%质量比添加壳寡糖制备含糖饲料, 用于实验组俄罗斯鲟的饲喂; 对照组采用基础饲料进行饲喂[12], 每组饲喂时间均为60d, 每天按照俄罗斯鲟体重的5.00%投喂饲料2次, 同时进行常规的残饵和粪便清理以保证水体清洁。
1.3 感染实验
在嗜水气单胞菌感染实验中, 实验组用半致死剂量的菌液(半致死剂量3.18×105CFU/g)对健康俄罗斯鲟进行腹腔注射, 对照组用同体积的PBS (300 µL/200 g)腹腔注射健康俄罗斯鲟, 每组设置3个重复,每个重复随机选取72个鲟鱼个体[13]。
1.4 样品的采集与保存
在组织取样前, 将所有组的俄罗斯鲟饥饿处理24h, 然后解剖分离组织。分别随机选取实验组和对照组的各3尾俄罗斯鲟分离血液、脑、鳃、性腺、心脏、头肾、肠、肝、肌肉、皮肤、脾、胃和后肾组织; 在嗜水气单胞菌感染实验中, 腹腔注射0、6h、12h、24h、48h、72h和96h后分别随机选取3尾俄罗斯鲟分离血液、鳃、头肾、肠、肝和脾组织。将所有收集的组织立即放入液氮中, 然后转移至-80℃冰箱中长期保存, 以备RNA提取。
1.5 总RNA提取及cDNA合成
根据动物组织总RNA提取试剂盒(天根, 北京)的说明书, 从保存于-80℃的各种组织中提取总RNA。然后用Agilent 2100 biological analyzer (Applied Biosystems, 美国)检测其质量和浓度, 琼脂糖凝胶电泳(1.00%)检测提取的RNA的完整性。最后,用DNaseⅠ酶于37℃下消化30min以去除残留的DNA[14]。用Prime ScriptTMRT reagent Kit (宝生物,大连)合成cDNA第一条链, 合成的cDNA放置在-20℃冰箱。
1.6 AgC7基因cDNA全长克隆
根据从俄罗斯鲟性腺转录组数据库中获得的AgC7基因部分序列[15], 用Primer 5设计特异性引物(表 1), 通过普通PCR和RACE (Rapid-amplification of cDNA ends)克隆扩增AgC7基因的全长cDNA序列。首先, 通过普通PCR反应获得AgC7基因的部分序列, 反应体系: 1.0 µL cDNA模板(100 ng/µL)、1.0 µL上游引物(10 µmol/L)、1.0 µL下游引物(10 µmol/L)、4.0 µL dNTP Mix、5.0 µL 10×RTaqBuffer、0.5 µL RTaq和37.5 µL ddH2O; 扩增程序设定为: 95℃7min预变性; 95℃ 30s, 60℃ 30s, 72℃ 3min, 35个循环; 72℃延伸5min。PCR产物经过琼脂糖凝胶电泳分析、切胶回收纯化后, 连接到Trans-T1载体(全式金, 北京)并转化大肠杆菌BL21 (DE3)感受态细胞,挑选阳性克隆进行测序, 验证AgC7基因的部分序列[16]。然后采用Clontech SMARTerTMRACE cDNA Amplification Kit试剂盒(Clontech)进行3′RACE和5′RACE扩增以获得AgC7基因的完整cDNA序列。反应体系: 1.0 µL cDNA模板(100 ng/µL)、1.0 µL上游引物(10 µmol/L)、1.0 µL下游引物(10 µmol/L)、3.5 µL PCR MasterMix (含染料)和13.5 µL ddH2O;扩增程序设定为: 95℃ 5min预变性; 94℃ 30s, 55℃30s, 72℃ 60s, 35个循环; 72℃延伸7min。
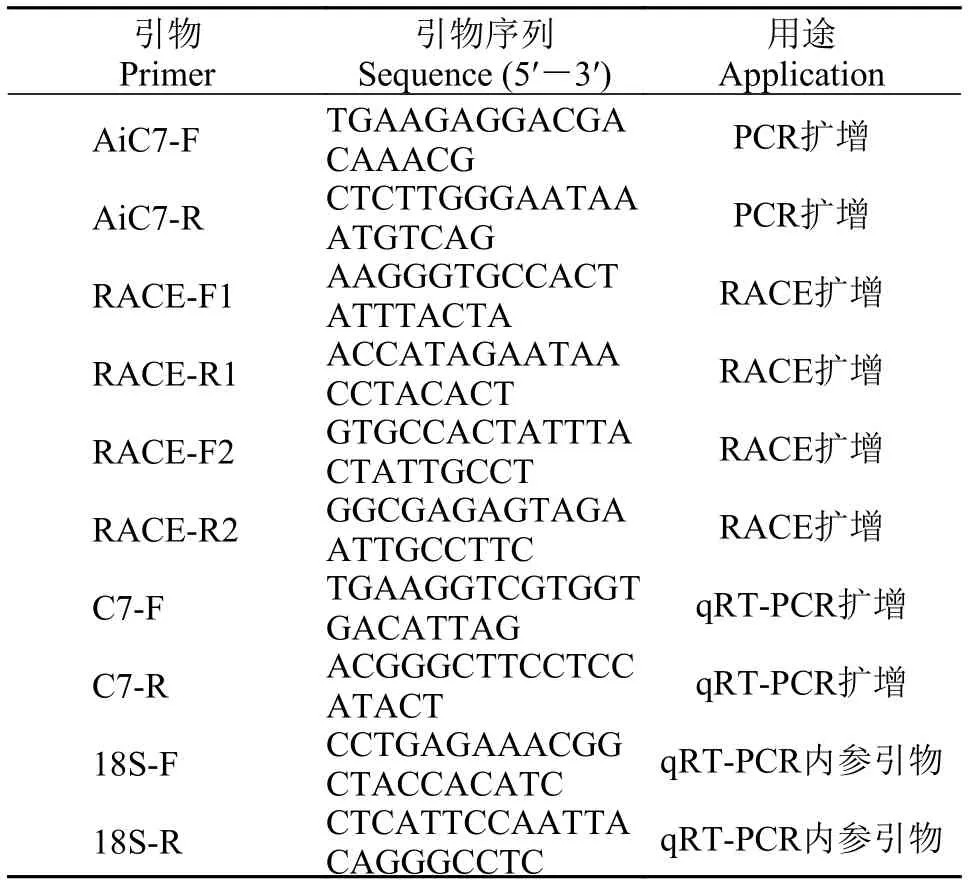
表 1 俄罗斯鲟补体C7基因克隆和表达分析所用引物Tab. 1 PCR primers used for cloning of C7
1.7 AgC7基因的序列分析
将测序得到的AgC7基因的cDNA序列信息提交到NCBI网站(http://blast.ncbi.nlm.nih.gov/blast.cgi), 通过BLAST程序对其进行核苷酸同源性比对。通过NCBI ORF Finder (http://blast.ncbi.nlm.nih.gov/gorf/gorf.html), 分析cDNA序列的开放阅读框(ORF)。使用ExPasy website (http://www.expasy.org)预测氨基酸序列, 用Protparam (http://www.expasy.org/tools/protparam.html)预测其相对分子质量和等电点。通过DNAMAN对AgC7与GenBank上下载的其他物种的C7进行多重序列比对, 利用MEGA 5.1软件中相邻连接法(Neighbor-Joining method)构建系统进化树。用SignalP 4.0 Server进行蛋白质信号肽预测, 在SMART online tool (http://smart.emblheidelberg.de)中预测蛋白的结构域。
1.8 AgC7基因的表达分析
使用ABI PRISM 7500HT荧光定量PCR仪(Applied Biosystems, 美国), 采用SYBR®Premix ExTaq™(宝生物, 大连)进行AgC7的qRT-PCR检测, 研究AgC7基因在俄罗斯鲟健康组织、壳寡糖刺激后的组织及病原刺激后的免疫组织中的表达水平。用FastKing RT Kit试剂盒(With gDNase) (宝生物, 大连)合成cDNA第一条链, 稀释10倍作为qRT-PCR扩增反应的模板, 以俄罗斯鲟18S rRNA为内参, 每个样品设置3个重复, 反应体系如下: 0.6 µL上游引物(10 µmol/L)、0.6 µL下游引物(10 µmol/L)、10.0 µL 2×Realtime PCR Super mix、1.0 µL cDNA sample(100 ng/µL)和7.8 µL ddH2O[17]。反应程序为: 95℃预变性8min; 95℃变性10s, 60℃退火20s, 72℃延伸35s, 40个循环; 72℃延伸7min。实验中使用的引物如表 1。
1.9 数据分析
qRT-PCR实验数据经7500 software v2.0.6.处理后, 以平均值±标准差(Mean± SD)表示, 使用2-ΔΔCt法计算相对表达量。用SPSS 19.0对数据进行处理, 采用单因子方差分析(One-Way ANOVA), Duncan多重比较组间的差异性, 以P<0.05为显著性差异。最后, 用Origin 9软件对相对定量表达做直方图。
2 结果
2.1 AgC7基因的cDNA全长克隆
将克隆获得的AgC7基因cDNA的5′-UTR和3′-UTR进行序列拼接并通过BLAST分析后确定为补体C7。AgC7基因的cDNA全长为3103 bp (GenBank登录号: MH973660), 5′-UTR为44 bp, 3′-UTR为554 bp,开放阅读框(Open Read Frame, ORF)为2502 bp, 编码833个氨基酸残基, 加尾信号在PolyA上游20位核苷酸处。
2.2 AgC7基因编码蛋白的生物信息学分析
推导的AgC7蛋白相对分子质量约为92.3 kD,等电点为6.24, GC含量为45.64%。AgC7蛋白存在16个氨基酸残基(Amino acid, aa)的信号肽序列(3—18 aa), 其中包括8个蛋白结构域、2个TSP1结构域(32—82和492—540 aa)、1个LDLa结构域(86—123 aa)、2个FIMAC结构域(687—755和760—832 aa)、1个MACPF结构域(237—439 aa)和2个CCP结构域(560—615和620—677 aa, 图 1)。
AgC7蛋白与其他鱼类的补体C7有广泛的同源性, 其中与斑点雀鳝(Lepisosteus oculatus, XP0066 26977.1)、斑点叉尾鮰(Ictalurus punctatus, XP01732 2364.1)、斑马鱼(Danio rerio, XP005161294.1)、大西洋鲑(Salmo salar, NP001133245.1)、尼罗罗非鱼(Oreochromis niloticus, XP005470513.1)等鱼的氨基酸序列一致性分别为56%、46%、49%、49%和47%。将俄罗斯鲟补体C7与这5种鱼类补体C7的氨基酸序列进行多重比对, 可以看出, 鱼类补体C7存在一些高度保守的氨基酸残基, 尤其是Cys残基, 其分子间形成的二硫键在蛋白折叠和功能驱使中起重要作用[18]。

图 1 补体C7的预测结构域Fig. 1 Domain structure prediction of complement C7
从NCBI blast的比对结果中选取来源于其他物种补体C7的氨基酸序列, 包括哺乳类人(Homo sapiens, J03507.1)、苏门答腊猩猩(Pongo abelii, NM 001132284.1)、家鼠(Mus musculus, NM0012438 37.1); 两栖类非洲爪蟾(Xenopus laevis, NM00109 1647.1); 爬行类扬子鳄(Alligator sinensis, XP006 033524.1); 鱼类斑点雀鳝(L. oculatus, XP006626 977.1)、(Miiuy croaker, KP689602.1)、鲢(Hypophthalmichthys molitrix, JN806258.1)、褐牙鲆(Paralichthys olivaceus, AB020964.1)、虹鳟(O. mykiss,NM001124618.1)、草鱼(Ctenopharyngodon idella,JN655169.1)、斑马鱼(D. rerio, XP005161294.1)、尼罗罗非鱼(O. niloticus, XP005470513.1), 用MEGA 5.1构建系统发育树(图 2)。从图 2可以看出, 鱼类C7聚在一起, 其中AgC7与鲢处于同一分支上, 亲缘关系较近, 然后与褐牙鲆、虹鳟、草鱼、尼罗罗非鱼聚为一类, 而斑点雀鳝和鮸鱼聚为另一类, 水生动物的补体C7与哺乳动物亲缘关系较远。
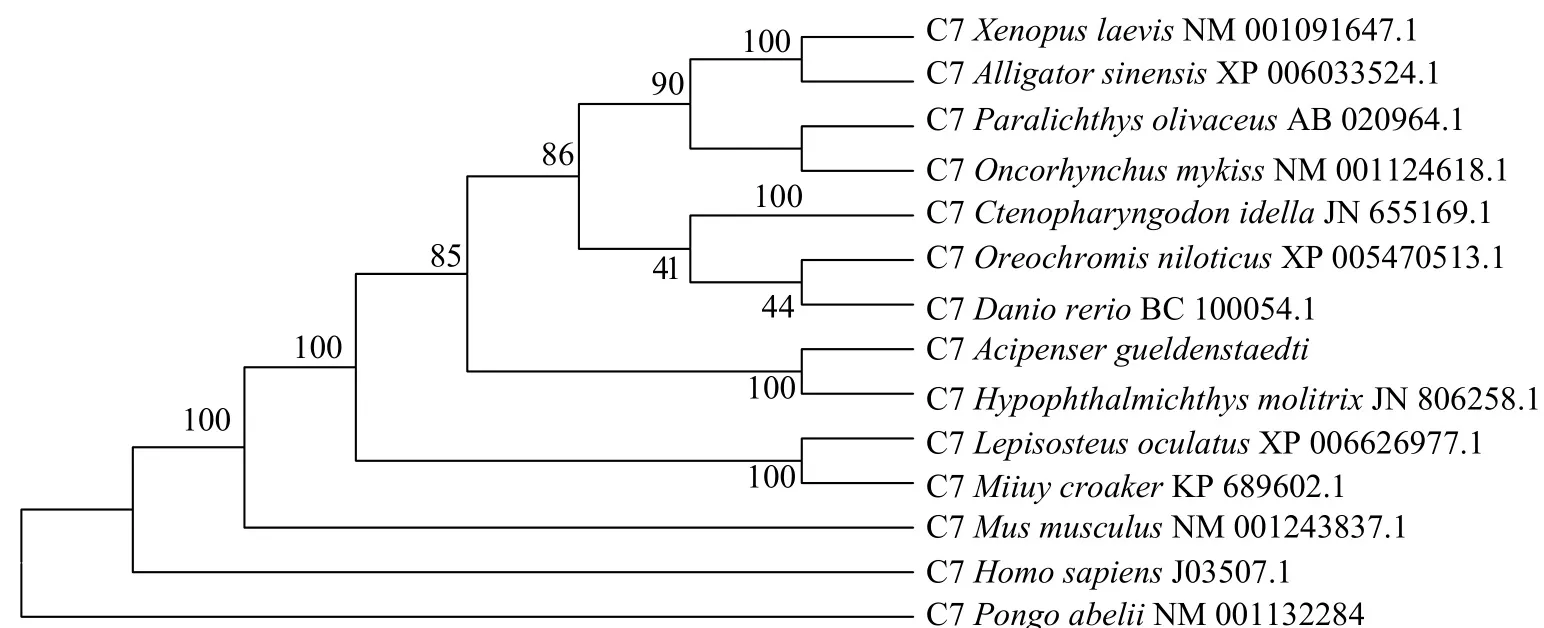
图 2 俄罗斯鲟补体C7的进化树分析Fig. 2 Phylogenetic analysis of Russian sturgeon complement C7
2.3 AgC7基因在健康俄罗斯鲟组织中的表达分析
AgC7基因在检测的健康俄罗斯鲟血液、脑、鳃、性腺、心脏、头肾、肠、肝、肌肉、皮肤、脾、胃和后肾共13种组织中均表达。设定表达量最低的肌肉为参考值1.00, 相对表达量最高的组织是肠(211), 其次是脑(90)、血液(72)、头肾(52)和心脏(41), 在胃(33)、肝(18)、脾(17.1)、鳃(12.5)、性腺(8.1)、皮肤(5.6)及后肾(1.2)中的表达量相对较低,AgC7基因在不同组织中表达存在组织特异性(图 3)。用添加壳寡糖的饲料饲喂健康俄罗斯鲟60d,AgC7基因的相对表达量如图 3, 结果显示实验组基因的相对表达水平高于对照组, 壳寡糖能够诱导AgC7基因的上调表达。且AgC7基因在肠中表达上升的趋势最明显, 约为对照组的1.51倍。肠道是主要的免疫器官, 补体表达量提高, 可以抵抗微生物感染。
2.4 细菌性病原刺激后AgC7基因在俄罗斯鲟免疫组织中的表达分析
经嗜水气单胞菌感染健康俄罗斯鲟后,AgC7基因在免疫组织中不同时间点的表达水平如图 4,结果显示:AgC7基因的表达量迅速上升, 随着病原菌感染时间增加, 基因表达量逐渐下降并恢复至正常水平。设组织中0的基因表达量为参考值1.00。血液中AgC7基因表达上调, 最大表达量出现在感染后72h, 是对照组的4.23倍; 在鳃中AgC7基因表达的上调趋势最明显, 最大表达量出现在感染后6h,为对照组的41.30倍, 12h后基因表达迅速下降并恢复至正常水平; 在头肾和脾中基因的表达呈现相同的上调趋势, 其表达峰值出现在嗜水气单胞菌感染后24h, 在头肾中为对照组表达量的2.70倍, 在脾中为对照组表达量的6.01倍; 在肠和肝中AgC7基因表达量变化不大, 在肠中最大表达量出现在感染后6h,是对照组的1.58倍, 在肝中最大表达量出现在感染后12h, 是对照组的1.48倍。
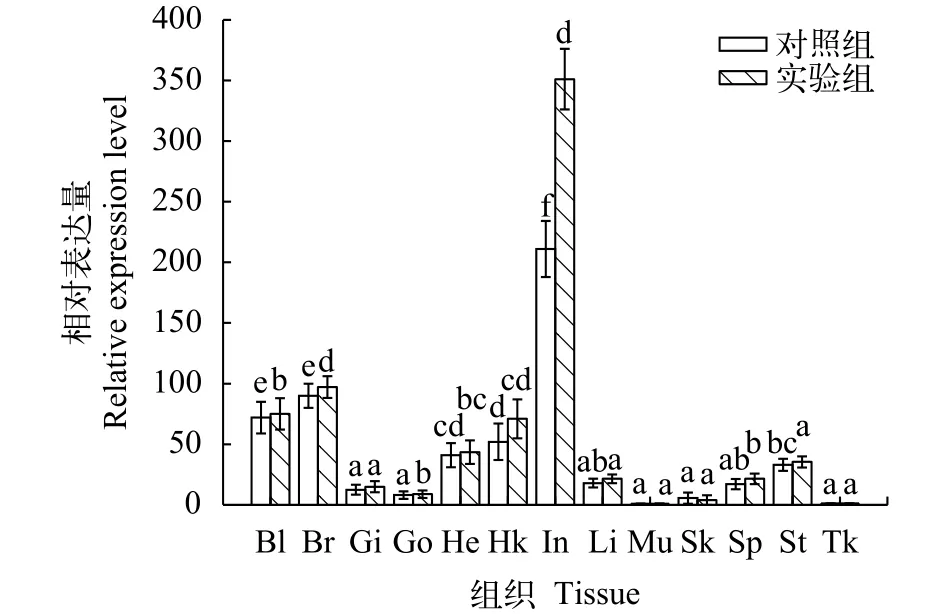
图 3 补体C7基因在俄罗斯鲟健康组织及壳寡糖刺激后的组织中的实时定量表达分析Fig. 3 The gene expressions of AgC7 in all tissues from healthy Russian sturgeon and chitosan oligosaccharide stimulated group血液(Bl)、脑(Br)、鳃(Gi)、性腺(Go)、心脏(He)、头肾(Hk)、肠(In)、肝脏(Li)、肌肉(Mu)、皮肤(Sk)、脾(Sp)、胃(St)、后肾(Tk)。用SPSS 19.0软件, 采用单因子方差分析法(One-Way ANOVA)分析数据差异性, 图中“a, b, c”为SPSS软件中Duncan算法计算出的子集分组。有相同字母表示差异不显著(P>0.05), 无相同字母表示差异显著(P<0.05)Blood (Bl), brain (Br), gills (Gi), gonad (Go), heart (He), head kidney (Hk), intestine (In), Liver (Li), muscle (Mu), skin (Sk),spleen (Sp), stomach (St), trunk kidney (Tk). Statistical analysis of differences was done by one-way analysis of variance (ANOVA)on SPSS 19.0 software, the letters “a, b, c” are subsets by Duncan algorithm. The same letters indicated that there was no significant difference in groups (P>0.05), the different letters indicated that there was significant difference in groups (P<0.05)
3 讨论
研究表明, 补体C7与C5b、C6、C8、C9形成膜攻击复合物, 它们都属于同一个基因家族, 可能由同一个原始基因经过一系列进化形成[19]。免疫系统作为机体生存的必需部分, 可以保护机体免受病原体的侵害。目前, 先天性免疫和获得性免疫已得到全面研究, 获得性免疫可以追溯到脊椎动物进化的早期阶段[2]; 相比较而言, 先天性免疫是一种古老的防御机制, 并在获得性免疫激活之前发挥作用,所以补体系统的重要性是不言而喻的。在哺乳动物之外的物种中很少有关于补体C7的研究, 鱼类补体系统的研究始于20世纪80年代, 但有关鱼类补体C7的报道还比较少。补体C7基因最早在人类血清中被发现; 在硬骨鱼类中,C7基因最早在日本比目鱼中得到克隆鉴定[19]。此后, 对虹鳟(O. mykiss)[19]、草鱼(C. idellus)[18]、鲢(H. molitrix)[20]和(M. mii-uy)[21]等物种进行了C7基因的克隆和分析, 其他鱼类的研究仍然相对较少。2005年Zarkadis等[22]从虹鳟中分离得到C7-1(编码808个氨基酸)和C7-2(编码845个氨基酸)2个基因亚型, 并显示虹鳟C7发生了基因复制。在硬骨鱼类和哺乳动物之间, 补体成分有一些相似的结构单元, 如TSP1、LDLa、MACPF。虹鳟C7-1基因结构中含有2个TSP1和2个CCP, 及LDLRa、MACPF、EGF、FIMAC各1个,虹鳟C7-2除了含有虹鳟C7-1所含有的结构单元外,还多含有一个FIMAC, 而这第2个FIMAC可能与增强C7-2与C5b-6二聚体复合物之间的相互作用有关[22]。C7-1和C7-2则具有相似的结构域, 但进化模式不同, 在健康组织和感染组织中表达模式不同, 但在抵抗病原感染中均发挥重要作用[21]。本研究对俄罗斯鲟补体C7进行了分子克隆和鉴定, 获得了其全长cDNA序列, 并对其氨基酸序列进行生物信息学分析, 发现其同样含有这些保守结构, 说明俄罗斯鲟补体C7具有抵抗外源病原体保护机体的免疫功能。
研究基因的组织分布模式有助于初步了解这些基因的生理功能。补体基因作为一种免疫分子,普遍存在于生物体各个组织, 并参与生物体抵抗病原微生物的入侵过程。荧光定量PCR分析表明,AgC7基因在健康俄罗斯鲟13种组织中均表达良好,但不同组织间的表达水平差异很大, 且在肠中表达水平最高, 一方面表明补体C7在各个组织中起着广泛的作用, 执行相同的免疫防御功能; 另一方面不同组织差异性的表达模式可能反应了不同组织特有的生物学作用, 这与其他水生动物的表达特征有些不同。研究发现, 草鱼补体C7在心脏、头肾、肠、肝、皮肤、脾、后肾中表达, 且在肝脏中表达水平最高, 在血液、脑、鳃、肌肉中不表达[18];补体C7-1和C7-2在脑、眼、鳍、鳃、心脏、头肾、肠、肝、肌肉、脾中均表达, 且均在肝脏中表达水平最高, 在其他组织中表达量不同[21]; 虹鳟补体C7在肾、脾中不表达, 在其他组织中均表达[19]。用含壳寡糖的饲料饲喂健康的俄罗斯鲟60d, 组织中补体C7基因的表达水平均上调。壳寡糖对免疫器官及多种免疫细胞有重要的免疫调节作用, 激活补体系统并能诱导分泌细胞因子, 完善了机体免疫系统, 促进机体免疫反应, 进而发挥免疫增强的作用[6,23]。由于近几年养殖环境的变化及国家对养殖安全的高度重视, 因此寻求绿色环保的水产养殖病害防治方法迫在眉睫。目前, 壳寡糖在禽畜方面的应用存在很多的报道, 例如肉鸡(Broilers)[24]、鼠(Mice)[25]、猪(Growing pigs)[26], 大多数研究证明壳寡糖可以增强机体免疫力, 是一种无污染、无残留的饲料添加剂。在水产动物方面研究发现, 在壳寡糖的刺激作用下, 三疣梭子蟹血淋巴中的过氧化物酶活性会增强; 在基础饲料中添加适量的壳寡糖也可以显著提高鱼类等免疫调节能力。本研究探讨了壳寡糖能够诱导俄罗斯鲟补体C7基因的表达, 进而增强机体免疫。
补体C7, 作为膜攻击复合物的重要组成成分,在抵御外源细菌或真菌的入侵中起重要作用。目前对鱼类补体C7生物学活性的研究主要集中在抗菌和抗病毒等免疫活性方面。草鱼在嗜水气单胞菌(革兰氏阴性菌)感染后, 头肾中的补体C7上调表达量最明显, 在第7天达到峰值, 肝、脾、后肾组织补体C7基因表达量也呈现上调趋势[18]。鲢补体C7基因在健康个体中只在脾中表达, 而感染嗜水气单胞菌12h后,C7基因在脑、鳃、心、肾、肠、肝、脾7种组织中迅速表达, 随着病原菌感染时间增加, 补体C7基因的表达量逐渐降低直至恢复正常水平[20]。在俄罗斯鲟感染嗜水气单胞菌后, 血液、鳃、头肾、肠、肝和脾6种组织中AgC7基因的表达均上调, 说明俄罗斯鲟AgC7对嗜水气单胞菌的入侵具有快速响应作用, 机体大量表达AgC7以抵御细菌感染。随着感染时间的推移, 俄罗斯鲟AgC7基因的表达量也逐渐下降, 恢复至正常水平,这与Ewart等[18]的研究报道一致。由此推测, 俄罗斯鲟AgC7在抵抗细菌感染中具有重要作用。
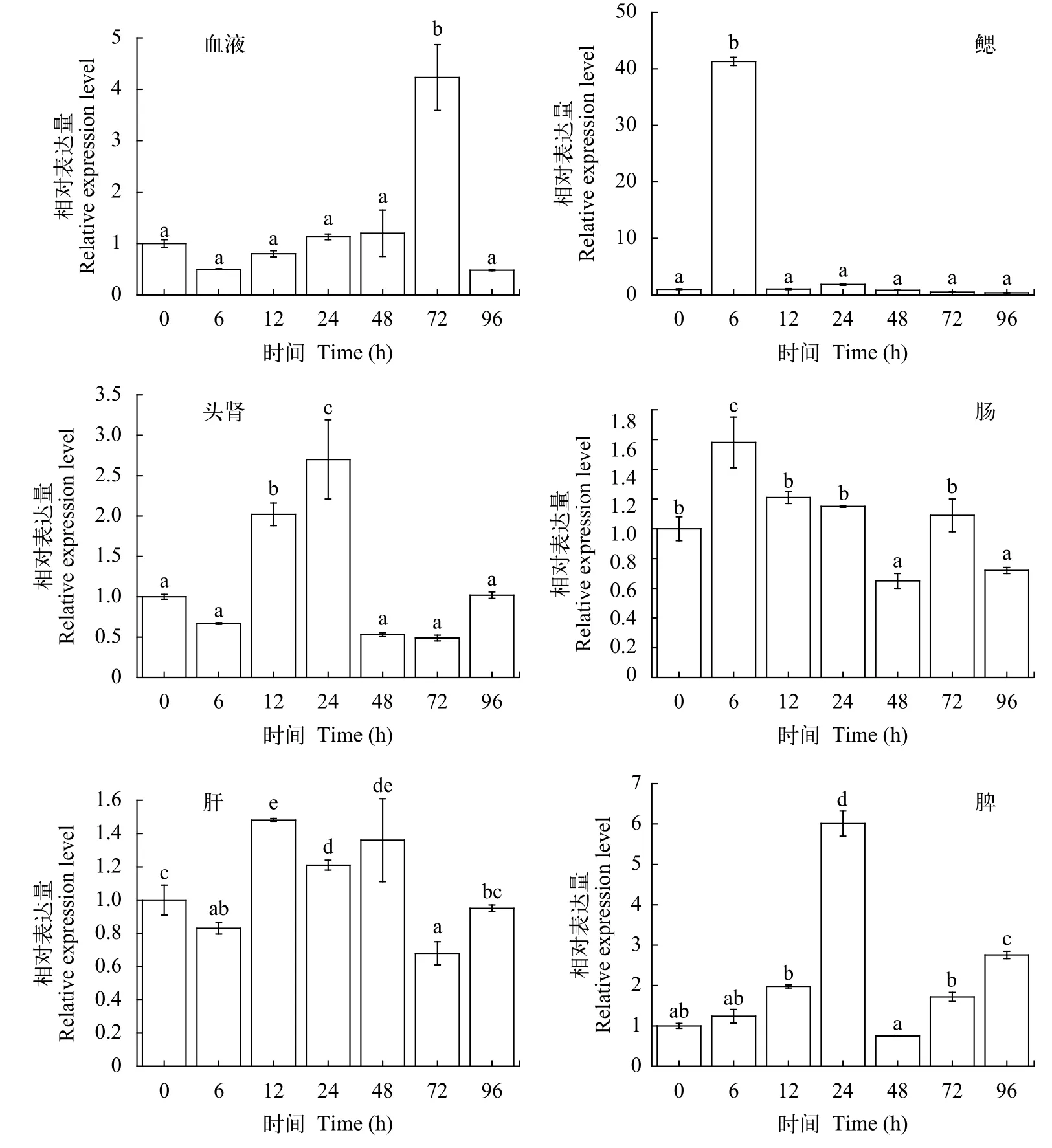
图 4 嗜水气单胞菌感染健康俄罗斯鲟后补体C7基因在免疫组织中的实时定量分析Fig. 4 The expression level of AgC7 in immune tissues after challenging the Russian sturgeon with Aeromonas hydrophila血液(Bl)、鳃(Gi)、头肾(Hk)、肠(In)、肝脏(Li)、脾(Sp); 用SPSS 19.0软件, 采用单因子方差分析法(One-Way ANOVA)分析数据差异性, 图中“a, b, c”为SPSS软件中Duncan算法计算出的子集分组; 有相同字母表示差异不显著(P>0.05), 无相同字母表示差异显著(P<0.05)Blood (Bl), gills (Gi), head kidney (Hk), intestine (In), liver (Li), spleen (Sp). Statistical analysis of differences was done by one-way analysis of variance (ANOVA) using SPSS v19.0 software, the letters “a, b, c” are subsets by Duncan algorithm. The same letters indicated that there was no significant difference in groups (P>0.05), the different letters indicated that there was significant difference in groups(P<0.05)
俄罗斯鲟AgC7具有典型的补体C7基因特征,且壳寡糖刺激和病原感染后均可引起AgC7基因表达变化, 补体C7可能参与了俄罗斯鲟的免疫应答。

