日本结缕草ZjNAC2基因的克隆、亚细胞定位及表达分析
姜红岩,张 蕊,滕 珂,檀鹏辉,刘凌云,尹淑霞
(1.北京林业大学草坪研究所,北京 100083;2.北京草业与环境研究发展中心,北京 100097)
NAC(NAM,ATAF1/2,CUC2)转录因子是植物中特有的一类转录因子,在调控植物生长发育、叶片衰老、响应生物和非生物胁迫等方面发挥着重要作用[1-3]。大量研究表明,NAC转录因子在转基因育种中具有很重要的作用和应用价值[4]。过量表达NAC基因的植株对非生物胁迫具有一定的抗性,因此可以通过转基因技术获得更多的抗干旱、抗盐碱等新的转基因材料[4-5]。全基因组分析已在拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、葡萄(Vitis vinifera)、杨树(Populus tricocarpa)和大豆(Glycine max)中分别鉴定出117、151、79、163、152个 NAC[6-7]。在紫花苜蓿 (Medicago sativa)[7]中MsNAC1基因可能参与了非生物逆境胁迫的生理响应,在高盐、干旱和低温处理下表达量均表现为先上升后下降的趋势。番茄(Lycopersicum esculentum)[8]SlNAC1的过表达提高了番茄植株的耐冷性,同时高温、盐、干旱等非生物胁迫和多种激素均会诱导SlNAC1基因的表达。在水稻[9]中OsNAC5、OsNAC6、OsNAC9和OsNAC10的过表达株系通过根结构适应和调控参与应激反应、防御反应和ABA生物合成的基因来增强耐旱性。Le等[10]研究表明,低温、机械损伤及防御相关的激素(水杨酸、茉莉酸甲酯、脱落酸和乙烯)均会诱导葡萄叶中VvNAC1的表达。
结缕草(Zoysia japonica)是我国重要的暖季型草坪草,分布广泛,普遍应用于各地的运动场、园林绿化等各种草坪[11]。但由于我国结缕草种质资源研究起步晚,其育种工作远远落后于发达国家[12-14]。现代生物技术发展加快了新品种的选育,为进一步改良草坪草的遗传性状提供了条件,加快了草坪草遗传改良的步伐[13,15]。目前对结缕草的研究多数以其抗性为主,利用生物技术通过对其抗性基因抗性机理的深入研究,可为结缕草新品种的培育提供理论依据。本研究通过克隆日本结缕草的ZjNAC2转录因子及其启动子,分别对其进行生物信息学分析,研究ZjNAC2基因在不同组织和不同的发育时期及干旱、高盐和激素处理下叶片中的表达情况;同时研究ZjNAC2基因的亚细胞定位,旨在为进一步深入探究ZjNAC2基因在日本结缕草中的分子调控机理提供基础。
1 材料与方法
1.1 材料
试验所用日本结缕草为‘Meyer',由江苏省中科院植物研究所惠赠;RNA提取试剂盒、质粒提取试剂盒、PCR产物纯化试剂盒均从OMEGA公司购买;反转录试剂盒、PrimeSTAR Max DNA Polymerase、pMD19-T载体、SYBR Mix购自TaKaRa公司;大肠杆菌感受态DH5α均从北京全式金生物技术有限公司购买;2 × GoldStar MasterMix从康为世纪公司购买;Seamless Assembly Cloning Kit从中美泰和生物公司购买;乙烯利(ET)、脱落酸(ABA)、茉莉酸甲脂(MeJA)和PEG4000从SIGMA公司购买。农杆菌菌株EHA105、亚细胞定位载体3302Y3及本生烟草(Nicotiana tabacum)均由北京林业大学草坪研究所实验室保存。
1.2 方法
1.2.1ZjNAC2基因及其启动子克隆
首先以健康生长3个月的日本结缕草植株为材料,根据RNA提取试剂盒中的说明书提取总RNA,以CTAB法提取DNA。提取的总RNA经NanoDrop 2000(Thermal Fisher,USA)和1%的凝胶电泳检测合格后,以其为模板,利用反转录试剂盒获取日本结缕草的cDNA。以获得的cDNA为模板,利用RACE技术进行3'/5'RACE扩增。产物纯化后与pMD19-T载体连接,然后转化大肠杆菌感受态DH5α,阳性克隆菌液送公司测序。从测序正确的菌液中提取质粒,用于后续试验。
以提取的DNA为模板,根据设计的特异性引物SP1、SP2、SP3(表1)进行染色体步移,经琼脂糖凝胶电泳检测后将条带单一的PCR产物送入公司测序。经序列比对正确后,设计启动子特异性引物ZjNAC2-Pro-F/R(表1),用于扩增启动子序列。反应程序为 95 ℃ 10 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃100 s,40个循环;72 ℃ 5 min。产物纯化后与pMD19-T载体连接,然后转化大肠杆菌感受态DH5α,阳性克隆菌液送北京睿博兴科生物技术有限公司测序。从测序正确的菌液中提取质粒,用于后续试验。
1.2.2 生物信息学分析
利用DNAMAN 8.0软件预测ZjNAC2编码的蛋白序列;通过NCBI数据库Blast功能筛选ZjNAC2基因的同源蛋白序列,然后利用MEGA 5.0软件采用Neighbor-jointing法构建系统进化树;通过SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP)和ProtParam (http://web.expasy.org/protparam/)预测蛋白质的分子量、等电点及亲疏水性等;分别通过(http://www.softberry.com/) 和 PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)预 测ZjNAC2的亚细胞定位情况和ZjNAC2基因启动子可能存在的作用元件。
1.2.3 亚细胞定位
以测序正确的PMD-ZjNAC2质粒为模板,以设计的3302Y3-ZjNAC2-F/R为构建载体的引物(表1),利用PrimeSTAR Max DNA Polymerase进行PCR扩增,反应程序 98 ℃ 10 s;98 ℃ 10 s,68 ℃ 40 s,25 个循环;72 ℃ 3 min。同时用BglⅡ单酶切3302Y3载体。通过Seamless Assembly Cloning Kit将纯化后PCR产物与酶切产物进行连接。将连接产物转化涂板后,挑取阳性克隆进行检测。将构建成功的3302Y3-ZjNAC2及空载3302Y3转化农杆菌EHA105,参照Yang等[16]的方法用注射器将重悬后的菌液注射本生烟草(Nicotiana tabacum),暗培养48 h,之后通过激光共聚焦显微镜观察黄色荧光蛋白的分布情况。
1.2.4 基因表达分析
分别剪取根、茎、叶,以及不同衰老程度的叶片,液氮速冻后提取总RNA。对长势一致的‘Meyer'日本结缕草分别喷施 10 μmol·L-1脱落酸 (abscisic acid,ABA)、10 μmol·L-1茉莉酸甲酯 (Methyl Jasmonate,MeJA)、200 μmol·L-1乙烯(ethylene,ET)、300 mmol·L-1NaCl、20%PEG4000,分别在0、1、3、6、12 和24 h取样,液氮速冻后-80 ℃保存,之后提取总RNA。以设计qPCR-F/qPCR-R(表1)为荧光定量引物,以日本结缕草Actin基因(GenBank登录号:GU290546)为内参,参照SYBR Mix说明书进行qRT-PCR反应。本研究采用2-ΔΔCT法计算基因的相对表达量。

表1 引物列表Table 1 Primer list
2 结果与分析
2.1 基因克隆与生物信息学分析
通过RACE技术获得了ZjNAC2目的基因(图1),该基因的开放阅读框为1 110 bp,编码369个氨基酸(GenBank登录号:MH580281)。用ExPASy server预测ZjNAC2的理论等电点为8.32,平均分子质量为39 847.05;酸性氨基酸残基(Asp+Glu)和碱性氨基酸酸残基总数(Arg+Lys)分别为32个、35个;亲水性平均值预测为-0.360,以上预测表明ZjNAC2属于亲水性蛋白。信号肽预测表明,ZjNAC2基因中不含有信号肽。亚细胞定位预测结果显示,ZjNAC2定位于细胞核。系统进化树分析结果显示,ZjNAC2与粟(Setaria italica)的亲缘关系最近(图2)。同源比对结果显示,ZjNAC2的氨基酸序列与慈竹(Bambusa emeiensis)、粟、高粱(Sorghum bicolor)的同源性较高(图3),相似度分别为73.66%、72.22%和71.58%。保守结构域分析表明,该基因编码的蛋白在N端有一个典型的NAM结构域。综上所述,试验所获得的ZjNAC2基因属于NAC转录因子家族。
2.2 启动子克隆与作用元件分析
以DNA为模板进行染色体步移,测序结果经序列比对正确后,用设计的启动子特异性引物进行扩增,经琼脂凝胶电泳检测PCR扩增产物。经序列比对正确,克隆得到ZjNAC2基因启动子序列,1 574 bp(图4A)。用PlantCARE网站分析ZjNAC2启动子上可能存在的潜在结合位点,如CAAT-box、TATA-box、脱落酸响应元件(ABRE)、赤霉素响应元件(CCTTTTG motif)、生长素响应元件(AACGAC motif)、HSE、MYB和TC-rich repeat等顺式作用元件。这些顺式作用元件可能响应植物激素、参与逆境胁迫防御应激相关的应答,调控植物的生长发育 (图4B)。
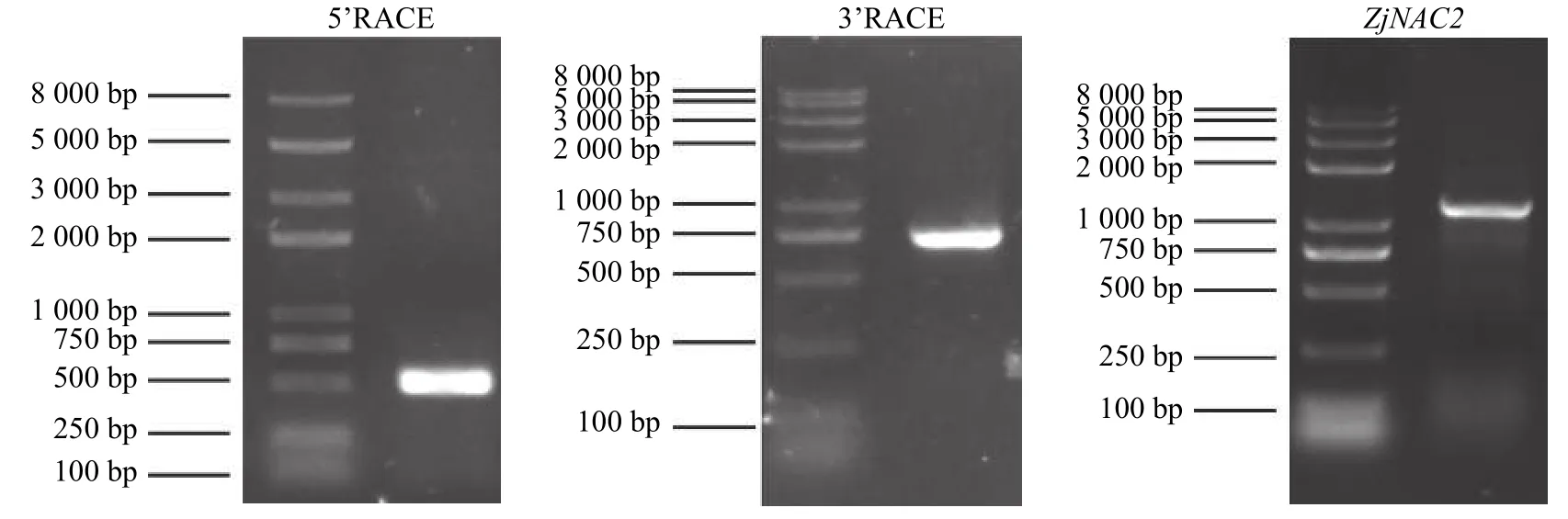
图1 ZjNAC2基因的克隆Figure 1 Molecular cloning of ZjNAC2

图2 ZjNAC2遗传进化分析Figure 2 Phylogenetic analysis of ZjNAC2

图3 ZjNAC2同源性比对分析Figure 3 Sequences alignment analysis of ZjNAC2
2.3 亚细胞定位
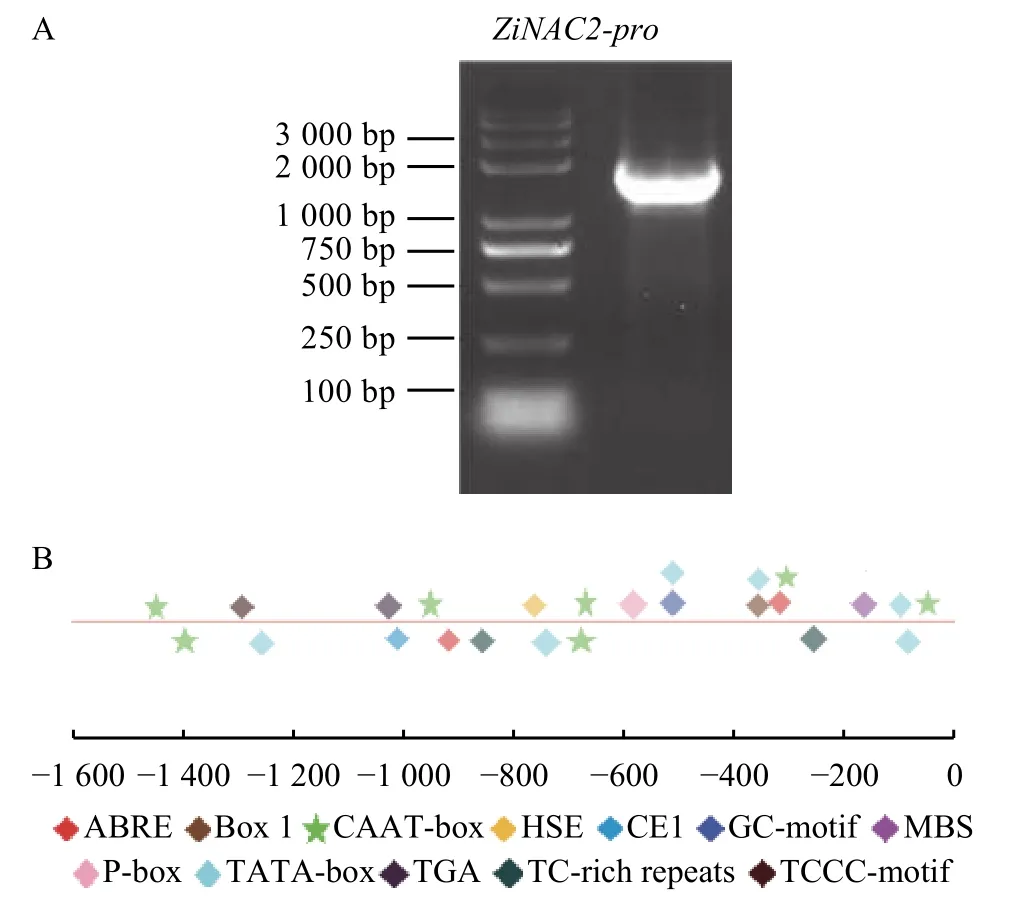
图4 启动子的克隆及其作用元件分析Figure 4 Molecular cloning for isolating promoter,and cis-elements analysis
之前的预测结果显示,ZjNAC2蛋白定位于细胞核中,为验证该结果,通过农杆菌注射烟草,暗培养48 h之后,将注射后的本生烟草叶片置于激光共聚焦显微镜下观察荧光蛋白的分布情况。结果发现,在激发场和融合场中转35S-ZjNAC1-YFP的荧光信号能够在细胞核中检测到,而对照的荧光信号在整个细胞中均能被检测到。试验结果表明,ZjNAC2定位于细胞核中(图5)。
2.4 基因表达分析
为了研究ZjNAC2在日本结缕草中的表达特征,以日本结缕草的根、茎、幼叶、成熟叶、衰老叶为材料,分别提取其总RNA,反转录成cDNA后进行荧光定量分析。结果显示,ZjNAC2在日本结缕草根、茎、叶中均有表达,且在根中的表达量最高,约为茎中表达量的3倍,叶的1.5倍(图6A);ZjNAC2在日本结缕草叶片的不同发育时期表达量不同,在老叶中的表达量明显高于幼嫩叶片和成熟叶片,约为幼嫩叶片中表达量的29倍,成熟叶片中的43倍(图6B)。
为研究ZjNAC2在不同激素处理下的表达特征,对日本结缕草分别喷施ET、MeJA和ABA,分析ZjNAC2在24 h内的表达情况。结果表明,ET处理后,24 h内ZjNAC2的表达水平波动较大,在1 h时其表达量降到最低,约为初始表达量的4倍,3 h时回升,6 h时又降低随后回升(图6C);MeJA处理后,在3 h时ZjNAC2基因的表达量降到最低,约为初始水平的2.5倍,随后在6 h时表达量开始回升(图6D);ABA处理1 h后ZjNAC2的表达量降到最低,约为初始水平的3.25倍,3 h时表达量水平没有发生明显的变化,6 h后其表达量逐渐开始回升 (图6E)。

图5 ZjNAC2的亚细胞定位Figure 5 Subcellular localization of ZjNAC2

图6 ZjNAC2表达特征分析Figure 6 Real-time quantitative PCR of ZjNAC2 expression characteristics
为探究ZjNAC2在干旱、高盐胁迫下日本结缕草中的表达情况,用PEG、NaCl处理,分析ZjNAC2在24 h内的表达情况。结果表明,干旱处理1 h后ZjNAC2的表达量降低了93.75%,随后逐渐开始回升,在12 h时ZjNAC2的表达量显著上升,其表达量约为胁迫前的4.4倍(图6F);高盐处理后,ZjNAC2的表达水平随着处理时间的延长逐渐上升,在12 h时达到峰值,约为对照的4.8倍(图6G)。
3 讨论
NAC(NAM,ATAF1/2,CUC2)转录因子是植物中最大的转录因子家族之一,不同的家族成员在植物发育过程和应激反应中具有不同的功能,其在拟南芥等模式植物中关于抗性胁迫方面的研究较为清楚,但在日本结缕草中的报道很少。本研究从日本结缕草中克隆得到了ZjNAC2基因,其编码区全长1 110 bp,编码369个氨基酸。通过蛋白保守结构域分析表明ZjNAC2编码的氨基酸N端具有典型的NAM结构域,属于NAC转录因子家族[17]。同源比对结果显示C端结构差异明显,不具有保守型,表明NAC转录因子通过有差异的C端来调控转录激活的。进化树分析显示,ZjNAC2与粟NAC的亲缘关系最近。亚细胞定位结果显示,ZjNAC2蛋白定位于细胞核中,与番茄SlNAC1[8]、水稻OsNAC3[18]、紫花苜蓿MsNAC2[19]的定位结果一致,表明ZjNAC2作为一个转录因子在细胞核中发挥作用。
启动子是一类启动基因表达的顺式作用元件,位于结构基因5' 端上游的DNA序列,通过与特定的转录因子结合,调控基因的转录[20]。启动子作为转录水平上重要的调控元件,在基因工程领域开发和分子网络机制的研究具有重要的意义。研究发现,不同的NAC转录因子响应的元件不一样,有的可以同时受不同的激素、非生物胁迫等调控[21]。本研究通过PCR扩增获得了ZjNAC2基因1 574 bp的启动子序列。对ZjNAC2上游启动子序列的分析发现,除了具有典型的核心启动子区域外,ZjNAC2启动子还含有多个与激素、逆境诱导相关的元件和光反应相关元件,比如脱落酸响应元件ABRE、赤霉素响应元件CCTTTTG motif、生长素响应元件AACGAC motif、热胁迫响应元件HSE以及参与干旱反应的MYB元件。这表明ZjNAC2基因可能参与了不同激素的信号传导途径,并受热、光、干旱等多种外界环境因子的诱导调控,为进一步探究ZjNAC2的表达特征提供了依据。
组织特异性表达模式分析研究表明,ZjNAC2在不同的组织中均有表达,在根中的表达水平最高,显著高于茎和叶中的表达量。研究结果与玉米(Zea mays)中的ZmNAM[22]、紫花苜蓿中的MsNAC2[19]的表达情况一致。孙志超等[23]对桑树(Morus alba)中CUC1、NAC100a和NAC100b基因研究表明,CUC2在叶片中表达最高,而NAC100a和NAC100b在冬芽中表达最高。这表明不同的NAC家族成员在不同的组织表达量不同,在植物生长发育过程中发挥的功能可能不同。不同发育时期的叶片表达模式分析表明,ZjNAC2在老叶中的表达水平显著高于幼叶、成熟叶片中的表达量,与拟南芥中AtNAC072的表达情况一致[3]。这表明ZjNAC2的表达可能与植物的叶片衰老有关,可能参与了叶片的衰老进程。
大量研究发现,NAC转录因子大部分都会受到多种生物和非生物胁迫的影响,响应多种激素和应答反应[9,24]。本研究中用ET处理日本结缕草后,ZjNAC2的表达模式表现为先下降后回升,之后在6 h时又下降后回升的波动趋势,这与香蕉(Musa nana)中MaNAC5[25]的表达模式类似,推测ZjNAC2受乙烯的调控表达。乙烯可诱导香蕉果肉和果皮中的MaNAC1和MaNAC2表达,且与EIN3相互作用,而果皮中MaNAC6受乙烯的抑制[25]。这表明不同的NAC转录因子可受到乙烯的不同调控。喷施MeJA后,ZjNAC2的表达量在3 h时下降,12 h时又达到最高点,表明ZjNAC2的表达可受到MeJA的不同调节。研究发现许多NAC转录因子在拟南芥和水稻中调控其对非生物胁迫和ABA的响应[26-27]。本研究中喷施ABA和浇灌PEG后,ZjNAC2的表达水平在表现为先下降后回升的趋势,表明ZjNAC2的表达受到ABA、干旱胁迫的调控,推测其可能参与日本结缕草响应ABA和干旱胁迫的调控途径。这与拟南芥中ANAC019、ANAC055、ANAC072受干旱和脱落酸诱导的表达结果一致,在转基因植物中明显上调且耐旱性明显增强[28]。这表明ABA和干旱胁迫可能诱导NAC转录因子表达,也可能下调其表达水平来增强或减弱植物的耐旱性。本研究中启动子元件分析发现,ZjNAC2启动子含有多个响应脱落酸和干旱胁迫的作用元件,因此ZjNAC2可能与植物的耐旱性有关,可以通过试验进一步研究其调控机理。高盐胁迫处理日本结缕草后,ZjNAC2的表达量逐渐上升,高盐处理诱导ZjNAC2表达,这与拟南芥中的ATAF1[29]、水稻中的OsNAC6[30]、葡萄中的VvNAC1[10]研究结果一致。
4 结论
本研究从日本结缕草中克隆获得了ZjNAC2的基因序列1 110 bp,编码369个氨基酸。保守结构域分析表明ZjNAC2属于NAC转录因子家族。同时通过染色体步移的方法获得其1 574 bp的启动子序列,通过作用元件分析发现该启动子上有多个不同的响应元件。亚细胞定位结果显示,ZjNAC2定位于细胞核。荧光定量表达分析表明,ZjNAC2在衰老叶片中的表达量最高,且ZjNAC2的表达受ET、MeJA、ABA及干旱和高盐处理的调控。本研究结果表明,ZjNAC2转录因子可能参与多种信号传导途径,这为进一步深入研究其功能奠定了基础。

