气相色谱法检测加米霉素原料药中6种溶剂的残留
侯林 张聪 姚路路
摘要 [目的]建立加米霉素原料药中丙醛、丙酮、乙腈、乙酸乙酯、正庚烷和吡啶6种溶剂残留的检测方法。[方法]采用气相色谱法,色谱柱为DB-624(30 m×0.32 mm×1.8 μm);采用氢火焰离子化检测器(FID),温度250 ℃,载气为N2;程序升温,流速为1.2 mL/min。[结果]丙醛、丙酮、乙腈、乙酸乙酯、正庚烷和吡啶在各自浓度范围内线性关系良好,检测限分别为1.7、5.0、4.1、5.0、1.7和2.0 ng,平均加样回收率为99.1%~103.0%。[结论]该方法适用于加米霉素原料中溶剂残留的检测。
关键词 加米霉素;残留溶剂;气相色谱法
中图分类号 S 859.79+6 文献标识码 A
文章编号 0517-6611(2019)12-0200-03
doi:10.3969/j.issn.0517-6611.2019.12.055
开放科学(资源服务)标识码(OSID):
Abstract [Objective] To establish the method for determination of six residual solvents in gamithromycin. [Method] The experiment was carried out by GC with column of DB-624 capillary column (30 m×0.32 mm×1.8 μm),temperature of detector (FID) 250 ℃,carrier gas of N2,and programmed temperature with flow rate of 1.2 mL/min. [Result] The linear relationships of propanal,acetone,acetonitrile,ethyl acetate,nheptane and pyridine were good in respective concentration ranges. The limits of detection were 1.7,5.0,4.1,5.0,1.7 and 2.0 ng,respectively. The average recovery was 99.1%-103.0%. [Conclusion] The method is suitable for the determination of residual solvents in gamithromycin.
Key words Gamithromycin;Residual solvents;Gas chromatography
加米霉素(Gamithromycin)是由梅里亞公司开发的氮杂大环内酯类抗生素,其在7α位为丙基取代,在生理pH条件下,有利于快速吸收,在靶组织富集。其制剂产品zactran经EMEA批准用于治疗由溶血性曼氏杆菌、多杀性巴氏杆菌等引起的牛、猪呼吸系统疾病[1],相关产品已在国内批准上市[2]。加米霉素在合成过程中使用了丙酮、吡啶、正庚烷、乙酸乙酯、乙腈和丙醛等有机溶剂[3-8],不可避免地会有部分残留在终产品中,进而会在使用过程中残留在动物体内造成伤害。根据《中华人民共和国兽药典》中对各类溶剂残留量的要求[9],笔者建立了气相色谱法测定加米霉素中6种有机溶剂残留的检测方法,结果表明,该方法可以用于加米霉素原料药中残留溶剂的测定。
1 材料与方法
1.1 仪器与试剂
岛津GC2010PLUS气相色谱仪,配氢火焰离子化检测器(FID);BS224S电子分析天平。
加米霉素,批号171001、171002、171003,洛阳惠中兽药有限公司;N,N-二甲基甲酰胺,光谱纯,国药集团化学试剂有限公司;丙酮、乙腈,色谱纯,德国默克;乙酸乙酯、正庚烷、吡啶,色谱纯,上海试剂一厂;丙醛,分析纯,阿拉丁试剂。
1.2 色谱条件
色谱柱:DB-624(30 m×0.32 mm×1.8 μm);柱温:起始温度37 ℃,保持6 min,以15 ℃/min 速率升温至150 ℃,然后以40 ℃/min速率升温至240 ℃,保持5 min。
FID检测器温度: 250 ℃;气化室温度:200 ℃;载气:N2;恒压模式流速:1.2 mL/min;分流比:50∶1;进样量:1 μL。
1.3 溶液的配制
1.3.1 对照品储备液。
称取丙醛0.055 3 g、丙酮0.469 6 g、乙腈0.052 6 g、乙酸乙酯0.495 2 g、正庚烷0.475 6 g、吡啶0.061 8 g,精密称定,分别置10 mL容量瓶中,加N,N-二甲基甲酰胺(DMF)溶解并稀释至刻度,摇匀,即得对照品储备液。
分别取丙醛、丙酮、乙腈、乙酸乙酯、正庚烷和吡啶对照品储备液 1 013、1 065、779、1 010、1 051、324 μL于10 mL容量瓶中,用 DMF定容,摇匀作为丙醛、丙酮、乙腈、乙酸乙酯、正庚烷和吡啶的混合对照品储备液。
1.3.2 供试品溶液。取加米霉素1.0 g,精密称定,加DMF溶解并稀释至10 mL,作为供试品溶液。
1.4 线性关系考察
精确移取混合对照品储备液 150、120、100、80、50 μL,分别用DMF定容至1 mL容量瓶中,即得混合对照品的标准曲线L5、L4、L3、L2、L1,对应的浓度为限量的150%、120%、100%、80%和50%。
1.5 定量限与检测限
取混合对照品储备液依次稀释,分别以信噪比(S∶N)约为10∶1及3∶1时的浓度作为定量限及检测限。
1.6 中间精密度试验
精确移取混合对照品储备液 1.20、1.00、0.80于10 mL 容量瓶中,精确称量1 g 供试品加入各容量瓶中,并用DMF 定容至刻度线摇匀,即为含量为限量120%、100%和80%的供试品加标溶液,各取3组平行样进行中间精密度试验。
1.7 重复性试验
精确移取混合对照品储备液1.00 mL于10 mL 容量瓶中,精确称量1 g 供试品加入容量瓶中,并用DMF 定容至刻度线摇匀,即为含量为限量100%的供试品加标溶液,共进样6次验证系统重复性。
1.8 加样回收率试验
取加米霉素中试样品9份(批号1001),每份约1 g,精密称定,分别置于10 mL容量瓶中,分别精密加入混合对照品储备液0.8、1.0、1.2 mL,用DMF稀释至刻度,配制成限量为80%、100%、120%的回收溶液,各取3组平行样进行回收率测定。
1.9 样品的测定
按照确定的方法对3批加米霉素原料样品(批号171001、171002、171003)进行残留溶剂测定。
2 结果与分析
2.1 系统适应性
精密移取混合对照品溶液 100 μL,用DMF定容至1 mL。分别精密吸取丙醛、丙酮、乙腈、乙酸乙酯、正庚烷和吡啶 10.1、10.7、7.8、10.1、10.5和3.2 μL至1 mL容量瓶中,用DMF定容,作为单标对照品溶液。按“1.2”色谱条件进行分析,结果见图1、2、3和表1。
2.2 线性范围 由表2可知,待测溶剂在规定的浓度范围内线性关系良好。
2.3 检测限与定量限
分别以信噪比约为10∶1及3∶1时的浓度作为定量限及检测限,结果见表3。
2.4 精密度
不同人员在不同时間按“1.6”中试验流程操作,按确定的色谱方法进样,记录峰面积,结果显示:丙醛、丙酮、乙腈、乙酸乙酯、正庚烷和吡啶峰面积RSD分别为0.83%、0.36%、1.29%、0.41%、1.92%和0.54%,表明色谱系统精密度良好。
2.5 重复性
精密量取“1.7”项下限量100%的供试品加标溶液,按上述色谱方法进样,以峰面积为指标,考察该方法的进样精密度,结果丙醛、丙酮、乙腈、乙酸乙酯、正庚烷和吡啶的RSD分别为1.29%、0.50%、0.71%、0.41%、3.32%和0.69%,表明系统重复性良好。
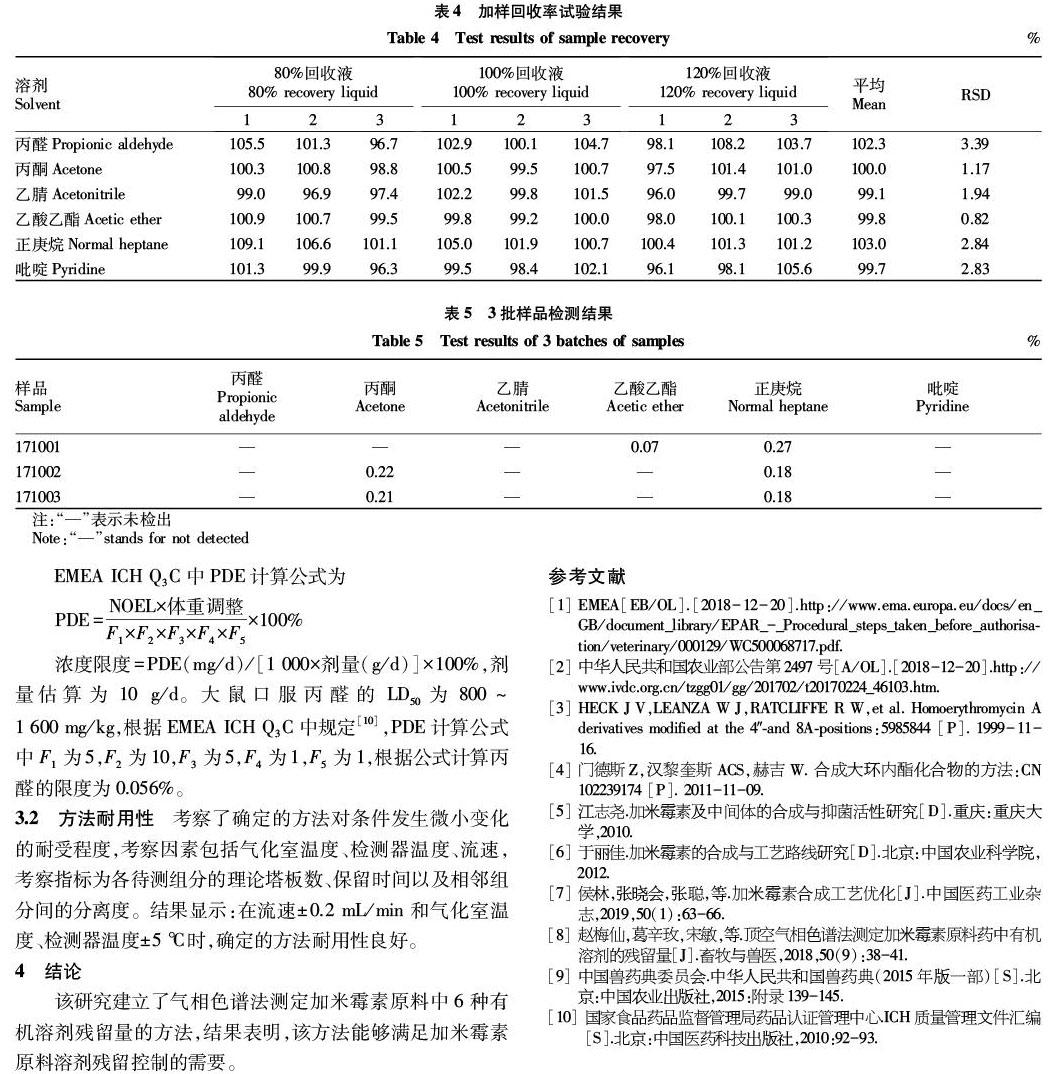
2.6 加样回收率 回收率试验结果见表4。由表4可知,丙醛、丙酮、乙腈、乙酸乙酯、正庚烷和吡啶的RSD分别为3.39%、1.17%、1.94%、0.82%、2.84%和2.83%。
2.7 样品测定 按
照上述方法对中试样品(批号171001、171002、171003)进行残留溶剂测定,结果见表5。
3 讨论
3.1 丙醛残留溶剂限度的确定
丙醛未在2015年版《中华人民共和国兽药典》一部附录所列的常见溶剂中出现,但是在加米霉素合成过程中作为反应原料使用,必须对其残留量进行控制。参考文献,根据半数致死量计算NOEL,根据NOEL计算PDE值,进而计算限度。
EMEA清洁验证指导原则中NOEL计算公式为
NOEL=LD50×702 000
EMEA ICH Q3C中PDE计算公式为
PDE=NOEL×体重调整F1×F2×F3×F4×F5×100%
浓度限度=PDE(mg/d)/[1 000×剂量(g/d)]×100%,剂量估算为10 g/d。大鼠口服丙醛的LD50为800~1 600 mg/kg,根据EMEA ICH Q3C中规定[10],PDE计算公式中F1为5,F2为10,F3为5,F4为1,F5为1,根据公式计算丙醛的限度为0.056%。
3.2 方法耐用性
考察了确定的方法对条件发生微小变化的耐受程度,考察因素包括气化室温度、检测器温度、流速,考察指标为各待测组分的理论塔板数、保留时间以及相邻组分间的分离度。结果显示:在流速±0.2 mL/min和气化室温度、检测器温度±5 ℃时,确定的方法耐用性良好。
4 结论
该研究建立了气相色谱法测定加米霉素原料中6种有机溶剂残留量的方法,结果表明,该方法能够满足加米霉素原料溶剂残留控制的需要。
参考文献
[1]EMEA[EB/OL].[2018-12-20].http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Procedural_steps_taken_before_authorisation/veterinary/000129/WC500068717.pdf.
[2] 中华人民共和国农业部公告第2497号[A/OL].[2018-12-20].http://www.ivdc.org.cn/tzgg01/gg/201702/t20170224_46103.htm.
[3] HECK J V,LEANZA W J,RATCLIFFE R W,et al. Homoerythromycin A derivatives modified at the 4″and 8Apositions:5985844 [P]. 1999-11-16.
[4] 门德斯Z,汉黎奎斯ACS,赫吉W. 合成大环内酯化合物的方法:CN 102239174 [P]. 2011-11-09.
[5] 江志尧.加米霉素及中间体的合成与抑菌活性研究[D].重庆:重庆大学,2010.
[6] 于丽佳.加米霉素的合成与工艺路线研究[D].北京:中国农业科学院,2012.
[7] 侯林,张晓会,张聪,等.加米霉素合成工艺优化[J].中国医药工业杂志,2019,50(1):63-66.
[8] 赵梅仙,葛辛玫,宋敏,等.顶空气相色谱法测定加米霉素原料药中有机溶剂的残留量[J].畜牧与兽医,2018,50(9):38-41.
[9] 中国兽药典委员会.中华人民共和国兽药典(2015年版一部)[S].北京:中国农业出版社,2015:附录139-145.
[10] 国家食品药品监督管理局药品认证管理中心.ICH质量管理文件汇编[S].北京:中国医药科技出版社,2010:92-93.

