一份特有红花甜荞活性物质的抗氧化特性研究
侯泽豪,孙坤坤,魏淑东,王书平,张迎新,尹军良,刘志雄,方正武
(1. 长江大学 农学院/主要粮食作物产业化湖北省协同创新中心,湖北荆州 434025;2. 长江大学 生命科学学院,湖北荆州 434025;3 长江大学 园艺园林学院,湖北荆州 434025)
荞麦,属蓼科(Polygonaceae)荞麦属,是一种重要的杂粮作物,分为甜荞(FagopyrumesculentumMoench)和苦荞(FagopyrumtaraicumGaerth)2个栽培品种,甜荞为异花授粉作物,结实率较低,在亚洲、欧洲和美洲均有大量种植[1],而苦荞为自花授粉作物,主要栽培于中国,在多数西方国家被认为是野生植物[2]。荞麦中富含多种药用和营养保健成分,如膳食纤维、维生素、矿物质和多酚类物质等多种生物活性物质,具有降血压、抗氧化和降低毛细管脆性等多种药理作用,是重要的药食两用作物[3]。研究表明多酚类物质是食物具有抗氧化能力和抑制慢性疾病的主要原因之一[4],而目前常使用化学抗氧化性的方法(如DPPH法、FRAP法、ORAC法和ABTS法)研究多酚类物质的抗氧化能力[4-6]。如Min等[7]利用DPPH法和ORAC法来评价具有不同麸皮颜色的大米的抗氧化能力,研究结果表明多酚物质的含量与抗氧化能力具有高度正相关。荞麦因具有丰富的多酚类物质,因此,在食品工业上,荞麦的籽粒、叶片和花可制成荞麦茶或保健产品等,并起到降低血液中的胆固醇和葡萄糖水平的作用[8]。
作物植株颜色是一种重要的经济性状,鲜艳的颜色不仅能改善产品的色泽,而且能激发消费者的购买欲和食欲。花青素作为植物呈色中的一类重要色素,可使植物呈现粉红色到蓝紫色[9-10],同时也是目前发现的最有效的天然水溶性自由基清除剂[11]。由于花青素的抗氧化能力及其在预防人类慢性疾病、控制肥胖和减轻糖尿病中的重要作用,因此,色彩鲜艳的天然食物受到国内外消费者的广泛推崇[12-13]。
Suzuki等[14]通过反相液相色谱-电喷雾电离-串联质谱技术对红花荞麦品种‘Gan-Chao’花瓣中的花青素质量分数和种类进行分析,结果表明红花荞麦花瓣中花青素种类以矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷为主,而白花荞麦花瓣中并未检测到花青素的存在;Kim等[15]的研究发现‘Gan-Chao’花瓣中的花青素质量分数最高可达0.19 mg/g,但其叶片中仅含有微量的花青素。长江大学小麦与荞麦种质创新课题组(以下称本课题组)在前期的研究中,从中国贵州毕节地区收集到一份甜荞农家品种(命名为‘HHTQ’)[16],其子叶、叶片、叶柄和花序在田间生长发育时均表现为深红色(图1-A),是一份特有的农家红花荞麦品种。
为了明确‘HHTQ’中活性物质的分布和抗氧化特性,本试验采用高效液相色谱法对该材料的子叶、叶片、叶柄及花序的花青素质量分数进行测定,同时利用分光光度法测定其总酚和总黄酮质量分数,并分析FRAP抗氧化能力,DPPH·清除能力和ABTS+·清除能力,为进一步开发利用‘HHTQ’荞麦资源提供理论依据。
1 材料与方法
1.1 试验材料
供试红花甜荞品种是本课题组于2009年从贵州毕节地区(105°36′E,26°21′N)征集所得,经 8 a选育,现命名为‘HHTQ’,并于长江大学农学院实验基地(112°15′E,30°36′N)进行繁育。于2018年9月播种,待种子发芽出土,子叶完成展开后,对生长健壮且无病虫害的植株进行子叶取样;待植株生长50 d左右至盛花期,对叶柄、叶片和花序进行取样,各样品利用真空冷冻干燥机冷冻干燥后研磨成冻干粉,-20 ℃保存,备用。
1.2 仪器与试剂
UV-8000型紫外可见分光光度计(上海元析仪器有限公司);Agilent1260高效液相色谱仪—Agilent 1260 series VWD 检测器(美国Agilent 公司);EYELA N-1200B 旋转蒸发仪(东京理化器械株式会社);真空冷冻干燥机(上海博医康实验仪器有限公司);5810R 高速冷冻离心机(德国Eppendorf公司)。
奎诺二甲基丙烯酸酯(Trolox)、没食子酸(Gallic acid)、芦丁(Rutin)、Folin酚试剂均购自美国Sigma公司;矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷购自北京索莱宝科技有限公司;色谱纯甲醇、甲酸均购自上海麦克林生化科技有限公司;其他试剂为国产分析纯。
1.3 试验方法
1.3.1 花青素的提取及高效液相色谱分析 花青素的提取参考Chu等[17]的方法略加改动,准确称取100 mg冻干样品,置于15 mL 离心管中,加入5 mL含φ=1% HCl的甲醇提取液,于4 ℃下避光震荡24 h。样品经4 ℃,4 500 g离心10 min后,取500 μL上清液于新的1.5 mL离心管中,加入500 μL去离子和300 μL氯仿,充分混匀去除叶绿素,4 ℃ 13 500 g离心15 min,转移上清液于新的1.5 mL离心管中,经0.22 μm滤膜(索来宝,北京)过滤后,-20 ℃保存,备用,每个样品做3个生物学重复。
采用Agilent1260高效液相色谱仪对花青素提取液进行定量分析。色谱条件为:色谱柱Inertsil ODS-3(250 mm × 4.6 mm,5 μm)C18色谱柱(岛津,日本),进样量20 μL,流速1 mL/min,检测波长520 nm,柱温25 ℃,流动相甲醇(A)-5%乙酸水溶液(B),梯度洗脱0~2 min,10% A;2~6 min,10%~20% A;6~10 min,20%~30% A;10~15 min,30%~35% A;15~20 min,35%~50% A;20~24 min,50%~90% A;24~29 min,90%~10% A;29~30 min,10% A。以标准品矢车菊素-3-O-葡萄糖苷(y= 21.513x-2.143 1,R2=0.998 8,测定范围:5~50 μg/mL)和矢车菊素-3-O-芸香糖苷(y= 34.401x- 29.958,R2=0.998 3,测定范围:5~75 μg/mL)建立标准曲线进行定量测定,其中y为峰面积,x为标准品质量浓度(μg/mL),最终结果以每1 g样品干质量中所含花青素(mg/g)表示。
1.3.2 荞麦各组织游离酚物质的提取 参照Min等[7]的方法并稍有改进,准确称取100 mg样品冻干粉,置于10 mL离心管中,加入8 mL正己烷,上下颠倒混匀后静置10 min,4 ℃,4 500 g离心10 min,弃上清,重复3次。向沉淀中加入8 mL含φ=1% HCl的甲醇提取液,每10 min上下颠倒1次,30 min后4 ℃ 4 500 g离心10 min,收集上清液,重复3次,合并上清液,37 ℃旋转蒸发浓缩,用含φ=1% HCl的甲醇提取液复溶并定容至15 mL,每个样品做3个生物学重复。
1.3.3 总酚和总黄酮质量分数的测定 采用Folin酚法[18]测定样品中的总酚质量分数,总酚质量分数以干基每1 g样品干质量中所含没食子酸量(mg/g)表示;采用亚硝酸钠-硝酸铝-氢氧化钠法[19]测定总黄酮质量分数,总黄酮质量分数以干基每1 g样品中所含芦丁量(mg/g)表示。
1.3.4 FRAP抗氧化能力、DPPH·和 ABTS+·清除能力测定 参考Benzie 和 Strain的方法[20]测定游离酚提取液的FRAP抗氧化能力,以奎诺二甲基丙烯酸酯(Trolox)作为标准品绘制标准曲线,得回归方程y=0.005 3x-0.080 7 (R2=0.998 3),其中y为吸光度,x为Trolox质量浓度(μg/mL)。结果以干基每1 g样品中的质量分数(mg/g)表示。
参考Chen和Ho的方法[21]测定游离酚提取液的DPPH·清除能力,以Trolox当量为标准品绘制标准曲线,得回归方程y= -0.002 7x+ 0.512 9(R2=0.995 1),其中y为吸光度,x为Trolox质量浓度(μg/mL)。结果以干基每1 g样品中的质量分数(mg/g)表示。
参考Re等[22]的方法测定游离酚提取液的ABTS+·清除能力,以Trolox当量为标准品绘制标准曲线,得回归方程y=-0.00 3x+ 0.800 8(R2= 0.997 4),其中y为吸光度,x为Trolox质量浓度(μg/mL)。结果以干基每1 g样品中的质量分数(mg/g)表示。
1.4 数理统计
利用Excel 2013和SPSS 19.0 软件进行数据统计和分析,数据以平均值 ± 标准差(Means ± SD)表示,采用单因素方差分析,不同组织间比较采用Duncan’s法,显著水平为0.05,利用Origin 2017进行绘图。
2 结果与分析
2.1 红花甜荞‘HHTQ’的表型性状
由图1-A可以看出,‘HHTQ’荞麦材料表现出鲜艳的色彩,其叶片边缘、叶脉以及叶柄呈紫红色。同时在整个花期,其花序均呈现出鲜艳的红色,可能富含花青素,具有一定的观赏价值和潜在应用价值。
2.2 红花甜荞‘HHTQ’不同部位的花青素质量分数
利用HPLC对红花甜荞‘HHTQ’不同部位花青素提取液进行定量测定(图1-B和表1),发现4个部位的花青素积累差异较大。花序和叶柄中积累的花青素质量分数最高,显著高于叶片和子叶(P<0.05)。花序和叶柄积累的花青素总质量分数无显著差异,分别为3.43 mg/g和3.28 mg/g,但具有不同的花青素单体积累模式,花序中以积累矢车菊素-3-O-芸香糖苷为主,质量分数达2.90 mg/g,占总质量分数的84.55%;而叶柄中则积累大量的矢车菊素-3-O-葡萄糖苷,其质量分数达 3.02 mg/g,占花青素总质量分数的 92.07%。子叶的花青素积累模式与叶柄相似,以矢车菊素-3-O-葡萄糖苷为主(0.96 mg/g,占总质量分数的 72.73%),而叶片则表现为等量积累。

A.红花甜荞‘HHTQ’不同部位的表型性状 Phenotypes of the four plant parts of the red-flowers buckwheat variety of ‘HHTQ’; B.花序、叶柄、叶片和子叶花青素提取液的高效液相色谱分析 HPLC profiles of anthocyanins extracted from the cotyledons, blades, petioles and inflorescences of the red-flowers buckwheat variety of‘HHTQ’

图1 红花甜荞‘HHTQ’不同部位的花青素成分分析Fig.1 Anthocyanin composition analysis of different parts of red-flowers buckwheat variety ‘HHTQ’
注:同列中不同小写字母表示组织间差异达显著水平(P<0.05),下同。
Note:In the same columns,the different lowcase letters means significant difference (P<0.05),the same below.
2.3 红花甜荞‘HHTQ’不同部位总酚和总黄酮质量分数
由表2可知,红花甜荞‘HHTQ’总酚和总黄酮在4个不同部位中的积累量存在显著差异(P<0.05),且总酚和总黄酮的积累模式在4个部位具有一致性,以花序中最高(总酚质量分数为225.47 mg/g,总黄酮质量分数为128.96 mg/g),叶柄中最低(总酚质量分数为26.59 mg/g,总黄酮质量分数为16.28 mg/g)。4个部位的总酚和总黄酮质量分数大小顺序均为:花序>叶片>子叶>叶柄。
2.4 红花甜荞‘HHTQ’不同部位抗氧化能力
‘HHTQ’荞麦4个不同部位的抗氧化能力如图2所示。4个不同部位的DPPH·清除能力的变幅为47.52~174.51 mg/g。各部位的 DPPH·清除能力差异较大,以花序的清除能力最强,为174.51 mg/g;其清除能力大小顺序为:花序>叶片>子叶>叶柄。FRAP抗氧化能力与DPPH·清除能力趋势一致,以花序最高,为 152.55 mg/g;叶片次之,为37.56 mg/g;以叶柄最低,为17.16 mg/g。在ABTS+·清除能力方面,花序的抗氧化能力显著高于其他部位(P< 0.05),为112.31 mg/g;叶柄,叶片和子叶的ABTS+·清除能力无差异,ABTS+·清除能力变幅为 8.63~12.05 mg/g。
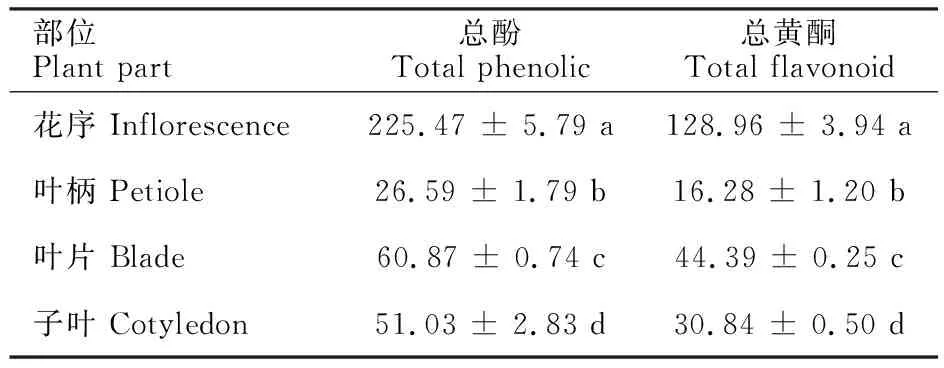
表2 红花甜荞‘HHTQ’不同部位总酚和总黄酮质量分数Table 2 Total phenols and total flavonoids in different parts of red-flower buckwheat variety of ‘HHTQ’ mg/g
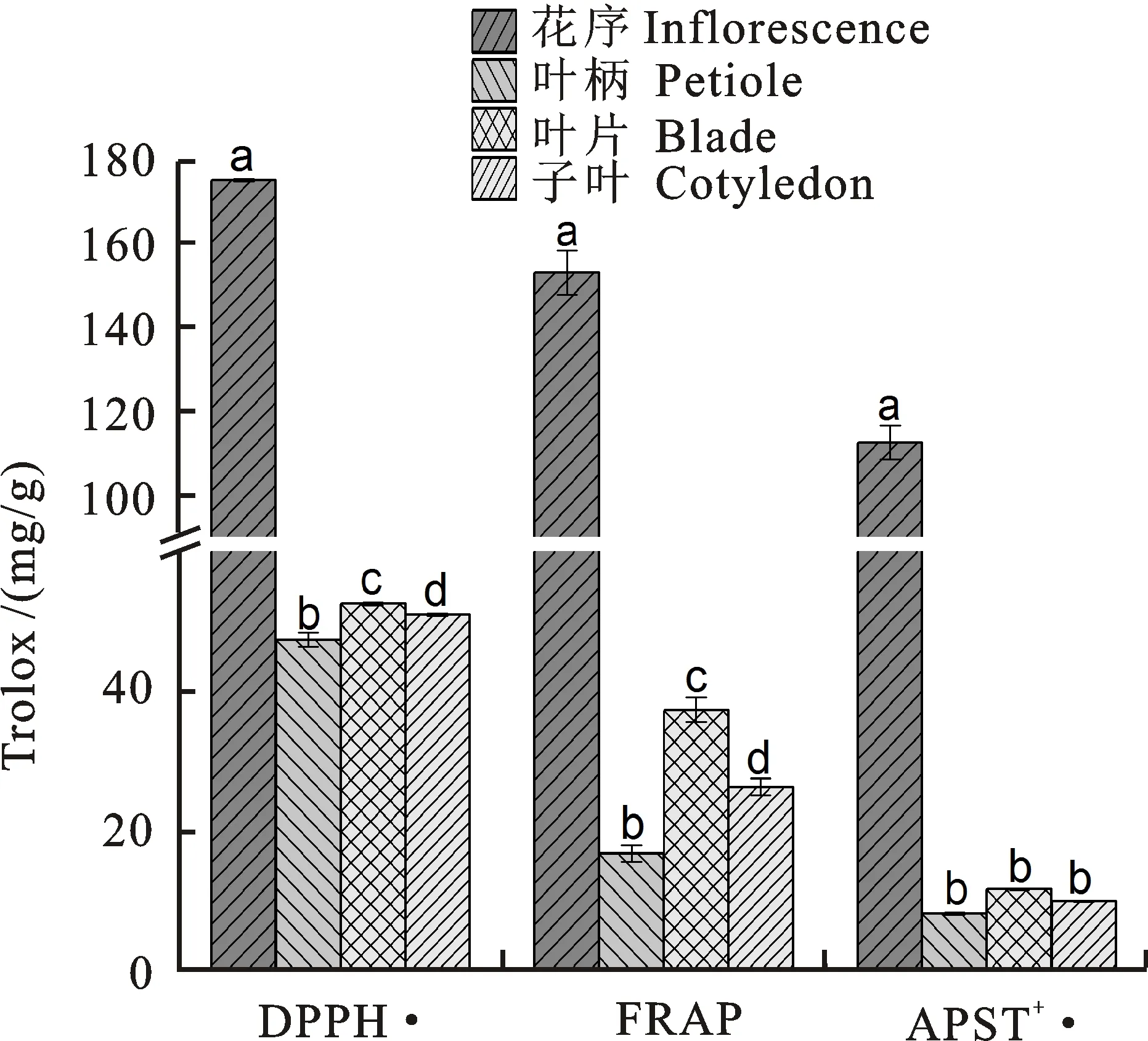
不同字母表示差异显著(P<0.05) Different letters mean significantly differences(P<0.05).
图2 红花甜荞‘HHTQ’不同部位抗氧化能力
Fig.2 Antioxidant abilities of different parts of red-flower buckwheat variety of ‘HHTQ’
2.5 红花甜荞‘HHTQ’多酚类物质质量分数与抗氧化能力的相关性分析
总酚、总黄酮和总花青素与抗氧化能力的相关系数如表3所示。总酚和总黄酮质量分数与DPPH·清除能力、FRAP抗氧化能力以及ABTS+·清除能力的相关性较大,相关系数在0.980以上。与总酚与总黄酮质量分数相比,总花青素与3个抗氧化能力指标的相关系数较低,分别为0.594(DPPH·清除能力)、0.530(FRAP抗氧化能力)和0.601(ABTS+·清除能力)。这些结果表明花青素作为一类酚类化合物,在植物抗氧化能力上发挥了一定的作用。
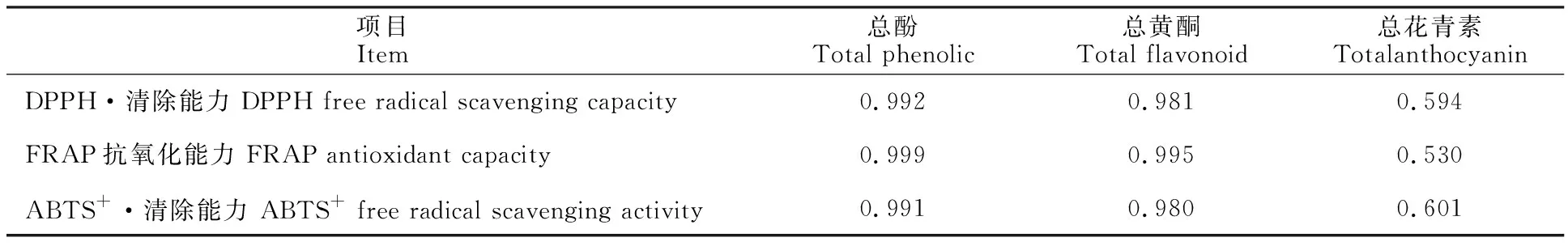
表3 总酚、总黄酮和总花青素质量分数与抗氧化能力的相关系数Table 3 Correlation coefficients of total phenols, total flavonoids and total anthocyanins with the antioxidant capacities
3 讨 论
3.1 荞麦中花青素的积累
前人的研究发现红花甜荞‘Gan-Chao’花瓣中的花青素质量分数随发育时期的变化而增加[14-15],最高可达0.19 mg/g,但其叶片中仅含有微量的花青素[15]。本研究利用HPLC对红花甜荞‘HHTQ’的花青素质量分数进行测定,发现该甜荞品种在子叶、叶片、叶柄和花序中均积累了大量的花青素,花序中积累的花青素总质量分数达到3.43 mg/g,子叶和叶片中的花青素总质量分数分别达到1.32 mg/g和1.44 mg/g,显著高于‘Gan-Chao’。Kim等[15]利用荧光定量PCR技术分析发现与花青素合成相关的结构基因(如FePAL、FeCHS、FeDFR和FeANS等)在红花荞麦‘Gan-Chao’中表现出较高的表达量。周天山等[23]的研究发现紫芽茶树中富含花青素,与绿芽茶树相比,紫色芽叶片的花青素相关基因(如CsDFR、CsANS和 CsF3′H等)呈上调趋势,而本课题在前期对红花品种‘HHTQ’的转录组测序分析中同样发现,‘HHTQ’的子叶和花序中与花青素合成相关的结构基因(如FeCHS、 FeF3′H和FeDFR)表现出较高的表达量[16],但其内在分子机理仍待研究,进一步探索花青素的积累机制对于培育和应用富含花青素的荞麦品种具有潜在价值。
3.2 荞麦中的总酚和总黄酮质量分数
多酚是广泛存在于植物组织中的一类具有生物活性的次级代谢产物[24],黄酮类物质(如芦丁、表儿茶素等)是荞麦多酚类物质的重要组成成分[25],因具有抗癌和抗氧化等多种作用而被广泛应用于抗癌以及预防冠心病等心脑疾病的药物当中[26]。由于荞麦中富含多种维生素,必需氨基酸和多酚等功能活性物质,因此荞麦作为一种营养保健的粗粮而深受喜爱[27]。本次研究对荞麦不同部位的总酚质量分数进行测定,发现4个不同部位的总酚质量分数存在显著差异(P<0.05),以花序中的总酚质量分数最高,为225.47 mg/g,且其总黄酮积累模式与总酚一致,以花序最高,为128.96 mg/g。总酚和总黄酮质量分数高低顺序均为:花序>叶片>子叶>叶柄。这一研究结果与Zielinska等[28]的研究发现荞麦不同部位的总黄酮化合物积累量差异较大(花朵>叶片>茎)的结果相似。
3.3 荞麦多酚类物质的抗氧化能力
前人的研究结果表明,荞麦籽粒的抗氧化能力与总黄酮/芦丁的含量成正相关,黄酮类物质的积累量越高,其抗氧化能力最强[28-29]。本研究发现荞麦4个不同部位的抗氧化能力存在显著差异,以花序最高,叶柄最低,且总酚和总黄酮质量分数与DPPH·清除能力、FRAP抗氧化能力以及ABTS+·清除能力的相关系数均在0.98以上,但花青素质量分数与抗氧化能力的相关系数仅为0.530~0.601。前人在紫薯的研究中发现,不能单独利用花青素质量分数解释抗氧化能力的强弱,而是由多种生物活性物质(如酚类化合物、维生素C和胡萝卜素等)综合决定[30-32],在本次研究中,发现叶柄中虽积累大量的花青素,但其总酚和总黄酮的质量分数最低,从而导致其抗氧化能力显著低于含有较高总酚和总黄酮质量分数的叶片和子叶。因此,全面准确地分析荞麦不同部位抗氧化能力对指导其开发利用具有重要价值。
4 结 论
该红花甜荞品种‘HHTQ’具有鲜红的表型性状,且其花序、叶柄、叶片和子叶中花青素、总酚、总黄酮质量分数及其体外抗氧化能力差异较大,该品种的花青素类型以矢车菊素-3-O-葡萄糖苷和矢车菊素-3-O-芸香糖苷2种为主,且花青素单体的积累具有组织特异性,花序中矢车菊素-3-O-芸香糖苷质量分数、总酚和总黄酮质量分数显著高于其他部位,同时抗氧化能力最强。叶片和子叶中均积累了一定量的多酚类物质,具有较强的抗氧化能力。鉴于该品种具有丰富的酚类物质和较强的抗氧化活性,可以将其作为荞麦茶新产品和天然抗氧化剂资源进行开发利用。

