一个玉米叶夹角突变体的表型鉴定及遗传分析
王晓娟,何海军,刘忠祥,杨彦忠,寇思荣,连晓荣,周玉乾,周文期
(甘肃省农业科学院 作物研究所,兰州 730070)
叶夹角,定义为叶片中脉与茎之间的倾角,是影响光截留、光合效率和种植密度的最重要的冠层结构参数之一。玉米叶夹角与产量的关系也早有报道,与1930年至1960年代的历史材料相比[1],直立叶片与大的叶面积指数的结合使现代玉米杂交种在光能捕获能力上提高14%。这种增加的光捕获能力以超过20%的增产效果体现出来[2]。其他研究也报道了叶夹角对籽粒产量直接影响的相似结果,如早在20世纪90年代释放的品种中,随着叶夹角从60°到30°的降低,产量提高了15%~30%[3]。这些研究为叶夹角的改善对于增加光捕获以及增产效应提供了丰富的试验证据。与此同时,前人对叶夹角的遗传规律做了比较深入的研究,对叶夹角的自然变异的研究报道有很多[4-5],这些研究表明,叶夹角是受到多个基因或者多个位点共同调控的一个复杂数量性状,认为加性基因效应最为重要,同时也受非加性基因效应影响[6-7]。因此,叶夹角性状的遗传分析对叶夹角的遗传基础、形成机制以及育种材料的遗传改良都具有重要意义。
BSA (Bulked segregant analysis)是寻找与目标QTL/基因连锁标记的一种简单快速的方法[8]。随着标记种类和密度的增多以及NGS(Next-generation sequencing)技术的发展, BSA策略被广泛的应用于主效QTL/基因的定位[9-10]。目前,该技术在拟南芥、水稻、大豆、小麦、玉米、高粱、向日葵等多种植物中的应用都有大量报道,并且鉴定到了很多重要性状的QTL/基因[11-16]。甘肃省农业科学院作物研究所玉米研究室前期工作中,发现了一个以自交系‘LY8405’为背景叶夹角显著减小的突变体材料,并命名为‘FU1603’。本研究中将‘FU1603’和玉米自交系‘B73’(参考基因组测序系)进行杂交,构建了F2群体,根据群体表型分离,经卡方检验确定该突变为单个核基因控制的隐性突变;进一步利用BSA的方法将该位点定位于玉米第1号染色体的 1.02 bin上大约9 Mb的物理区间内。该位点是一个新的控制玉米叶夹角的基因位点,为后续该突变基因的精细定位和克隆奠定了良好的工作基础。
1 材料与方法
1.1 试验材料
玉米自交系‘B73’和‘LY8405’,突变体材料‘FU1603’,以及‘B73’和‘FU1603’为亲本构建的F2分离群体。
1.2 田间试验
将‘LY8405’‘FU1603’‘LY8405×FU1603’F1、‘B73×FU1603’F1,以及F1自交产生的F2分离群体分别于2017年春种植在甘肃省张掖市试验基地以及2017年冬种植在海南省三亚市荔枝沟试验基地,行长5 m,宽0.6 m,每行种植20株。
1.3 农艺性状观察分析
在开花散粉高峰期对‘LY8405’和‘FU1603’各个农艺性状进行观察,包括:株型(株高、穗位高、叶片数、节间数、穗三叶以及倒三叶叶夹角)、穗部性状(雄穗长、雄穗分枝数、雌穗长、雌穗粗、穗行数、轴粗)、籽粒(粒长、粒宽、百粒质量)等,采用t-test检验差异显著性。
1.4 突变体遗传分析
通过‘LY8405×FU1603’F1植株表型分析以及‘LY8405×FU1603’F2和‘B73×FU1603’F2分离群体中野生型及突变体植株数目统计分析,结合卡方测验来判断该突变体的遗传模式。
1.5 突变位点的初定位
利用BSA的方法对叶夹角突变基因进行初定位。首先,将‘FU1603’与‘B73’进行杂交,产生F1,并将F1进行自交,构建F2分离群体。F2分离群体中突变体鉴定的主要依据叶夹角、卷曲程度等性状的整体表现,叶夹角较小、叶片较小且出现卷曲的为突变体,反之为野生型。从田间选取15株突变体表型植株,提取DNA等量混合,构建一个“突变体池”;同时,另外选取15株表型正常的植株,提取DNA等量混合,构建一个“野生型池”。利用甘肃省农业科学院作物研究所玉米研究室已经合成的均匀覆盖玉米基因组的 1 000对SSR引物,对2个DNA池进行扩增,毛细管电泳对PCR产物进行检测,筛选多态性的标记,即与突变基因紧密连锁的标记。然后利用160株左右的F2分离群体对多态性标记进行共分离验证,并准确定位突变基因所在的区间。
1.6 统计分析
采用Microsoft Excel 2013 软件对数据进行整理、统计分析及作图。
2 结果与分析
2.1 玉米叶夹角突变体‘FU1603’田间表型调查分析
‘FU1603’来源于自交系‘LY8405’的一个自然突变,该突变体表现为叶夹角减小、且叶片卷曲皱缩等表型(图1-A)。通过自交繁殖,自交后代也表现出与上一代同样稳定的表型特征,说明该位点已经纯合并且能够稳定遗传。通过田间植株观察发现,突变体在5叶期以后开始出现叶片皱缩卷曲的表型,之后叶片卷曲皱缩表型越来越明显,与‘LY8405’叶片的表型差异显著;通过对穗三叶以及倒三叶的叶夹角进行考察,结果显示,与野生型‘LY8405’相比,突变体‘FU1603’的穗位叶、穗下叶以及穗上叶的叶夹角显著变小(图1-A和图1-B),而倒三叶的叶夹角在2个材料中差异不显著(图1-C,表1)。
2.2 玉米叶夹角突变体‘FU1603’和野生型‘LY8405’农艺性状比较分析
在成株期,与‘LY8405’相比,‘FU1603’的株高和穗位高显著降低(P<0.05),其中株高降低约15 cm,穗位高降低约6 cm(图1-A和图1-B,表1)。然而,节间数在2个材料间却没有显著差异(P>0.05)。此外,与‘LY8405’相比,‘FU1603’雄穗长、雄穗分枝数、雌穗长、穗粗、穗行数以及轴粗等性状显著降低(P<0.05),因此‘FU1603’雌雄生殖器官都显著减小。籽粒相关性状分析结果显示,尽管百粒质量不存在显著差异,但粒长与粒宽都存在显著差异,与‘LY8405’相比,‘FU1603’粒长显著降低,粒宽显著增加。综上所述,与‘LY8405’相比, ‘FU1603’突变体的株型、穗部性状以及籽粒等多个农艺性状值均发生了显著的改变。
2.3 玉米叶夹角突变体‘FU1603’的遗传模式分析
‘LY8405×FU1603’F1和‘B73×FU1603’F1单株的叶夹角以及叶片相关性状均与野生型‘LY8405’相同,没有任何差异,因此‘FU1603’为一个隐性突变;将F1自交,获得F2分离群体,通过卡方检验发现野生型植株与突变体植株的分离比例符合3∶1(表2),表明该突变体是受单个核隐性基因控制的。
A.散粉期的‘LY8405’及‘FU1603’ The plants of ‘LY8405’ and ‘FU1603’ during reproductive development stage;B.营养生长中的‘LY8405’及‘FU1603’ Performance of ‘LY8405’ and ‘FU1603’ during the vegetative growth stage in the field;C.‘LY8405’及‘FU1603’叶夹角统计分析(t-test) Statistical analysis of leaf angle between ‘LY8405’ and ‘FU1603’ by t-test;“***”代表P< 0.001,NS代表P>0.05 “***” indicatesP<0.001,NS indicatesP>0.05
图1 叶夹角突变体‘FU1603’以及野生型‘LY8405’的表型
Fig.1 Phenotype of ‘FU1603’ and ‘LY8405’

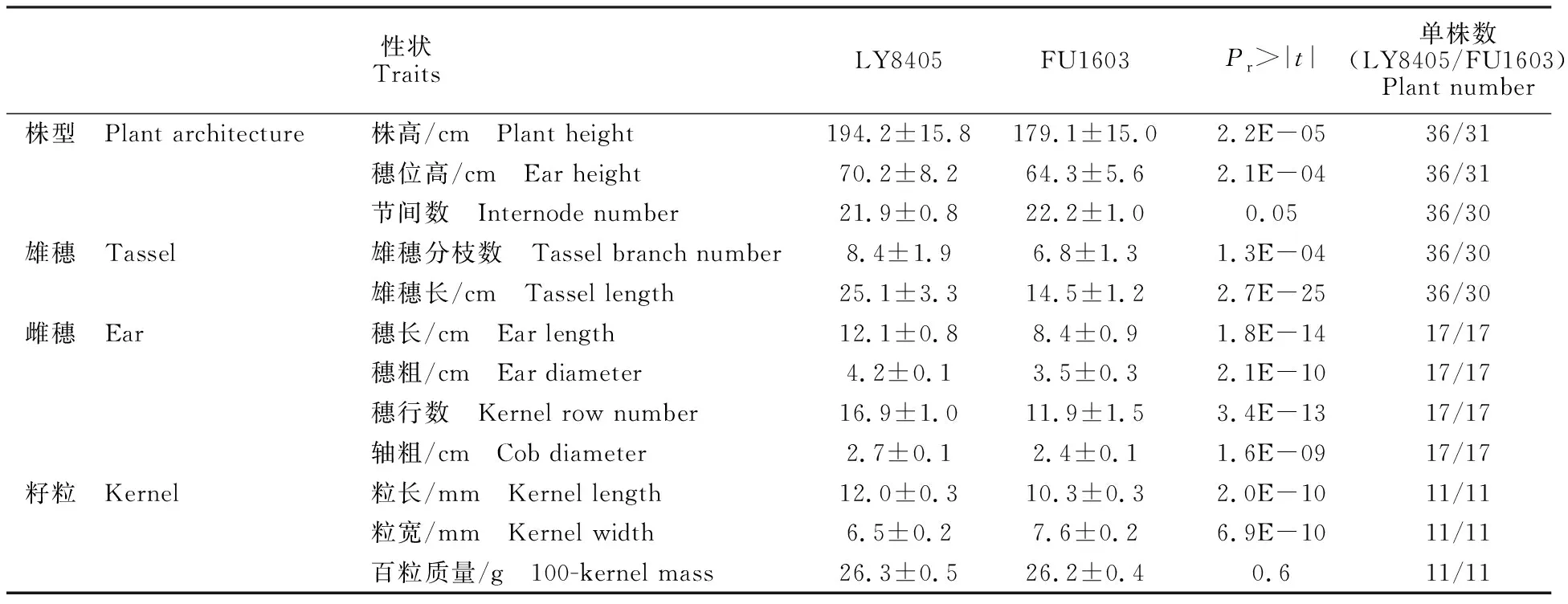
性状TraitsLY8405FU1603Pr>|t|单株数(LY8405/FU1603)Plant number株型 Plant architecture株高/cm Plant height194.2±15.8179.1±15.02.2E-0536/31穗位高/cm Ear height70.2±8.264.3±5.62.1E-0436/31节间数 Internode number21.9±0.822.2±1.00.0536/30雄穗 Tassel雄穗分枝数 Tassel branch number8.4±1.96.8±1.31.3E-0436/30雄穗长/cm Tassel length25.1±3.314.5±1.22.7E-2536/30雌穗 Ear穗长/cm Ear length12.1±0.88.4±0.91.8E-1417/17穗粗/cm Ear diameter4.2±0.13.5±0.32.1E-1017/17穗行数 Kernel row number16.9±1.011.9±1.53.4E-1317/17轴粗/cm Cob diameter2.7±0.12.4±0.11.6E-0917/17籽粒 Kernel粒长/mm Kernel length12.0±0.310.3±0.32.0E-1011/11粒宽/mm Kernel width6.5±0.27.6±0.26.9E-1011/11百粒质量/g 100-kernel mass26.3±0.526.2±0.40.611/11
注:Pr>|t|为双样本t测验的概率值。
Note:Pr>|t| is probability oft-test between two independent samples.
2.4 玉米叶夹角突变体‘FU1603’的突变位点初定位
利用F2群体中的极端单株构建的2个混合DNA池,采用BSA的方法对该突变位点进行初定位。通过均匀分布在玉米10条染色体的 1 000对SSR标记在“突变体”DNA池以及“野生型”DNA池中的多态性分析,最终筛选到了3对多态性的标记,即C1-2、C1-16和C1-18(图2);这3对标记都是在野生型池中有双带,而在突变体池中只存在单条带,因此这3对标记很可能与‘FU1603’突变位点紧密连锁,而且这3对标记都位于玉米第1号染色体1.02 bin上(表3),根据‘B73’ V4版本参考基因组显示,3个标记在染色体上的顺序依次为:C1-16、C1-18和C1-2,物理位置分别为:15061072、17966407和26885514 (表3)。

表2 玉米叶夹角在2个F2群体中分离比例的卡方测验Table 2 Chi-square test of segregation ratio of leaf angle in two F2 populations
用筛选到的与‘FU1603’突变位点连锁的3对SSR标记分析160个F2单株的基因型,并结合这些单株的表型,验证上述3对标记与突变位点是否真实连锁,结果显示,C1-16与表型的交换频率为0.11,C1-18与表型的交换频率为0.06,C-2与表型的交换频率为0.04(表3)。根据连锁标记与表型的交换频率,验证了BSA结果真实可靠,并且突变位点更加靠近于标记C1-2。进而根据交换单株的基因型信息,将‘FU1603’的突变位点定位于标记C1-18与C1-2之间约9 Mb的物理区间内(表4)。

W.野生型池 Wild-type bulk;M.突变体池 Mutant bulk
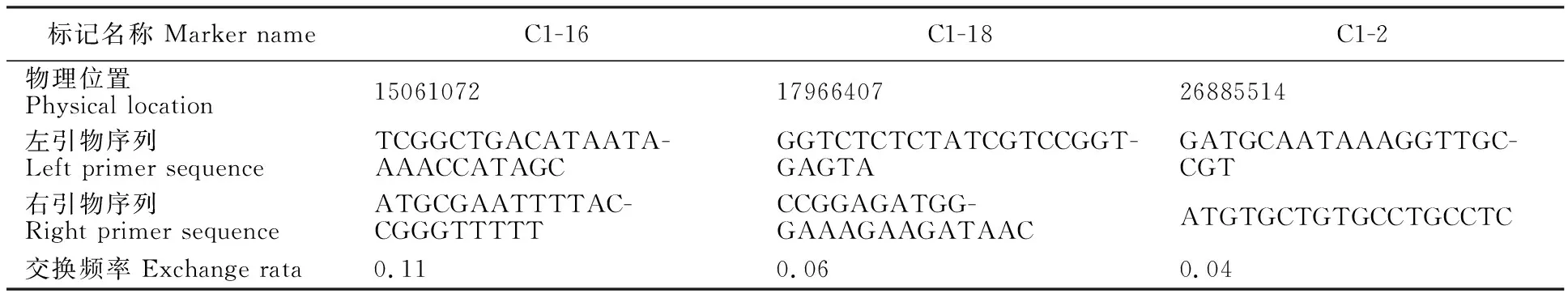
表3 连锁标记信息以及与突变位点的交换频率Table 3 The information and exchange frequency between linkage markers and mutation sites
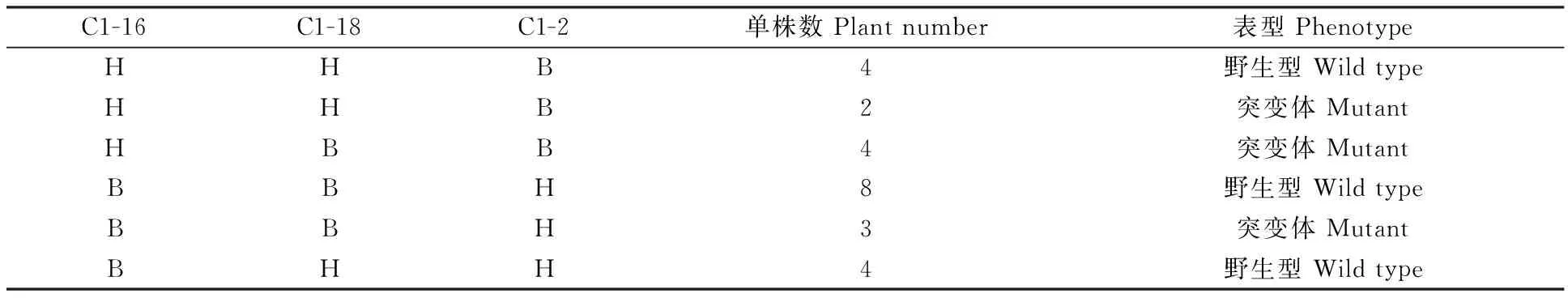
表4 重组单株基因型以及表型信息Table 4 The genotype and phenotype of the recombinant plants
注:B.突变体‘FU1603’的基因型;H.杂合基因型。
Note:B.genotype of ‘FU1603’; H.genotype of Heterozygous.
3 讨 论
叶夹角突变体的发掘与研究为玉米的株型育种以及高密度育种提供了重要的种质资源。叶夹角对产量存在两个方面的贡献,其一是对光的截获效率的提高,其二是种植密度的提高[17-18]。迄今为止,科研工作者利用玉米突变体材料已经克隆了一批叶夹角相关的基因,如,Strable等[19]发现了一种具有叶片结构变异的玉米突变体,并将其命名为drooping leaf1 (drl1),drl1突变影响叶长和宽度、叶角、节间长度和直径,是一个多效基因。Moreno等[20]对lg1突变体的研究发现,该突变体为lg1基因表达缺失突变体,该突变体表现为叶片直立、不能形成叶舌和叶耳,叶片和叶鞘的连接处不能正常发育。lg2编码一个亮氨酸拉链蛋白,该基因的突变导致叶夹角减小,叶耳叶舌缺失或者异常,叶片与叶鞘连接处弥散状[21]。lg1和lg2两个突变体密度与产量的试验研究阐明叶夹角和种植密度的关系:lg1基因型拥有几乎直立的叶片,在极端密度(151 000株/hm2)仍然具有较高的产量,lg2虽然没有极端小的叶夹角,但它拥有着比较大的光截获效率,因此具有最高的产量[22]。而本研究中所鉴定到一个新的叶夹角突变体‘FU1603’,其在穗三叶的叶夹角都显著减小,株型更加紧凑,具有耐密植的特性;同时籽粒产量性状分析结果表明,粒型虽然发生了改变,但百粒质量没有显著变化,即突变体与野生型相比,籽粒产量没有发生改变,但耐密植性显著改善,因此,‘FU1603’突变材料的发现,为玉米株型育种、密度育种及提高玉米产量都提供了很好的资源。
BSA是突变体快速定位及克隆定位的一个重要工具,利用分离群体野生型和突变体2个DNA池就能够找到突变位点的大概位置所在,简单快速,并且节约成本。Cai等[23]采用BSA的方法快速将一个控制玉米籽粒发育的突变体emp10定位到玉米1号染色体靠近末端的位置,并成功克隆了该基因。Zhang等[24]采用BSA的策略将控制玉米茎顶端组织发育的突变体gif1定位于1号染色体,并成功克隆了该基因。Han等[25]发现了一个玉米多性状突变体muw,并通过BSA的方法将该位点定位于玉米第2号染色体靠近着丝粒的位置,最终发现该位置存在着一个约5 Mb的大片段缺失。本研究中,同样采用了F2分离群体的野生型和突变体各15株,创建了2个DNA池,用1 000对SSR引物成功的筛选到了与之紧密连锁的标记,并进一步通过分离群体的共分离分析及交换重组单株的分析将一个新的控制叶夹角的基因定位于玉米第一染色体1.02 bin约9 Mb的物理区间内,本研究获得的结果为新的玉米叶夹角基因的精细定位和克隆奠定了良好的工作基础。

