表达持续活化型ALK3抑制大鼠肝星状细胞活化
石 慧,柳长柏,肖和杰
石慧,海南医学院第一附属医院消化内科 海南省海口市 570000
石慧,柳长柏,三峡大学肿瘤微环境与免疫治疗湖北省重点实验室 湖北省宜昌市 443000
石慧,柳长柏,肖和杰,三峡大学肝病研究所 湖北省宜昌市 443000
0 引言
在肝纤维化发生发展过程中由于慢性炎症刺激肝星状细胞(hepatic stellate cells,HSCs)被活化,由静止的储脂细胞转变成肌成纤维细胞(myofibroblast,MFB)并合成分泌大量纤维化相关因子和胶原蛋白[1].TGF-β1在肝纤维化病理发展过程中发挥着极其重要的作用,BMP-7是TGF-β超家族成员之一,许多研究表明BMP-7能够拮抗TGF-β的促纤维化作用,在肝纤维化进展过程中,BMP-7表达水平被逐渐下调[2].
ALK3属于BMPs的持续活化Ⅰ型受体,无需BMP-7与BMP-7Ⅱ受体结合,磷酸化细胞内相关信号蛋白Smad1/5/8,磷酸化Smad1/5/8进而结合Smad4转移至细胞核并诱导下游靶基因表达.本实验利用BMP-7Ⅰ型受体的持续性活化突变基因真核表达载体pcDNA3-HASL-ALK3(QD)转染大鼠HSCs株(HSC-T6),建立稳定高表达持续活化型BMP-7Ⅰ型受体ALK3细胞株.无需BMP-7刺激,持续活化型ALK3即可激活下游信号通路,探讨持续活化型ALK3对HSC-T6的影响,探讨活化BMP-7信号通路抗肝纤维化分子机制.
1 材料和方法
1.1 材料 大鼠HSCs、DH5α大肠杆菌为三峡大学肝病研究所保存;真核表达载体pcDNA3 -HASL-ALK3(QD)质粒由日本东京大学宫园浩平教授惠赠;限制性核酸内切酶、Taq DNA聚合酶、dNTP、RevertAidTM M-MuLV逆转录试剂盒购自美国Fermentas公司;DNA纯化试剂盒为QIAGEN公司产品;LipofectamineTM2000和Trizol试剂为美国Invitrogen公司产品;小鼠Samd1单克隆抗体、兔抗山羊P-Smad1多克隆抗体、山羊抗兔E-cadherin多克隆抗体、兔抗山羊col1A2多克隆抗体均为 Santa Cruz Biotechnology公司产品;小鼠α-SMA单克隆抗体为Sigma公司产品;辣根过氧化物酶标记兔抗山羊、山羊抗兔、羊抗小鼠IgG购自北京中杉金桥公司;ECL化学发光检测试剂为GE Healthcare公司产品,MTT及培养基DMEM购自美国Sigma公司;寡聚核苷酸引物由上海生工技术服务有限公司合成.
1.2 方法
1.2.1 细胞培养及传代:本实验所用的细胞株大鼠HSCsHSC-T6置于含10%小牛血清及1%青霉素/链霉素的培养液DMEM,37 ℃ 5% CO2培养箱中培养.细胞传代方法:弃去旧的培养液,用3 mL PBS洗2次后,每瓶500 μL1%胰蛋白酶消化细胞1 min;用3 mL细胞完全培养液终止消化并将细胞悬液转入15 mL离心管中,800 rpm离心3 min,弃上清液;细胞用培养液重悬后,以1:3的比例传代.
1.2.2 重组质粒鉴定:用重组质粒pcDNA3-HASL-ALK3转化E.coli DH5α感受态细胞,用含0.1 g/L氨苄青霉素的琼脂糖培养平板进行筛选,挑取阳性单克隆菌落扩增培养,提取质粒并用EcoRI/XhoI进行双酶切鉴定.酶切鉴定正确的质粒纯化后送上海生工生物工程有限公司测序.测序结果用DNAMAN与GenBank序列比对无误.
1.2.3 建立稳定高表达持续活化型ALK3受体的HSC-T6细胞株:大鼠HSC-T6在转染前1 d传代,长至细胞融合约80%,转染前1 h换为无血清无双抗的DMEM培养液孵育.应用LipofectamineTM2000试剂法用纯化的重组质粒pcDNA3-HASL-ALK3转染HSC-T6细胞,同时转染空载质粒pcDNA3.1作为对照.37 ℃ 5% CO2培养箱孵育4-6 h后更换为DMEM完全培养液培养,培养24 h后换为浓度800 μg/mL Neomycin的完全培养液进行筛选,2-3 d更换一次培养液,待细胞克隆形成后,挑取单克隆细胞进行扩大培养.
1.2.4 RT-PCR法筛选稳定表达持续活化型ALK3的HSC-T6细胞株:分别收集稳定转染重组质粒pcDNA3-HASL-ALK3及空载质粒pcDNA3.1的HSC-T6细胞,提取细胞总RNA,经DU730紫外分光光度仪检测在260 nm处的吸光度值,A260nm/A280nm比值均介于1.8-2.0之间,RNA琼脂糖凝胶电泳28 S、18 S和5 S条带清晰可见,表明抽提的RNA较完整,未见明显降解.提取的总RNA经逆转录合成cDNA第一链,并以合成的cDNA为模板进行PCR反应.col1A2上游引物:5'-TGGTCTTACTGGGA ACTTTG-3',下游引物:5'-CCGTTTGTCCGGGCTCAC CA-3';col3A1上游引物:5'-GTTCTGTAATATGGAAAC CGGAG-3',下游引物:5'-CAAGGACATCTTCAGGAA GATC-3',col4A2上游引物:5'-CTGGACCCAAAGGAC AACC-3',下游引物:5'-ACGGGTCCAGGGTCTCCT-3';E-cadherin上游引物:5'-CTCGTGGCTTTGTCAGCA-3',下游引物:5'-GACCCAGTCTCGTTTCTG-3',α-SMA上游引物:5'-GTGTGAAGAGGAAGACAG-3'下游引物:5'-TTGGCCTTAGGGTTCAGC-3',以GAPDH为内参照,上游引物:5'-TGGCACCCAGCACAATGAA-3',下游引物:5'-CTAAGTCATAGTCCGCCTAGAAGCA-3',PCR循环条件:94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环后,72 ℃ 5 min结束扩增.PCR产物于1%琼脂糖凝胶电泳鉴定并在凝胶扫描仪下观察记录结果.获得稳定高表达持续活化型ALK3的细胞株命名为CA-ALK3-T6,稳定转染空载体质粒细胞株命名为Vector-T6.
1.2.5 Western blotting法检测稳定表达持续活化型ALK3对HSC-T6细胞的影响:收集并裂解细胞提取总蛋白,用BCA试剂盒蛋白定量后进行SDS-PAGE分离蛋白,采用湿转法将蛋白质转移至PVDF膜上,1%脱脂奶粉封闭过夜后,分别用小鼠Samd1单克隆抗体(1:800稀释)、兔抗山羊P-Smad1多克隆抗体(1:800稀释)、山羊抗兔E-cadherin多克隆抗体(1:1000稀释)、兔抗山羊col1A2多克隆抗体(1:800稀释);小鼠α-SMA单克隆抗体(1:1000稀释)和小鼠抗大鼠β-actin单克隆抗体(1:4000稀释)孵育2 h,TBST洗膜10 min/次3次,再分别用辣根过氧化物酶(HRP)标记的山羊抗兔IgG(1:4000稀释),兔抗山羊IgG(1:8000稀释)和羊抗小鼠IgG(1:5000稀释)孵育1 h,TBST洗膜3次(10 min/次),采用ECL增强化学发光法检测结果.
1.2.6 MTT法检测稳定表达持续活化型ALK3对HSC-T6细胞株增殖的影响:以2×104个/ml的细胞密度,接种于96孔板中,100 μL/孔;待细胞完全贴壁后,加入MTT(200 μg/mL,无血清DMEM培养基配制),37 ℃继续孵育4 h,去除培养基后每孔加入150 μL的DMSO,室温摇床振荡充分溶解结晶,全自动酶标仪570 nm波长测定各孔吸光度(OD)值,并以此检测时间点为0 h.用同样的方法测定细胞培养24、48、72 h各时间点的OD值,以各时间点的OD值与0 h OD值的比值反映细胞增殖的速度.
统计学处理应用SPSS 13.0进行分析,数据以mean±SD表示,样本均数比较采用t检验,同一药物不同浓度组间采用单因素方差分析进行比较,P<0.05为差异有统计学意义.
2 结果
2.1 稳定表达持续活化型ALK3受体对HSC-T6细胞形态的影响 倒置相差显微镜下,对照组Vector-T6细胞呈单层生长,细胞间连接疏松,细胞伪足多呈星形,胞质薄而透明,核椭圆;而CA-ALK3-T6细胞连接紧密,细胞成多角形或蝌蚪形,胞质饱满,核圆大(图1).
2.2 稳定表达持续活化型ALK3受体对HSC-T6细胞生长增殖的影响 为观察稳定表达持续活化型ALK3受体后对HSC-T6细胞生长增殖的影响,我们采用MTT法检测了稳定表达持续活化型ALK3对HSC-T6细胞增殖的影响(图2).与0 h相比,当培养24 h CA-ALK3-T6细胞和Vector-T6细胞增殖倍数分别为1.5和2.6倍;当培养48 h,对Vector-T6细胞增殖倍数为4.3倍,而CA-ALK3-T6细胞为1.7倍(P<0.05);随着时间的延长,CA-ALK3-T6细胞增殖速度较对照细胞要慢(P<0.05).因此稳定表达持续活化型ALK3受体后可抑制HSC-T6细胞的活化增殖,并且具有时间依赖性.
2.3 半定量RT-PCR检测稳定表达持续活化型ALK3受体HSC-T6细胞α-SMA、col1A2等基因表达水平 分别收集CA-ALK3-T6细胞和Vector-T6细胞,提取总RNA,经逆转录合成cDNA,并以其作为模板进行RT-PCR反应.PCR产物经1%琼脂糖凝胶电泳后在凝胶成像仪下观察记录结果(图3).电泳结果显示,与阴性对照组Vector-T6细胞相比,CA-ALK3-T6细胞株α-SMA、col1A2、col3A1、col4A2 mRNA表达水平明显下调,而E-cadherin水平上调.
2.4 Western blotting检测稳定表达持续活化型ALK3受体HSC-T6细胞BMP信号转导相关蛋白 我们进一步检测了稳定表达持续活化型ALK3受体HSC-T6细胞BMP信号转导及纤维化相关蛋白表达,培养CA-ALK3-T6细胞和Vector-T6细胞,分别收集细胞并提取细胞总蛋白,进行Western blotting分析.与阴性对照细胞株Vector-T6相比,CA-ALK3-T6细胞P-Smad1磷酸化水平明显上升、E-cadherin表达水平上调,α-SMA,col1A2蛋白表达下降,Smad1蛋白水平未见明显改变.以β-actin作为内参照,凝胶成像系统成像(图4).
3 讨论
肝纤维化是各种慢性肝病发展至肝硬化的必经阶段,是由各种致病因子引起肝脏损伤和炎症,产生多种细胞因子刺激多种细胞发生上皮-间充质转化(epithelial to mesenchymal transition,EMT),产生大量细胞外基质(extracellular matrix,ECM)并在肝脏沉积,近年来,EMT参与肝纤维化被日渐提出,但肝脏中EMT的发生机制尚不完全明确.肝纤维化过程中发生EMT的最主要细胞为HSCs,HSCs活化增殖是肝纤维化发生发展的中心环节[3].Yu等[4]也提出HSCs的激活是肝纤维化的一个关键事件,被认为是EMT过程.EMT主要表现为细胞间粘附削弱,E-cadherin等上皮细胞分子标记表达下调,间质细胞标志分子如a-SMA表达上调,典型的细胞外基质成份如Ⅰ、Ⅲ、Ⅵ型胶原蛋白分泌增加[5].因此如何抑制上皮间质转化是治疗肝纤维化重要策略之一.
TGF-β参与HSCs发生EMT,直接或间接引起肝肌成纤维细胞的增加[6].BMP-7是一分子大小35KD的分泌性同源二聚体蛋白,属于TGF-β超家族成员之一[7].BMP-7受体是一种跨膜丝/苏氨酸激酶受体,BMP-7首先与Ⅱ型受体结合,Ⅱ型受体的蛋白激酶被激活,再与Ⅰ型受体结合,形成异源二聚体,催化Ⅰ型受体GS区的丝氨酸和苏氨酸残基磷酸化.Ⅰ型受体被激活后,作用于Smad1、Smad5或Smad8的C端SSXS模体,使其磷酸化,再与Smad4形成复合物,进入核内与多种转录因子相互作用发挥基因调控作用[8].BMP-7基因表达不足也是纤维化进展的重要原因之一[9].Zeisberg等[7]在慢性肾纤维化小鼠模型中高表达BMP-7能有效拮抗TGF-β1诱导的上皮间质转化.研究还显示,BMP-7通过影响TGF-β1信号通路的下游蛋白—Smads蛋白来阻断其信号转导[10].
本文运用真核表达载体pcDNA3-HASL-ALK3(QD)建立稳定表达持续活化型ALK3受体的大鼠HSCs株(CA-ALK3-T6).实验结果显示,持续活化型ALK3高表达可使大鼠HSCs形态趋向静止化,抑制大鼠HSCs活化增殖,进一步观察发现,BMP7信号通路下游信号分子Smad1磷酸化增加、上皮细胞标志分子E-Cadherin表达水平上调;同时,间质细胞标志物α-SMA以及Ⅰ型胶原mRNA及蛋白表达水平下降,Ⅲ、Ⅳ型胶原蛋白的mRNA水平下降.说明在大鼠HSCs中BMP-7信号通路的持续活化可逆转HSCs活化,抑制TGF-β1诱导的上皮间质转化和肌成纤维细胞增殖;减少ECM的分泌,从而改善肝纤维化.Yu等[4]研究发现,在肝纤维化过程中,MEG3在体内和体外均有降低,MEG3过表达导致肝纤维化的抑制,减少α-SMA和I型胶原蛋白.MEG3过表达通过EMT抑制HSC激活,与上皮标记物增加和间充质标记物减少有关.由此可见EMT是HSC激活致肝纤维化过程的关键环节.王丽惠等[11]研究发现TGF-β1刺激HSC-T6后细胞形态发生变化,伪足增多呈星形,细胞间连接呈疏松状态,呈现活化生物学特征.本实验研究通过倒置显微镜观察发现,BMP-7信号通路持续活化导致大鼠HSCs的形态学失去活化形态特征而趋向静止化变化.

图1 倒置相差显微镜下观察细胞形态.
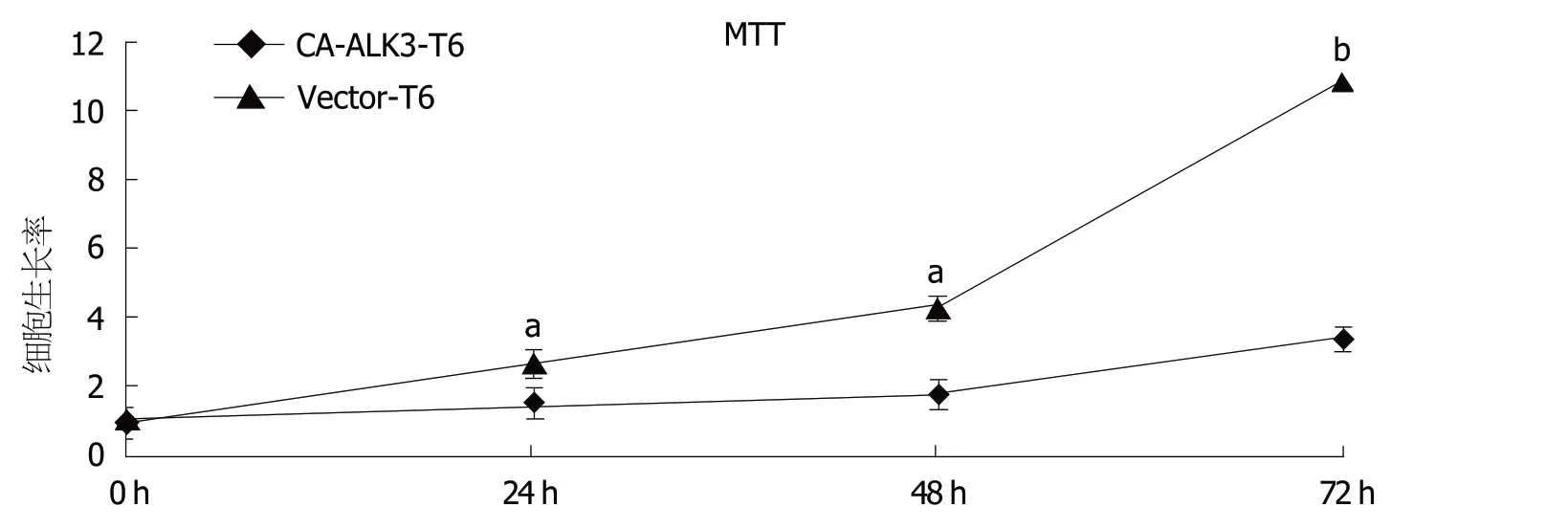
图2 MTT法检测稳定表达持续活化型ALK3受体对HSC-T6细胞增殖的影响(mean±SD,n = 3).
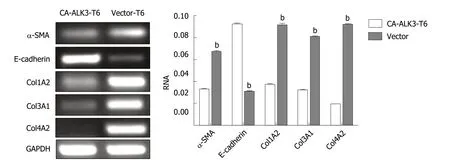
图3 RT-PCR检测稳定表达持续活化型ALK3受体HSC-T6细胞相关基因表达.
肝纤维化传统上被认为是一个不可逆转的过程,但以上本研究显示了BMP-7信号转导可抑制TGF-β1信号通路的致纤维化效应,为BMP-7成为治疗肝纤维化的关键靶点奠定基础.有望以激活BMP-7信号转导为靶点来探索、开发抗肝纤维化药物并应用到临床.
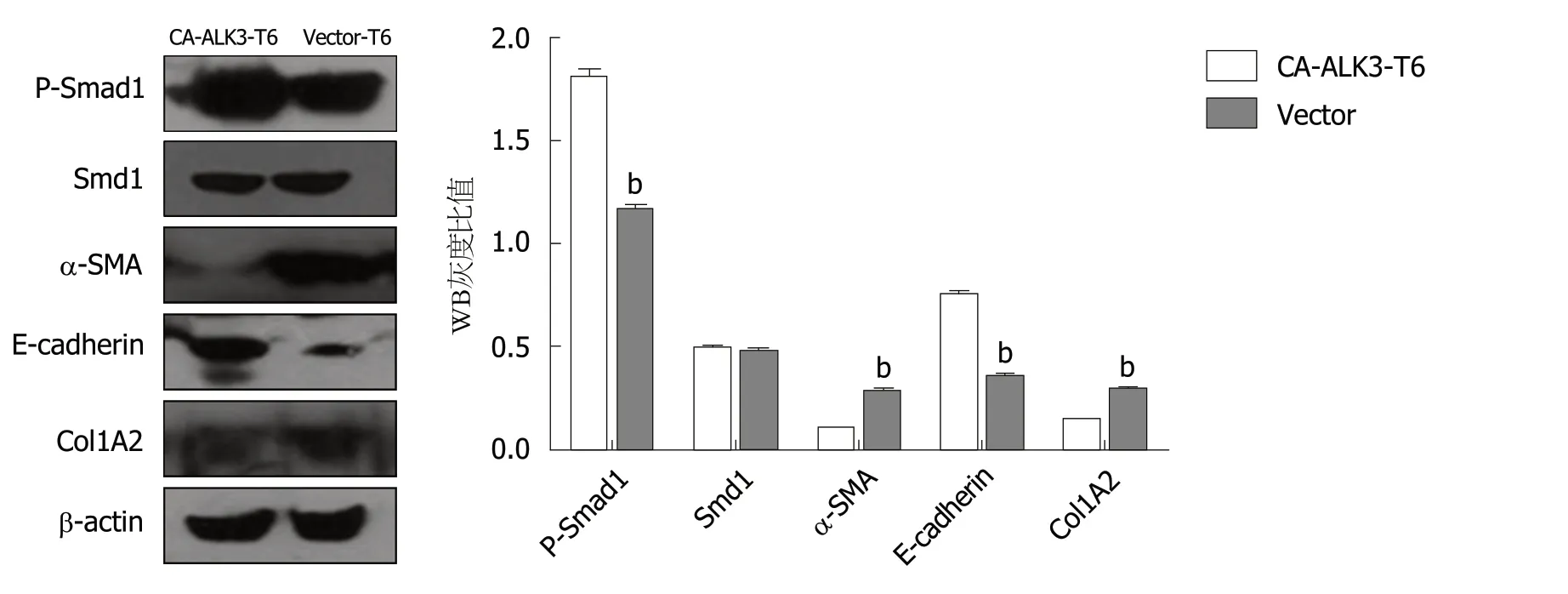
图4 Western blotting方法检测相关蛋白水平表达.
文章亮点
实验背景
二是在研判市情中增强紧迫感。市纪委、监委严格对照上级要求检视全市生态文明建设,深切感悟到保障污染防治攻坚战工作的艰巨性和紧迫性。盐城生态优势明显,但生态环境保护形势也比较严峻,特别是少数地方政绩观存在偏差,贯彻新发展理念不够坚决,环保执法不严,纵容环境违法行为,造成恶劣社会影响。今年上半年,江苏辉丰农化股份有限公司严重环境污染事件被生态环境部通报,大丰、滨海、响水三个县区被省生态环境厅区域限批,教训十分深刻。
虽然随着人们生活水平的提高及乙肝疫苗接种,我国乙型肝炎发病率逐年降低,但是酒精性及丙型肝炎引起的肝硬化却并不少见,研究数据显示,感染人员就诊者不足1/3,简直是冰山一角,长期不管理的结果便是肝硬化甚至迅速进展至肝癌,肝硬化是各种慢性肝病的晚期阶段,治疗效果差,且耗费大量资源,慢性乙型病毒性肝炎临床治愈(珠峰)工程项目、国家“十二五”传染病重大专项等课题对于肝硬化的研究及治疗有巨大的贡献,但目前仍未研究出并适用临床的有效逆转肝硬化方法.
实验动机
拟通过探讨肝硬化分子发生机制找到逆转的肝硬化关键靶点.
实验目标
本实验观察到通过研究BMP7及下游信号通路抑制肝纤维化与肝星状细胞(hepatic stellate cells,HSCs)能逆转肝硬化核心细胞HSCs.
实验方法
倒置相差显微镜、MTT、半定量PCR、western-blotting.
本文实验研究达到我们预期的结果,印证了肝纤维化分子发生发展机制,我们观察到持续活化的HSCs增殖受到抑制,并且向未活化方向逆转,探索了其中的分子机制,磷酸化的smad1水平显著升高,α-SMA和Ⅰ型胶原蛋白表达下调,而E-cadherin表达上调.本研究提示BMP7有希望成为肝纤维化的分子治疗靶点.
实验结论
本研究采用持续活化型ALK3的新方法,进一步探索了肝纤维化分子发病机制,观察到肝纤维化关键细胞HSCs活化有逆转,进一步印证BMP7有望成为肝纤维化分子治疗靶点,为将来肝纤维化的治疗提供新的契机.
展望前景
本实验采取成熟的实验方法,提出了我们的观点,但通过评审专家的意见确实有些忽略之处,会吸取经验教训,使实验更加严谨,本研究未来研究方向是动物模型的研究,未来研究方法的最佳方法仍主要以分子生物学研究方法为主.

