不同厂家市售美洛昔康片剂的溶出度比较
吕宝兴,张亚晴,牛景梅,何文彬,李玉琴
不同厂家市售美洛昔康片剂的溶出度比较
吕宝兴,张亚晴,牛景梅,何文彬,李玉琴*
(山东第一医科大学(山东省医学科学院) 药学院,山东 泰安 271016)
对不同生产厂家市售美洛昔康片剂进行溶出度比较。按2015版《中华人民共和国药典》(四部)溶出度测定第二法,用紫外分光光度法测定,测定波长362 nm。5个生厂家的美洛昔康片45 min时的平均溶出度分别为84.43%、88.30%、90.52%、90.03%和87.90%,均符合2015版《中华人民共和国药典》(二部)的规定。5个生产厂家美洛昔康片剂的平均溶出度之间存在一定的差异,临床用药时应考虑该差异所带来的临床效果。
药剂学;美洛昔康片;紫外分光光度法;美洛昔康;不同生产厂家;溶出度;比较
美洛昔康是一种新型的烯醇酰胺类非甾体抗炎镇痛药(NSAIDs),具有溶解性低、渗透性高的特点,在生物药剂学分类系统中属于第II类药物[1-3]。在临床上主要用于治疗关节炎及类风湿性关节炎,其抗渗出性炎性反应的作用优于吡罗昔康、吲哚美辛等抗炎药物,抑制炎性疼痛作用与吡罗昔康相似,但维持时间优于吡罗昔康[4]。由于美洛昔康水溶性差[5],导致其吸收差、生物利用度低。而药物的生物利用度与其溶出度密切相关,为了比较不同厂家生产的美洛昔康片剂的溶出度,本实验根据2015版《中华人民共和国药典》(四部)溶出度测定第二法[6]对5个不同厂家生产的美洛昔康片剂进行了溶出度的测定。
1 仪器与材料
ZRS-8G智能溶出试验仪(天津天大天发科技有限公司),UV-2700紫外分光光度计、AUY120电子天平(日本岛津公司),TG-16G凯特离心机(盐城凯特实验仪器有限公司),优普系列超纯水器(成都超纯科技有限公司)。
美洛昔康对照品(批号G1515087,纯度质量分数≥98%,阿拉丁试剂上海有限公司)。美洛昔康片(宁波大红鹰药业股份有限公司(A),批号H20031131,标示量7.5 mg/片;苏州威尔森药业有限公司(B),批号H20061231,标示量7.5 mg/片;扬子江药业集团有限公司(C),批号H20010207,标示量7.5 mg/片;江苏飞马药业有限公司(D),批号H20030679,标示量7.5 mg/片;仁和药业股份有限公司(E),批号H20031131,标示量7.5 mg/片),磷酸二氢钾(天津博迪化工有限公司),氢氧化钠(天津恒兴化学试剂制造有限公司)。
2 方法
2.1 溶液的制备
2.1.1 pH值7.4的PBS缓冲溶液的制备
精密称取磷酸二氢钾1.36 g,加入0.1 mol∙L-1的氢氧化钠溶液79 mL,用去离子水稀释,并定容至200 mL,备用。
2.1.2 美洛昔康对照储备液的制备
精密称取美洛昔康对照品0.1 g,置于100 mL量瓶中,加入0.1 mol∙L-1的氢氧化钠50 mL,超声溶解,用“2.1.1”条中的PBS缓冲液定容至刻度,摇匀,4 ℃冷藏备用。
2.2 溶出度测定法
取宁波大红鹰药业股份有限公司生产的美洛昔康片6片,按2015版《中华人民共和国药典》四部通则0931溶出度测定法中第二法,以“2.1.1”条下的PBS缓冲液900 mL为溶出介质,75 r∙min-1离心45 min,到45 min时,取溶液,过0.45 µm的微孔滤膜,取续滤液作为供试溶液;另取“2.1.2”条下的美洛昔康对照储备液适量,用溶出介质稀释制备成质量浓度为8 mg∙L-1的对照溶液;再以溶出介质为空白,取上述2种溶液在波长362 nm处分别测定其吸光度,按公式(1)计算每片的溶出量()。其余4个厂家的产品同法测定。
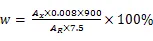
其中:A为供试溶液的吸光度值,A为对照溶液的吸光度值。
3 结果与讨论
3.1 美洛昔康最大吸收波长的确定
精密量取“2.1.2”条下的美洛昔康对照储备液适量,置于10 mL量瓶中,用“2.1.1”条下的PBS缓冲液定容至刻度,摇匀,制备质量浓度为8.0 mg∙L-1的美洛昔康对照溶液。将此溶液在波长300~500 nm内扫描,其吸收光谱见图1。由图1可知,美洛昔康的最大吸收波长在362 nm处。

Fig. 1 Ultraviolet absorption spectrum of meloxicam
3.2 美洛昔康对照品的线性关系考察
精密量取美洛昔康对照储备液0.3、0.4、0.5、0.6和0.8 mL,分别置于50 mL量瓶中,用“2.1.1”条下的PBS缓冲液定容至刻度,摇匀。以该PBS缓冲液为空白,分别在波长362 nm处测定其吸光度,以吸光度()对美洛昔康质量浓度()进行线性回归,得回归方程=0.179﹣0.2×10-4,2=0.999 2(=5)。结果表明,美洛昔康质量浓在6~16 mg∙L-1内与吸光度()线性关系良好。
3.3 精密度考察
按“3.2”条所述方法制备6、8、10 mg∙L-13种质量浓度的美洛昔康对照溶液,以pH值7.4的PBS缓冲液为空白,在波长362 nm处分别测定其吸光度值,重复测定3组,计算其吸光度的RSD见表1。结果表明,美洛昔康6、8、10 mg∙L-13种质量浓度对照溶液吸光度值的精密度均<2.0%,说明该方法精密度良好。
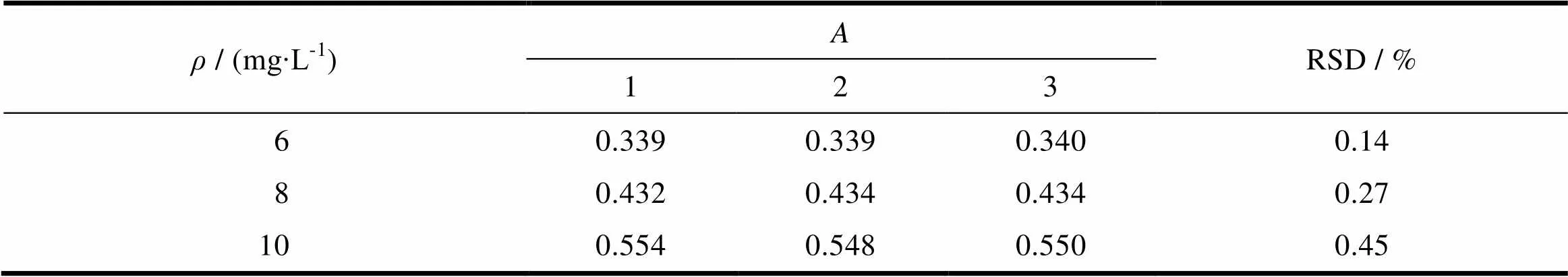
Table 1 The results of the method precision (n=3)
3.4 加标回收率的测定
取已知含量的宁波大红鹰药业股份有限公司美洛昔康片粉6份(约相当于美洛昔康40.0 mg),精密称定,再分别于每份中精密加入相当量的美洛昔康对照品,按“2.2”条方法制备供试溶液。将制得的6份供试溶液分别过0.45 µm的微孔滤膜,取续滤液,以溶出介质为空白,分别在波长362 nm处测定吸光度值,按标准加入法计算回收率(表2)。由表2可见,6份供试溶液的平均回收率为98.78%,RSD为0.61%,表明该方法准确性高。

Table 2 The determination results of recovery
3.5 溶出度的测定
取宁波大红鹰药业股份有限公司的美洛昔康片6片,照2015版《中华人民共和国药典》四部通则0931溶出度测定法中第二法测定,将测得的吸光度值代入公式(1)计算出每片标示量的百分含量,其余四个厂家以同法测定,结果见表3。由表3可见,5个厂家美洛昔康片的平均标示量百分含量分别为84.43%、88.30%、90.52%、90.03%和87.90%,而2015版《中华人民共和国药典》(二部)[7]美洛昔康片的溶出度规定,每片的溶出量应不低于标示量的75%。因此,5个厂家美洛昔康片的溶出度均符合规定。5个厂家美洛昔康片平均标示量百分含量的RSD为2.43%,表明所测5个厂家美洛昔康片的溶出度存在一定的差异,但无显著性差异。

Table 3 The dissolutions of meloxicam tablets from five manufacturers
由于美洛昔康水溶性差,2015版《中华人民共和国药典》(二部)规定要对其进行溶出度检查,作者考察了5个生产厂家的美洛昔康片剂溶出度。结果表明, 5个厂家美洛昔康的溶出度均符合《中华人民共和国药典》(二部)的规定,但不同厂家生产的美洛昔康片的溶出度之间也存在差异,临床用药时应考虑该差异所带来的临床效果。
[1] 王平, 顾振纶. 新型非甾体抗炎药—美洛昔康[J]. 中国新药与临床杂志, 2000, 19(6): 499-501.
[2] 贺立中. 新型非甾体抗炎药美洛昔康的药理作用及临床应用[J]. 中国医院用药评价与分析, 2001, 17(6): 365-368.
[3] PAREKH V J, 王盈. 美洛昔康自纳米乳化颗粒的研制[J]. 中国医药工业杂志, 2017, 48(3): 433-433.
[4] 隋鹏, 陆洋. 美洛昔康片体外多条溶出曲线的比较[J]. 临床合理用药杂志, 2018, 11(34): 114-115.
[5] 杨汉初, 陈晓冰. 美洛昔康片溶出度测定方法的研究[J]. 中国医院药学杂志, 2000, 20(3): 143-144.
[6] 国家药典委员会. 中华人民共和国药典: 四部[M]. 北京: 中国医药科技出版社, 2015: 121.
[7] 国家药典委员会. 中华人民共和国药典: 二部[M]. 北京: 中国医药科技出版社, 2015: 846.
To compare the dissolution of meloxicam tablets from the different manufacturers
LV Baoxing, ZHANG Yaqing, NIU Jingmei, HE Wenbin, LI Yuqing*
(,,271016,)
To compare the dissolution of meloxicam tablets in different manufacturers.According to the second method listed in theⅣ (Edition 2015), the contents of the tablets were measured by the ultraviolet spectrophotometry at a wave length of 362 nm.The average dissolutions of meroxicam tablets at 45 min from 5 different manufacturers were 84.43%, 88.30%, 90.52%, 90.03% and 87.90%, respectively, which all met the provision ofⅡ(Edition 2015).There is a certain difference in the average dissolution of meloxicam tablets between the five manufacturers, and the clinical effect of this difference should be considered in clinical use.
pharmaceutics; meloxicam tablet; ultraviolet spectrophotemetry; meloxicam; different manufacturers; dissolution; comparation
2019-03-20
国家级大学生创新训练项目(201810439073); 山东省青少年教育科学规划课题大学生学术课题(19BSH272)
吕宝兴(1994-), 女(汉族), 山东淄博人, 硕士研究生, E-mail 1871926384@qq.com;
李玉琴(1968-), 女(汉族), 山东泰安人, 教授, 博士, 硕士生导师, 主要从事药物分析方面的研究, Tel. 0538-6229751, E-mail liyuqin@tsmc.edu.cn。
R94
A
(2019)04–0122–05
10.14146/j.cnki.cjp.2019.04.005
(本篇责任编辑:赵桂芝)

