奥氮平口腔速溶膜剂的研制及质量评价
万小草,方 亮
奥氮平口腔速溶膜剂的研制及质量评价
万小草,方 亮*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
研究奥氮平口腔速溶膜剂处方以及制备工艺,并对优选膜剂的质量进行评价。通过溶剂浇铸法制备膜剂,采用单因素考察法对成膜材料、抑晶剂、增塑剂进行筛选;以膜剂含量、溶出度、机械性质对优选处方进行质量评价。优选处方的质量分数组成为:主药奥氮平18%,成膜材料PVA 4-88 60%,抑晶剂苹果酸9%,增塑剂丙二醇12%,以及甜味剂三氯蔗糖1%;自制膜剂厚度约120 mm,含量均匀度高,3 min 释放90%以上药物,可达到速释效果;成膜性较好,抗张强度为(166.83 ± 15.42)N·mm-2,断裂伸长率为(101.9 ± 6.7)%,有良好的韧性和硬度。自制奥氮平口腔速溶膜剂有望制成速释抗精神分裂制剂,值得进一步研究。
药剂学;口腔速溶膜剂;溶剂浇铸法;奥氮平;溶出度;机械性质
精神分裂症(schizophrenia,SZ)是一种慢性的高复发率、高自残率以及高危险的严重精神类疾病,它不仅影响患者本身,而且影响他们的家庭和整个社会[1-2]。奥氮平(olanzapine,OLN)作为第二代抗精神病药物(SGAs)的代表药物,因其引起的锥体紊乱不良反应较其他SGAs小,被作为治疗与躁狂症相关的双相情感障碍和精神分裂症的一线药物[3],其化学结构式见图1。目前,SZ患者在服用上市的OLN片剂期间,普遍存在藏药和吐药现象,使得患者用药的依从性较差,影响疗效[4]。而口腔速溶膜剂无需饮水服用,即可在唾液中能快速溶解、释放药物;黏附于舌面后不易吐出,给药方便,患者顺应性好且制备工艺简单易于工业化生产[5-8]。因此,本文作者采用溶剂浇铸法制备奥氮平口腔速溶膜剂,并对优选处方进行了初步质量评价。

Fig. 1 The structural formula of olanzapine.
1 仪器与材料
CJJ-6磁力搅拌器(上海君竺仪器有限公司),AL-104电子天平(梅特勒-托利多仪器有限公司),TB-1实验用框式涂布器(上海锴凯科技贸易有限公司),ZRS-8G智能溶出试验仪(天津天大天发科技有限公司),高效液相色谱仪(包括L-2130泵和L-2420可变波长紫外吸收检测器,日本Hitachi公司),HT-220A色谱柱恒温箱(大连汇达科学仪器有限公司),Diamonsil C18色谱柱(200 mm × 4. 6 mm,5 μm,美国Dikma公司),BLD-200S 电子剥离试验机(济南兰光机电技术开发公司)。
奥氮平(北京华威锐科化工有限公司),羟丙基甲基纤维素E5(hydroxypropylmethyl cellulose,HPMCE5,上海卡乐康包衣技术有限公司),聚乙烯醇(polyvinyl alcohol,PVA)4-88、18-88、40-88(德国EMD 米利波尔公司),聚乙烯吡咯烷酮K30(polyvinylpyrrolidone,PVP K30,上海迈瑞尔化学技术有限公司),乙烯吡咯烷酮-乙酸乙烯酯共聚物(polyvinylpyrrolidone-co-vinyl acetate,PVP VA64,德清宝维同纳米材料有限公司),聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus)、聚乙烯醇-聚乙二醇接枝共聚物(Kollicoat IR)(巴斯夫中国有限公司),聚乙二醇6000(polyethylene glycol,PEG6000)、丁二酸、顺丁烯二酸、反丁烯二酸、丙二醇、甘油、聚乙二醇400(PEG400)、冰醋酸、无水乙醇(天津博迪化工有限公司),苹果酸(大连美仑生物技术有限公司),三氯蔗糖(默克化工技术有限公司),三乙胺(天津科密欧化工有限公司),甲醇(色谱纯,天津康科德科技有限公司),其他所用试剂(分析纯,市售)。
2 方法
2.1 奥氮平口腔速溶膜剂的制备
采用溶剂浇铸法制备口腔速溶膜剂。将成膜材料1 g分别溶解在一定量的重蒸水中,充分溶胀后搅拌溶解得到澄清透明胶液,将处方量OLN与辅料分散于上述胶液中,充分搅拌混匀获得均匀含药的胶液。室温静置2 h后,超声15 min,得到不含气泡的胶液,用涂布器将其均匀涂布,50 ℃干燥,脱膜,切割即可。
2.2 处方筛选
2. 2. 1 成膜材料的筛选
实验中选择6种常用的成膜材料分别为PVP K30、PEG6000、PVA、Soluplus、PVP VA64和Kollicoat IR 并对PVA 4-88、18-88、40-88三种型号进行筛选,主要对其成膜能力进行比较。
2.2.2 抑晶剂的筛选
奥氮平属于难溶性弱碱性药物,其在水溶性成膜材料中极易发生聚团而析出结晶[9]。实验中选择琥珀酸(succinic acid)、富马酸(fumaric acid)、马来酸(maleic acid)和苹果酸(malic acid)4种酸作为抑晶剂,并对这4种酸的抑晶能力进行考察。含抑晶剂膜剂的制备方法:在已制备好的空白成膜材料胶液中加入与OLN用量摩尔比为1∶1的抑晶剂,搅拌均匀后加入OLN粉末,室温搅拌直至得到透明黄色胶液,并采用“2.1”条方法制得含不同抑晶剂的膜剂。室温放置12 h后用显微镜观察各个膜剂中是否有结晶析出。
2.2.3 增塑剂的筛选
为改善膜剂的机械性质,进一步对增塑剂进行筛选,使其便于包装和拿持,所选增塑剂有丙二醇、甘油和PEG400。
2.3 质量评价
2.3.1 色谱条件
色谱柱:Diamonsil C18柱(200 mm×4. 6 mm,5 μm);流动相:甲醇-水(加入0.1%三乙胺,冰醋酸调节pH至3.7),体积比为40∶60;检测波长270 nm;柱温40 ℃;流速1 mL·min-1;进样量20 μL。在本色谱条件下,OLN质量浓度()在0.25~50 g·L-1内与峰面积()线性关系良好,回归方程为= 6.493 3×104+1.140 7×104,2= 0.999 9。
2.3.2 含量测定
将优选的奥氮平口腔速溶膜剂切割成4 cm2大小并溶于适量重蒸水中,稀释,定容。采用“2.3.1”条色谱条件进行测定,求膜剂中药物的实际含量(= 20)。
2.3.3 膜剂厚度的测定
用螺旋测微器量程(0 ~ 25 mm,分辨率0. 001 mm)测优选膜剂厚度,测试点为膜剂的四角和中心共5个点,记录数据并求均值,得膜剂的平均厚度(= 6)[10]。
2.3.4 体外溶出实验
分别以100 mL 模拟唾液和0.1 mol·L-1HCl为溶出介质,转速为50 r·min-1,水浴温度为(37±1)℃。将4 cm2优选膜剂置于250 mL溶出杯的底部,自其接触溶出介质起开始计时,分别于1、3、5、7、10、15、20、30、45和 60 min取 5 mL样品溶液,并立即加入等量新鲜已预热至37 ℃的溶出介质。样品在1.6×104r∙min-1离心5 min,取上清液稀释后采用“2.3.1”条色谱条件测定,计算每片膜剂药物的溶出量(6)。
2.3.5 膜剂机械性质的测定
为考察优选膜剂的机械性质,采用抗张强度和断裂伸长率对膜剂的机械性质进行评价。操作如下[9]:将膜剂裁成115 mm×10 mm,水平置于两个相距100 mm 的夹子间,以50 mm·min-1的速度拉右侧夹子,待样品从中间断裂后,仪器自动记录样品断裂时所施加的最大力()即为抗张强度;而断裂伸长率的大小为增加的长度与原长的比值(= 6),其计算公式如下[11]:
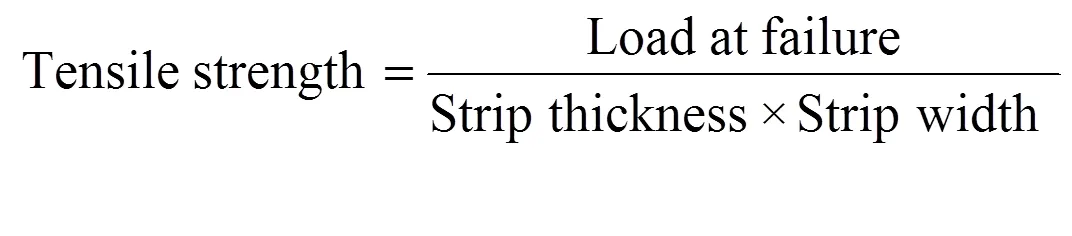
3 结果
3.1 膜剂处方筛选
3.1.1 成膜材料的筛选
制备8种膜剂的外观如图2所示,从图2可以明显的看出,PVP K30、Soluplus、PVP VA64和Kollicoat IR为透明的膜剂,但是膜剂的内聚能大,收缩现象明显,且机械性质差,而PEG6000涂膜干燥后,得到的膜剂为白色且不均匀。与之相比,PVA显示了其良好的成膜性质,与PVA 18-88、PVA 40-88 相比,PVA 4-88能够得到无气泡且厚度均匀的膜剂。最终选用PVA 4-88为成膜材料进行接下来的处方筛选。
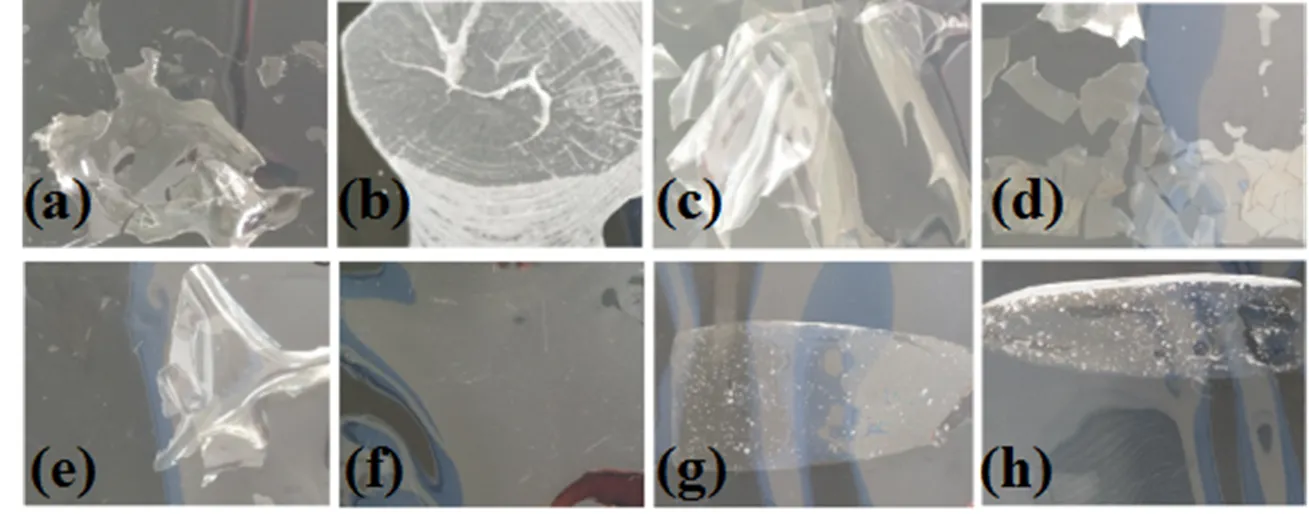
a—PVP K30; b—PEG6000; c—Soluplus; d—PVP VA64; e—Kollicoat IR; f—PVA 4-88; g—PVA 18-88; h—PVA 40-88
3.1.2 抑晶剂的筛选
对于固体分散体而言,药物析晶严重影响其在体内外的溶出度,进一步影响治疗效果[12-14],因此需要选择一种合适的物质抑制药物在极性高分子成膜材料中的重结晶。实验中分别对琥珀酸、富马酸、马来酸和苹果酸4种口服常用的二元酸进行筛选。
由图3可以观察到含OLN•Fum、OLN•Male、OLN•Suc的3种膜剂中有结晶析出,而含OLN•Mal膜剂中未发现药物结晶,说明OLN在抑晶剂Mal帮助下以无定型存在于PVA 4-88膜剂中。因此,优选Mal作为抑晶剂进行进一步研究。

a—OLN•Fum; b—OLN•Male; c—OLN•Suc; d—OLN•Mal
3.1.3 增塑剂的筛选
已知含OLN•Mal的PVA 4-88膜剂,呈黄色透明。三种增塑剂丙二醇、甘油和PEG400 的加入,均不会引起药物薄膜外观的改变,依旧为黄色透明。因此,在确定增塑剂筛选结果的基础上,主要以机械性质的改变和 1 min 膜剂中药物溶出为指标进行考察。从表1 中可以看出,甘油组机械性质和丙二醇组的相当,而PEG400组的机械性质并不合格,这一点由耐折度可以看出(耐折度:将膜剂裁剪为4 cm2的大小,沿着中线反复折叠,直到断裂,记录次数,即为耐折度)。当丙二醇和甘油的质量分数大于PVA 4-88的15%时,两种增塑剂影响下的含OLN•Mal膜剂均具有较好的机械性质。但丙二醇组在1 min时的溶出速度明显比甘油组的快,随着其浓度的增大,药物的溶出度基本呈增大的趋势,对于含20%和25%丙二醇而言,>0.05无显著性差异,因此采用丙二醇作为增塑剂且用量质量分数为20%。
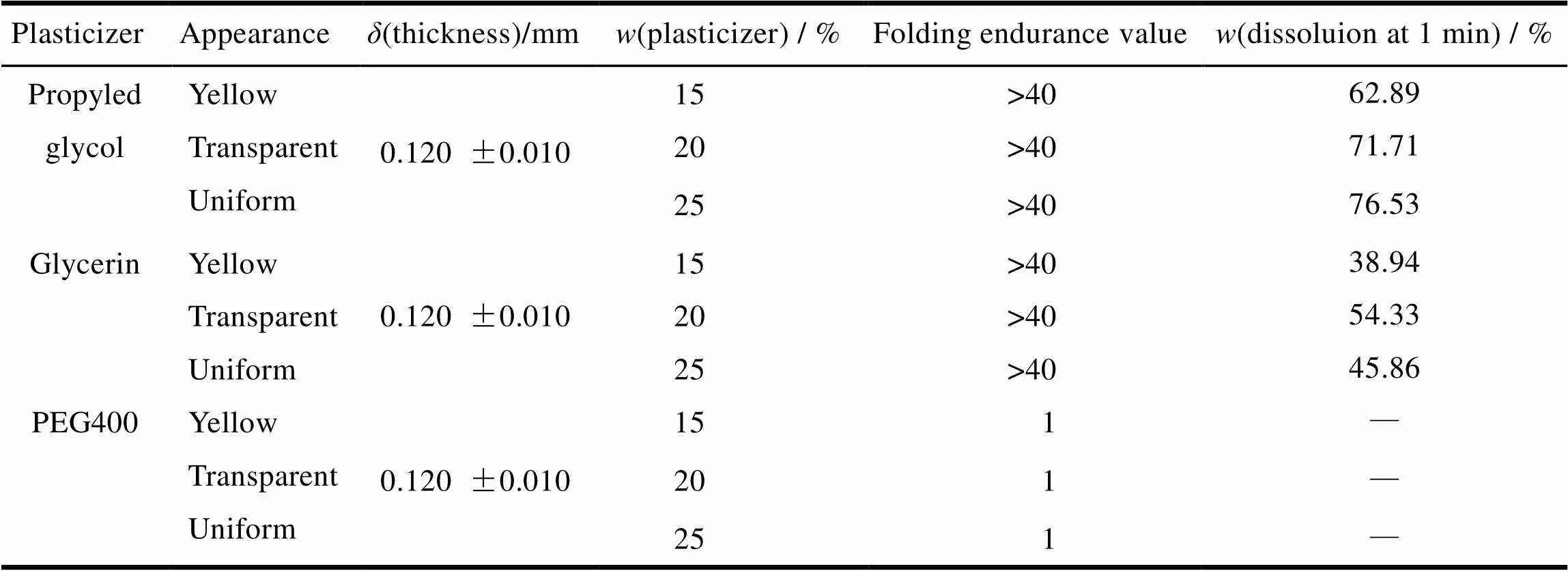
Table 1 Investigation of different plasticizers
为了增加精神分裂患者的顺应性,在处方中加入了质量分数为PVA 4-88的2%的三氯蔗糖作为甜味剂,得到的膜剂外观与不含甜味剂相比无差异,但味道明显改善,甜度适中且无苦涩感。
3.1.4 膜剂最终处方组成
奥氮平口腔速溶膜剂的处方组成为(质量分数): PVA 4-88(60%),OLN(18%)和Mal(9%),丙二醇(12%)和三氯蔗糖(1%)。
3.2 膜剂体外质量评价
3.2.1 厚度
对于口腔速溶膜剂而言,太薄不容易从自封袋中拿取,而常规的厚度在0.1 mm左右比较合适[15]。在保证膜剂在给定面积和含药量以及具有良好的溶出行为的前提下,最终将膜剂的厚度控制在(0.126±0.005)mm,RSD < 5%。
3.2.2 含量
自制 OLN•Mal膜剂其单片(4 cm2)药物含量为(10.20±0.56)mg,测得的药物含量均在标示量的 92.1%~108%内,符合《日本药典》15版对制剂药物含量的规定(90% ~ 110%);根据含量均匀度的计算公式,接受值(AV)为 12.34%,小于15%,认为制得的OLN•Mal膜剂含量均匀度符合要求。
3.2.3 机械性质
机械性质原本用于材料性质的考察,而膜剂实质就是载药的高分子材料,因此可通过抗张强度和断裂伸长率对其机械性质进行评价。试验中对6条OLN•Mal膜剂(115×10 mm)进行了拉断测试,记录数据,得到OLN•Mal膜剂抗张强度为(166.83±15.42)N·mm-2,断裂伸长率为101.9%±6.7%。Visser.J.C等从质量源于设计角度出发,认为抗张强度大于2 N·mm-2,断裂伸长率大于10%便符合该要求,其包装和储存简便[16]。
3.2.4 体外溶出实验
图4为OLN•Mal膜剂在模拟唾液和0.1 mol·mL-1HCl中的溶出曲线,优选膜剂在 0.1 mol·mL-1HCl和模拟唾液中的溶出行为无显著性差异(> 0.05),3 min以内药物累积溶出度均能大于 90%,10 min 以内药物溶出完全。

¾—OLN∙Mal film-0.1 mol∙L-1∙HCl; —OLN∙Mal film-simulated saliva
4 讨论
近30年来,膜剂以其剂量准确、无需饮水、溶化迅速、便于携带、制备工艺简单等独特的性质和优势,逐渐在制剂领域得到重视。采用第二代抗精神分裂奥氮平为原料药制备口腔速溶膜剂,相较于片剂,膜剂可增加此类患者的用药依从性。采用溶剂浇铸法制备的奥氮平口腔速溶膜剂,其中苹果酸作为抑晶剂可使其外观透明光洁,厚度均匀,且膜剂大小4 cm2(约含药10 mg)便可满足口服日剂量,给药方便。同时,3 min释放90%以上药物,10 min内即释放完全,可达到速释效果。对自制奥氮平口服速溶膜剂拉伸强度和断裂伸长率的考察结果表明,其具有良好的韧性和硬度,便于服用和贮存。综上,本研究初步确立了奥氮平口腔速溶膜剂制备工艺及体外质量评价标准,为后续进一步研发本制剂产品奠定了基础。
[1] HOWES O D, MURRAY R M. Schizophrenia: an integrated sociodevelopmental-cognitive mode[J]. Lancet, 2014, 383: 1677-1687.
[2] ESFAHLANI F Z, VISSER K, STRAUSS G P, et al. A network-based classification framework for predicting treatment response of schizophrenia patients[J]. Expert Systems with Applications, 2018, 109: 152-161
[3] SHAHLAEI M, RAHIMI B, ASHRAFI-KOOSHK M R, et al. Probing of possible olanzapine binding site on human serum albumin: combination of spectroscopic methods and molecular dynamics simulation[J]. Journal of Luminescence, 2015, 158: 91-98.
[4] 韩雪红,袁利明. 950例精神病患者中的藏药现象及心理康复护理对策[J].中国医药指南, 2005(4): 83-100.
[5] DE MOHAC L M, DE FÁTIMA P M, RAIMI-ABRAHAM B T. Solid microcrystalline dispersion films as a new strategy to improve the dissolution rate of poorly water soluble drugs: A case study using olanzapine[J]. Int J Pharm, 2016(508): 42-50.
[6] BORGES A F, CLÁUDIA S, COELHO J F J, et al. Oral films: Current status and future perspectives: I –galenical development and quality attributes[J]. J Control Release, 2015, 206: 1-19.
[7] DIXIT R P, PUTHLI S P. Oral strip technology: Overview and future potential[J]. J Control Release, 2009, 139(2): 94-107.
[8] 陈芳, 夏怡然, 侯惠民. 口腔膜剂的研发及应用[J]. 中国医药工业杂志, 2012, 43(6): 484-489.
[9] MAHER E M, ALI A M A, SALEM H F, et al./evaluation of an optimized fast dissolving oral film containing olanzapine co-amorphous dispersion with selected carboxylic acids[J]. Drug Delivery, 2016: 23(8): 1-13.
[10] ZHAO Y, QUAN P, FANG L. Preparation of an oral thin film containing meclizine hydrochloride:andevaluation[J]. Int J Pharm, 2015, 496(2): 314-322.
[11] IRFAN M, RABLEl S, BUKHTAR Q, et al. Orally disintegrating films: A modern expansion in drug delivery system[J]. Saudi Pharmaceutical Journal, 2015, 24: 537-546
[12] GRECO K, BOGNER R. Crystallization of amorphous indomethacin during dissolution: Effect of processing and annealing.[J]. Mol Pharm, 2010, 7(5): 1406-1418.
[13] HOMAYOUNI A, SADEGHI F, VARSHOSAZ J, et al. Promising dissolution enhancement effect of soluplus on crystallized celecoxib obtained through antisolvent precipitation and high pressure homogenization techniques[J]. Colloids and Surfaces B: Biointerfaces, 2014, 122: 591-600.
[14] 陈玉红, 王青松, 平其能, 等. 热熔挤出技术制备艾拉莫德固体分散体及体外溶出度的影响因素研究[J]. 中国药学杂志, 2013, 48(17): 1272-1278.
[15] ADROVER A, PEDACCHIA A, PETRALITO S, et al.dissolution testing of oral thin films: A comparison between USP 1, USP 2 apparatuses and a new millifluidic flow-through device[J]. Chemical Engineering Research and Design, 2015, 95: 173-178.
[16] VISSER J C, DOHMEN W M C, HINRICHS W L J, et al. Quality by design approach for optimizing the formulation and physical properties of extemporaneously prepared orodispersible films[J]. Int J Pharm, 2015, 485(1/2): 70-76.
Preparation andevaluation of olanzapine orodisper-sible films
WAN Xiaocao, FANG Liang*
(,,110016,)
To study the formulation and preparation process of olanzapine orodispersible films, and evaluate the quality of the preferred film.In this study, the films were prepared by solvent casting method. The film-forming materials, crystal inhibitors and plasticizers were selected by single factor method. The film was optimized with the evaluation parameters of the uniformity, dissolution time and mechanical properties.The optimized film was composed of 18% olanzapine (2.5×10-3g·cm-2), PVA 4-88 as film-forming material, 9% malic acid as a crystal inhibitor and 12% propylene glycol as a plasticizer. The thickness of the self-made olanzapine film was about 120 mm, drug contents were uniform in the film, and more than 90% of the drugs was released in 3 min, which achieved the effect of immediate drug release. The mechanical properties of the film were good, and the films had great toughness and hardness. The tensile strength and elongationat break of the films were (166.83±15.42) N·mm-2and (101.9±6.7)%, respectively.The self-made olanzapine film is expected to be a quick-release antipsychotic preparation and is worthy for further study.
pharmaceutics; orodispersible films; solvent casting method; olanzapine; dissolution; mechanical properties
2019-04-17
万小草(1993-), 女(汉族), 陕西西安人, 硕士研究生, E-mail wanxiaocao5566@163.com;
方亮(1964-), 男(朝鲜族), 吉林和龙人, 教授, 博士,博士生导师, 主要从事经皮吸收制剂、口腔膜剂的研究, Tel. 024-43520511, E-mail fangliangspu@aliyun.com。
R 94
A
(2019)04–0107–08
10.14146/j.cnki.cjp.2019.04.003
(本篇责任编辑:赵桂芝)

