纺锤体与动粒相关蛋白-1在肝细胞癌中的预后分析
倪谢根,方 强,谢应海,唐小龙,杨 枋,刘付宝
肝细胞癌(hepatocellular carcinoma, HCC),以下简称肝癌,是原发于肝细胞的恶性肿瘤[1]。HCC的高发病率和死亡率与其易转移复发密切相关[2]。因此,探究HCC发生发展的异常机制对HCC诊断和治疗具有重要意义。纺锤体与动粒相关蛋白-1(spindle and kinetochore-associated complex subunit 1,SKA1)是一个与有丝分裂相关的基因。它与SKA2、SKA3共同组成纺锤体和动粒相关复合物(spindle and kinetochore associated complex,SKA复合体),在有丝分裂后期染色体分离中发挥重要作用[3]。近年来,大量研究[3-5]表明SKA1参与多种恶性肿瘤的发生发展。虽然在HCC系中敲除SKA1能抑制HCC细胞的增殖[6],然而,SKA1对HCC的预后影响尚未见报道。该研究探讨了SKA1的异常表达与HCC患者生存预后之间的关系。
1 材料与方法
1.1 病例资料本研究收集的88对HCC组织和相对应的癌旁组织都是来自于安徽医科大学第一附属医院2006~2010年HCC根治性切除术的组织标本。所有患者在术前均没有接受过任何的辅助治疗,如放射治疗和化学治疗等。术后均经组织病理学证实为原发性HCC。收集的标本常规石蜡包埋,4 μm切片。参与研究的88例患者中,男72例,女16例,年龄27~80(52.10±12.73)岁,其他主要的临床和病理特征见表1。本研究经我院伦理委员会批准实施。
TCGA(the cancer genome atlas)数据库,全球最大的肿瘤数据库(https://cancergenome.nih.gov/),截止2017年12月20日,收录HCC有371例,癌旁组织有50例。本研究所涉及的TCGA数据来源于此数据库。
1.2 免疫组化将石蜡切片放置于60 ℃的烘箱中60 min,然后将切片脱蜡水化。0.3%过氧化氢封闭内源性过氧化物酶。柠檬酸缓冲液进行抗原修复。冷却至室温后,磷酸盐缓冲液洗涤后,山羊血清室温封闭60 min以减少非特异性反应。SKA1(美国Atlas公司)抗体稀释液(1 ∶25),4 ℃孵育过夜。阴性对照选用磷酸盐缓冲液。孵相对应的二抗在37 ℃中放置30 min。DAB显色,苏木精复染。脱水封片。
1.3 免疫组化结果判定SKA1染色主要位于细胞浆和细胞膜,呈现棕黄色颗粒为阳性。本研究根据阳性细胞数平均面积和染色强度对免疫组化进行评分。评分由两位研究者(其中一位为病理医师)采用双盲法进行。评分标准如下:阳性细胞数平均面积≤50%记为0分,>50%记为1分;染色强度为无染色或淡黄色记为0分,棕色记为1分,深棕色记为2分。两者得分相加≥2分者为高表达。
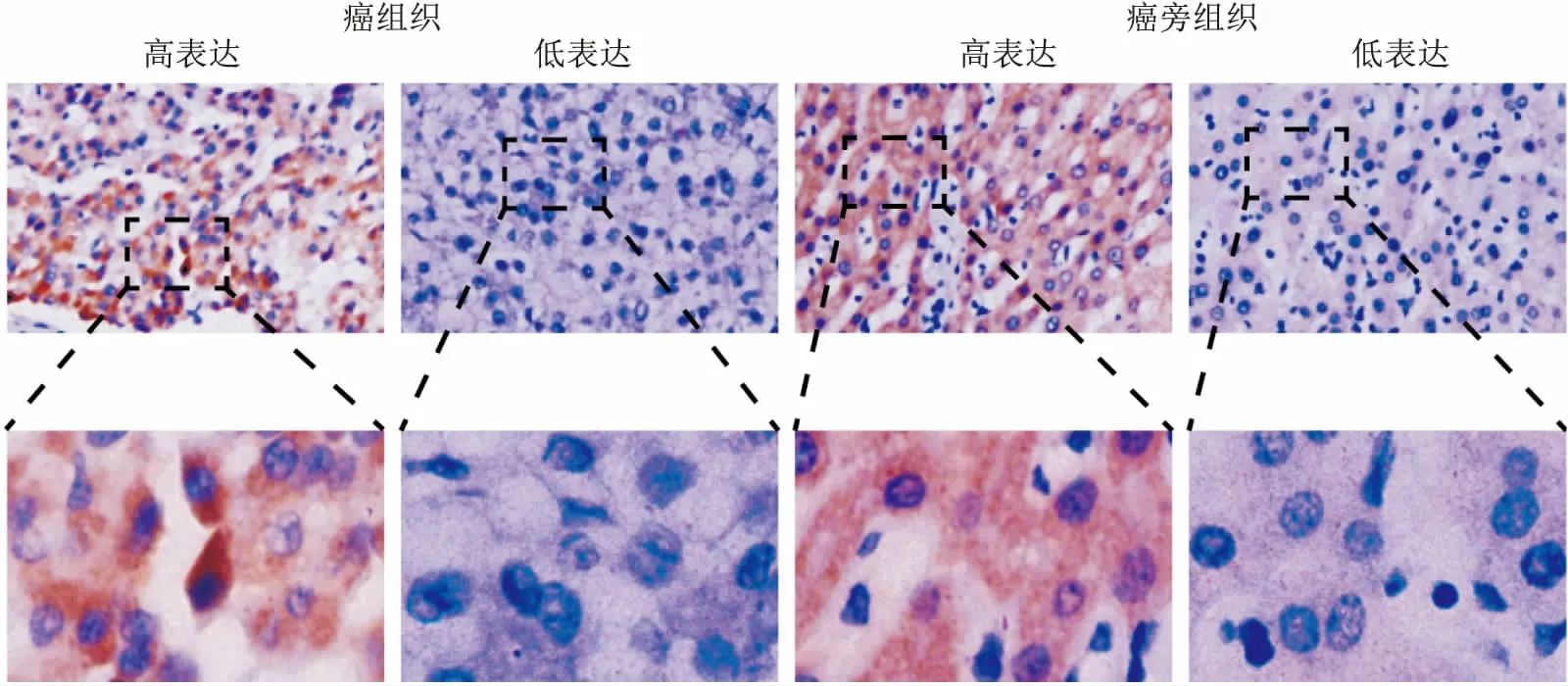
图1 HCC组织和癌旁组织SKA1免疫组化染色 ×100(上图);×400(下图)
1.4 随访方法本研究通过结合门诊和住院病历记录与电话进行随访。随访日期截止到2015年12月,总生存时间(overall survival, OS)为手术至患者死亡或最后一次随访的时间,无瘤生存时间(disease-free survival, DFS)为手术至患者复发的时间间隔。
1.5 统计学处理采用SPSS 22.0软件进行统计分析。根据数据特征,两组间的比较选用t检验或χ2检验或秩和检验。SKA1的表达与肿瘤大小的相关性使用Spearsman相关分析。OS和DFS生存分析使用Kaplan-Meier检验。单因素和多因素分析采用Cox比例风险回归模型。以P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 SKA1在HCC组织中高表达在HCC组织中,37例(42.05%)为高表达,51例(57.95%)为低表达,而在相对应的癌旁组织中,10例(11.36%)为高表达,78例(88.64%)为低表达。见图1。SKA1在HCC组织中的表达显著高于癌旁组织[1(四分位数间距为2)vs1(四分位数间距为1)](P<0.001),见图2A。TCGA数据显示在mRNA水平上SKA1在HCC组织中的表达显著高于癌旁组织[(250.66±278.63)vs(10.91±10.34),P<0.001],见图2B。
2.2 SKA1的表达水平与HCC患者临床病理特征之间的关系SKA1与性别、年龄、乙肝表面抗原(hepatitis B virus surface antigen,HBsAg)阳性、谷丙转氨酶(alanine transaminase,ALT)、甲胎蛋白(alpha
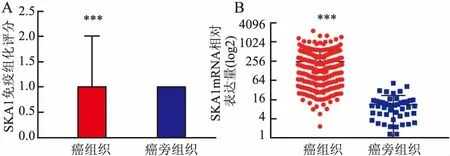
图2 SKA1在HCC组织中高表达
A:SKA1在88对HCC组织和癌旁组织中的免疫组化评分;B:SKA1在TCGA数据库中的表达;与癌旁组织比较:***P<0.001
fetoprotein,AFP)、肝硬化、肿瘤数目、包膜完整性、分化程度无相关性(P>0.05),见表1,而与肿瘤大小相关(P=0.002)。SKA1的表达与肿瘤大小的Spearman相关系数为0.334(P=0.001)。
2.3 SKA1的表达水平与HCC患者的OS和DFS有关在88例HCC患者的5年生存率为46.59%,5年复发率为55.68%。Kaplan-Meier法分析SKA1表达水平与HCC患者预后的关系。结果显示,SKA1高表达患者的OS远低于SKA1低表达患者的(P<0.001),见图3A,SKA1高表达患者的DFS也远低于SKA1低表达患者的(P=0.016),见图3B。SKA1高表达患者的5年生存率明显低于低表达组(27.03%vs60.78%),SKA1高表达患者的5年复发率明显高于低表达组(64.86%vs49.02%)。TCGA数据显示SKA1高表达患者的OS比低表达的显著降低(P<0.001),见图3C,与本研究的结果相符。
2.4 SKA1在亚组中对HCC患者OS和DFS的影响本研究显示,对于血浆ALT高表达的患者,SKA1高表达组较低表达组OS和DFS更差(P<0.001,P=0.007),见图4。SKA1高表达者的1、3、5年生存率分别为78.30%、26.10%、13.00%,而SKA1低表达者的1、3、5年生存率分别为93.10%、79.30%、55.20%。SKA1高表达者的1、3、5年OS分别为78.30%、26.10%、13.00%,而SKA1低表达者的1、3、5年OS分别为93.10%、79.30%、55.20%。SKA1高表达者的1、3、5年DFS分别为39.10%、32.60%、0.00%,而SKA1低表达者的1、3、5年DFS分别为75.90%、42.40%、34.70%。然而,对于血浆ALT低表达的患者,SKA1高表达组和低表达组之间的OS和DFS差异无统计学意义(P=0.115,P=0.605)。
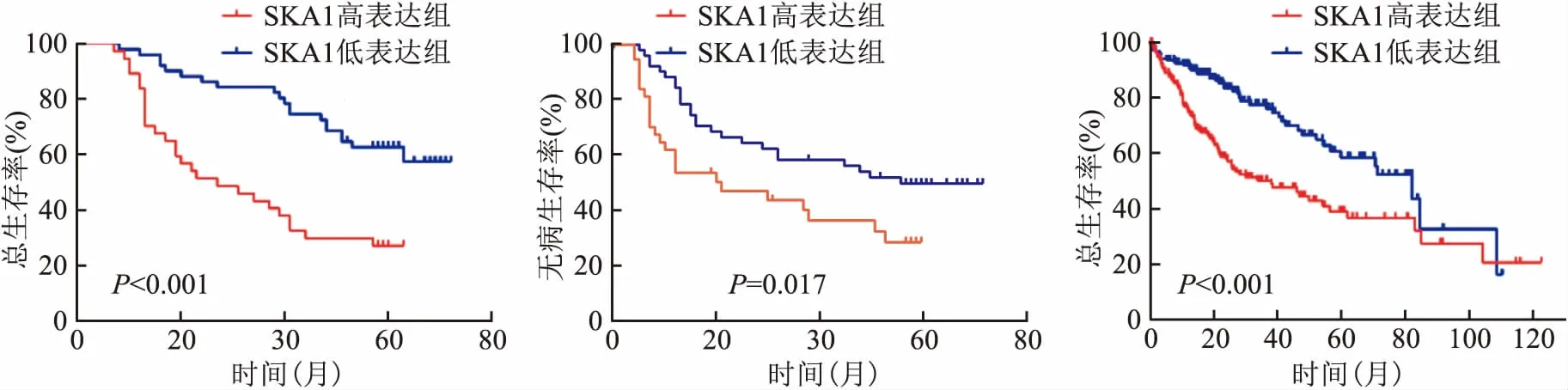
图3 SKA1的表达水平与HCC患者的OS和DFS有关
A:SKA1高表达组和低表达组OS的比较;B:SKA1高表达组和低表达组DFS的比较;C:在TCGA数据库中,SKA1高表达组和低表达组OS的比较

表1 SKA1的表达水平与HCC患者临床病理参数的关系
a:χ2检验
2.5 影响HCC患者OS和DFS的单因素和多因素生存分析单因素生存分析表明影响HCC患者OS的因素有SKA1的表达水平、肿瘤数目、ALT和肿瘤大小。将这些因素进行多因素生存分析时,SKA1的表达水平、肿瘤数目、ALT是HCC患者OS的独立危险因素。见表2。影响HCC患者DFS的因素有SKA1的表达水平、肿瘤数目、ALT和肿瘤大小,而多因素生存分析显示SKA1的表达水平不是影响HCC患者DFS的独立危险因素,ALT和肿瘤数目是影响HCC患者DFS的独立危险因素。见表2。
3 讨论
近年,SKA1在恶性肿瘤中的作用受到越来越多的关注。研究证实,SKA1参与肺癌[4]、胃癌[5]、肾癌[3]等恶性肿瘤的发生发展,并与甲状腺乳头状癌[7]和原发性唾液腺腺样囊性癌[8]预后相关。本研究在88对HCC和癌旁组织中分析SKA1的表达水平与患者病理参数和预后的关系。结果表明,高表达的SKA1与患者肿瘤的大小和不良预后相关。
异常的有丝分裂是大部分恶性肿瘤的共同特征。在有丝分裂中,染色体的分离需要丝粒在染色体和纺锤体微管之间生成物理连接,而SKA1参与构成的SKA复合体在这一过程中发挥着重要作用[3]。在胃癌细胞中敲除SKA1,细胞增殖明显受到抑制[5]。在非小细胞肺癌中,SKA1明显促进肿瘤细胞的增殖和转移,还可调节癌细胞对顺铂的敏感性[4]。Qin et al[6]研究表明在38例HCC组织和10例肝正常组织,SKA1在癌组织中高表达,但研究中收集的组织不是配对样本,所以存在一定的缺陷。本研究对88对HCC和相应的癌旁组织中的SKA1表达水平进行了检测,同时对TCGA数据库进行了分析,结果显示SKA1在癌组织中的表达水平明显高于癌旁组织。因此,本研究进一步证实了SKA1在HCC组织中高表达。
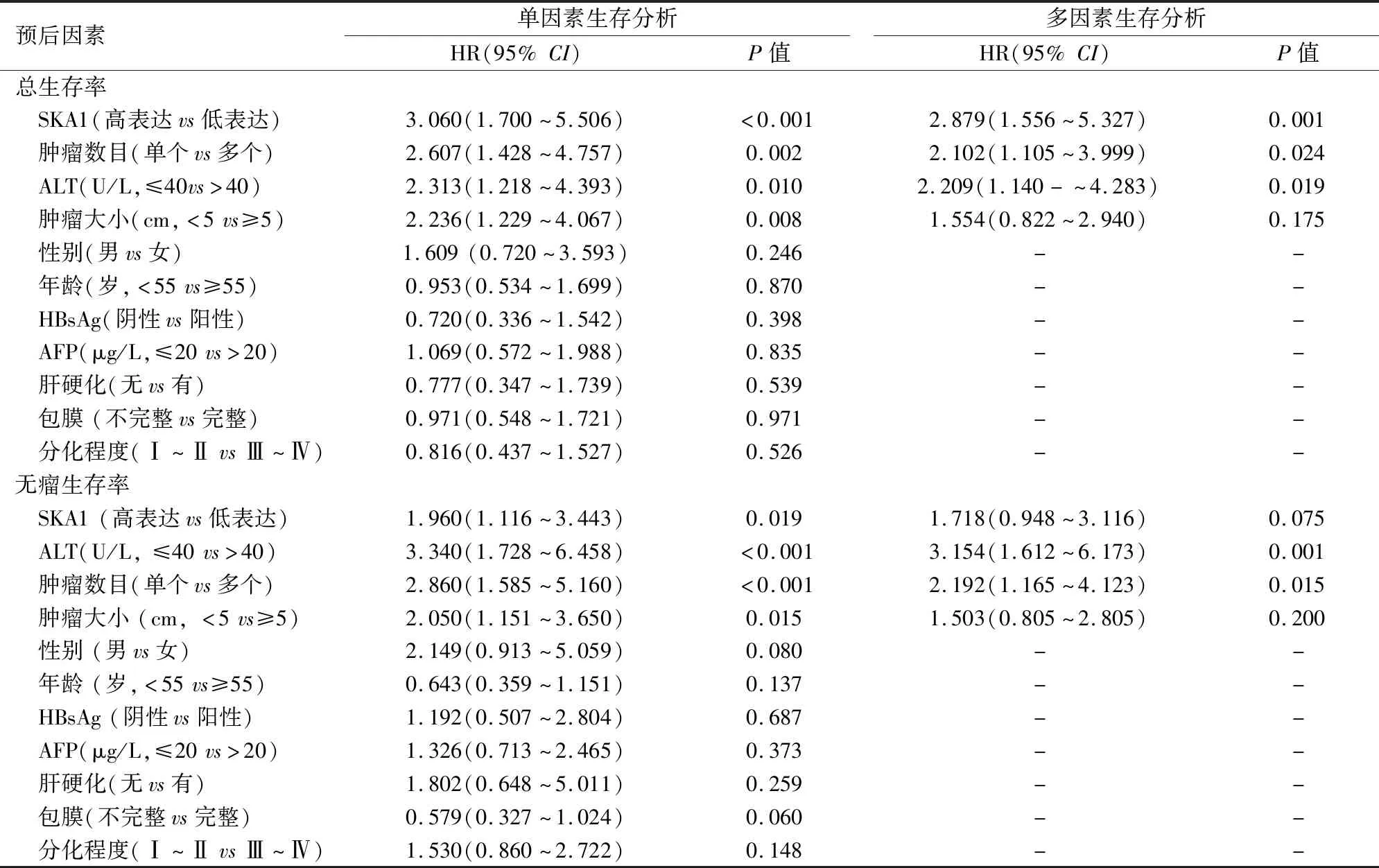
表2 HCC患者预后相关因素(单因素和多因素Cox比例风险回归模型)
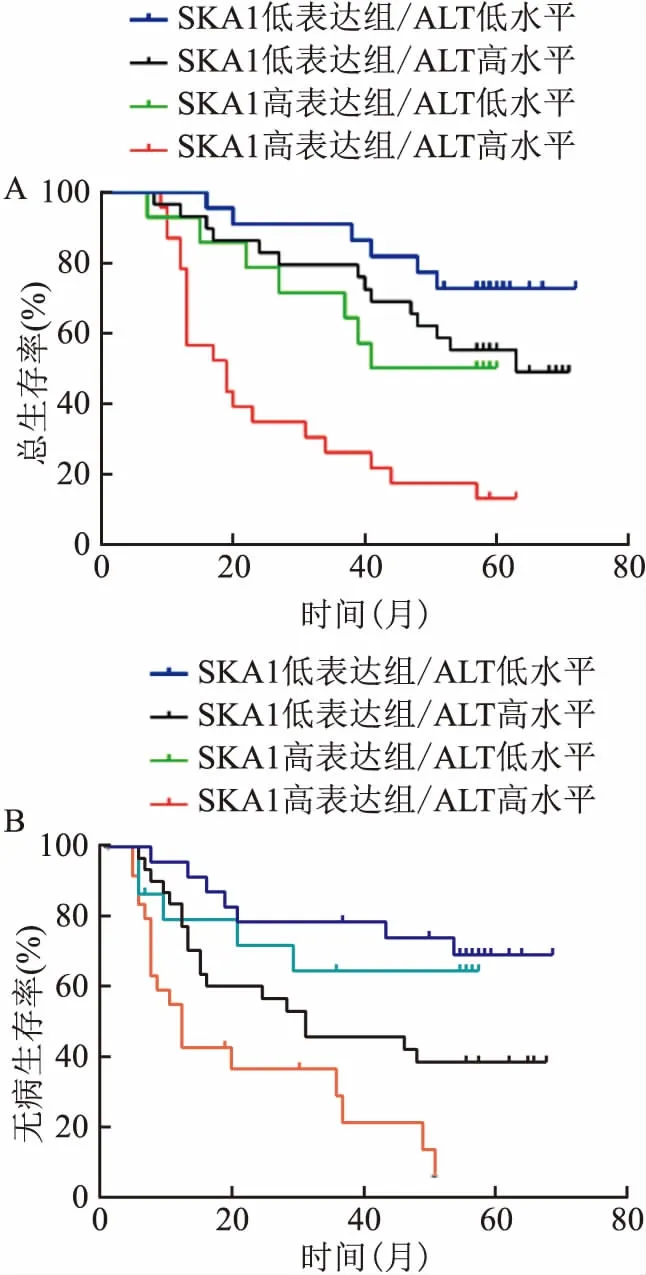
图4 SKA1在亚组中对HCC患者OS和DFS的影响
A:在ALT高水平和低水平亚组中,SKA1对HCC患者OS的影响;B:在ALT高水平和低水平亚组中,SKA1对HCC患者DFS的影响
SKA1与肿瘤的临床病理参数的关系在其他肿瘤中有报道。在甲状腺乳头状癌中,SKA1与患者的临床分期、甲状腺外浸润和淋巴结转移呈正相关[7]。原发性唾液腺腺样囊性癌中,高表达的SKA1与患者的病理分型和TNM分期有关[8]。然而,在HCC中,目前没有报道SKA1与临床病理参数的关系。本研究显示肿瘤大小与SKA1表达水平呈正相关性,在一定程度上,说明SKA1与肿瘤的增殖有关。
HCC是一种发病率和复发率极高的恶性肿瘤[2],寻找预测HCC的预后和复发的指标一直是此领域的研究热点[9-10]。在最近几年,SKA1被报道是甲状腺乳头状癌[7]和原发性唾液腺腺样囊性癌[8]的预后指标,但其是否是HCC的预后指标尚不明了。本研究中Kaplan-Meier生存分析表明SKA1高表达患者的OS比低表达患者的明显降低,SKA1低表达患者的DFS比高表达患者的明显增高。单因素和多因素生存分析显示SKA1的表达水平是影响患者OS的独立危险因素,而SKA1不是影响患者DFS的独立危险因素。

