TRPC1与硝苯地平及环孢素A诱导的牙龈增生的相关性研究
李楠楠,朱婷婷,李午丽,李 颂
药物性牙龈增生(drug induced gingival overgrowth, DIGO)是服用某些特定药物后口腔中发生的副作用,目前引起牙龈增生的药物主要有硝苯地平(nifedipine,Nif)和环孢素A(cyclosporin A,CsA)。临床上,服用CsA的患者易出现高血压等副反应,需同时服用降压药如Nif控制[1],这两种药物联合服用可能引起患者罹患更严重的牙龈增生[2]。尽管Nif和CsA的药理作用不同,但它们都能干扰细胞内钙的代谢[3-4],这可能是DIGO发病的关键原因。经典瞬时受体电位通道1(transient receptor potential channel 1,TRPC1)是非兴奋性细胞表面钙离子通道的重要组成元件,参与了牙龈角质细胞的分化[5]。牙龈成纤维细胞(gingival fibroblasts,GFs)作为牙龈增生反应的主要效应细胞,属于非兴奋性细胞, TRPC1可能参与了DIGO的发病。鉴于此,该实验用Nif和CsA单独及联合作用于体外培养的人牙龈成纤维细胞(human gingival fibroblast,HGF),检测HGF内TRPC1表达量的变化,初步探讨TRPC1在DIGO发病机制中的作用。
1 材料与方法
1.1 主要材料和仪器DMEM培养基购自美国Gibco公司;胎牛血清购自美国corning公司;胰酶消化液、RIPA 裂解液、蛋白酶抑制剂、磷酸酶抑制剂、PMSF、蛋白浓度测定试剂盒购自南通碧云天公司;硝苯地平购自美国sigma公司;苏木精、环孢素A购自北京索莱宝公司;兔抗人/鼠TRPC1多克隆抗体购自以色列alomone公司;凋亡标记分子B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)单克隆抗体购自美国santa cruz公司;山羊抗鼠、抗兔IGg抗体、通用SP9000试剂盒购自北京中杉金桥公司;CCK8试剂盒购自日本同仁公司;PCR引物购自上海生物工程股份有限公司;逆转录试剂盒、 Real Time-qPCR试剂盒购自日本TaKaRa公司;PVDF 膜购自美国Invitrogen公司;CO2恒温孵箱购自美国Thermo公司;实时荧光定量PCR仪购自美国Stratagene公司;酶标仪购自美国Bio-tek公司。
1.2 实验方法
1.2.1细胞体外培养 临床上收集的健康人牙龈组织,超净工作台中经取材液洗3遍,尽可能剪去上皮,再用PBS洗3遍,用眼科剪将组织剪成1 mm3大小的小组织块,然后将这些小组织块铺到6孔板中,加入200~300 μl含20%血清的完全培养液,待组织贴壁后,补液至2 ml。6 d后第一次换液,此后每3 d换一次液。待细胞爬至板底70%~80%时,进行传代培养。
1.2.2细胞鉴定 取P2代细胞制作细胞爬片,以波形蛋白(vimentin, Vim)和细胞角蛋白(cytokeratin,CK)抗体进行免疫细胞化学染色。
1.2.3CCK8检测药物对HGF增殖活性的影响 取P3代HGF,以3×103每孔的密度铺到96孔板中,待细胞贴壁后分别加入100 μl不同浓度的Nif (0、0.25、0.5、1.0、1.5、3.0 μg/ml)和CsA (0、0.05、0.1、0.2、0.4、0.8 μg/ml)溶液,混合组时CsA浓度为0.2 μg/ml,联合加入上述浓度梯度的Nif,每个浓度组设3个复孔,于培养箱中分别培养1、3、5、7 d,每孔加入10 μl CCK8液,培养箱中孵育4 h后,酶标仪测定450 nm处吸光度(optical density,OD)值。
1.2.4实时荧光定量PCR检测 取P2~P6代HGF,按空白对照组、溶剂组、Nif(1.0 μg/ml)组、CsA(0.2 μg/ml)组和Nif+CsA(1.0 μg/ml+0.2 μg/ml)组铺六孔板,每孔3×105个细胞,次日待细胞完全贴壁后,加入相应的药物刺激,培养箱中孵育1、3、5、7 d后,提取细胞总RNA,通过实时荧光定量PCR检测HGF内TRPC1、Bcl-2和PCNA的基因表达水平。按TRIzol试剂盒说明书提取各组细胞总RNA,使用PrimeScriptTM-PCR kit逆转录试剂盒逆转录成cDNA,然后以此为模板,用目标基因的引物进行扩增和检测。每个样品设置3个复孔,PCR的所有引物由上海生物工程公司进行设计合成,引物序列见表1。

表1 引物序列
1.2.5Western blot检测 取对数生长期HGF,按以上实验分组铺6孔板,每孔3×105个细胞,次日待细胞完全贴壁后,加入相应药物刺激,于培养箱中孵育1、3、5、7 d后,提取各组细胞总蛋白。BCA测定试剂盒测定各组蛋白浓度,调整各组浓度一致后,99 ℃、10 min使蛋白变性,10% SDS-PAGE凝胶电泳,然后转移至0.45 μm的PVDF膜上,5% BSA封闭液在室温条件下封闭1 h后,分别加鼠抗人PCNA 抗体(1 ∶1 000)、鼠抗人Bcl-2抗体(1 ∶1 000)、兔抗人/鼠TRPC1抗体(1 ∶400)、兔抗人 β-actin抗体(1 ∶2 000),4℃冰箱内孵育过夜,次日复温后加相应二抗(1 ∶5 000)室温孵育1 h,经ECL曝光成像。
1.2.6免疫细胞化学染色 取对数生长期HGF,按以上实验分组铺6孔板(含细胞爬片),每孔3×105个细胞,次日细胞完全贴壁后,加入相应的药物刺激,培养箱中孵育1、3、5、7 d后,用兔抗人/鼠TRPC1抗体进行免疫细胞化学染色,每组设3个重复组。
2 结果
2.1 HGF体外分离培养与鉴定体外组织块法分离培养HGF,约6~8 d观察到有细胞从组织块周围爬出,呈长梭形样细胞并成旋涡状排列,见图1。免疫细胞化学法结果显示,HGF表面抗原Vim抗体阳性,CK抗体阴性,见图2,表明此细胞是GFs。
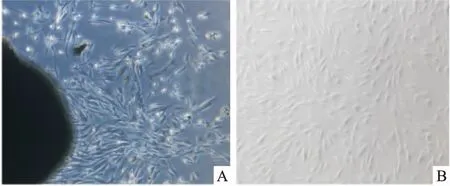
图1 HGF体外分离培养 ×50
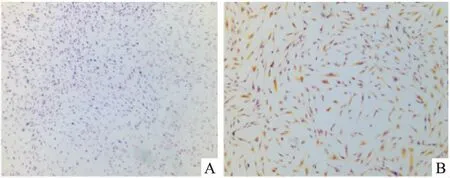
图2 免疫细胞化学染色法进行HGF表面抗原鉴定 ×50
2.2 单独及联合用药对HGF增殖活性的影响CCK8结果显示:与空白对照组相比,细胞培养7 d,1.0 μg/ml Nif,0.2 μg/ml CsA和1.0 μg/ml Nif+0.2 μg/ml CsA对HGF的促细胞增殖作用最明显(F=12.718、10.574、7.983,P<0.05),见图3。
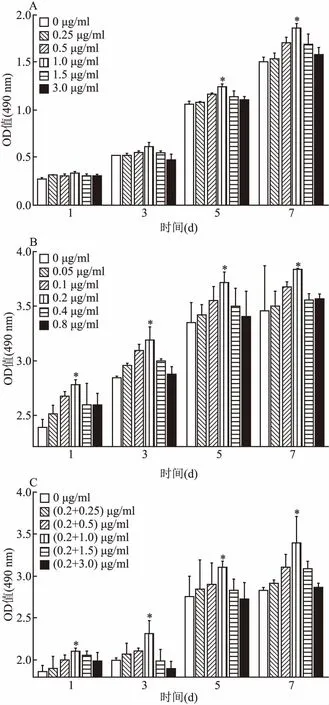
图3 CCK8法检测药物对HGF增殖活性的影响
A:Nif;B:CsA;C:CsA+Nif;与空白对照组(0 μg/ml)比较:*P<0.05
2.3 单独及联合用药对HGF PCNA、Bcl-2和TRPC1基因表达的影响实时荧光定量PCR分别检测1、3、5、7 d HGF内PCNA,Bcl-2和TRPC1基因的表达水平。结果表明:与空白对照组相比,PCNA基因的表达水平在Nif组、CsA组和Nif+CsA组差异均无统计学意义(F=1.615,P>0.05);Nif组和CsA组中Bcl-2基因的表达水平在1、3、5、7 d均明显增加,其中7 d时Nif组和CsA组中Bcl-2基因的表达相对于空白对照组分别是(1.271±0.061)和(1.348±0.050),差异有统计学意义(P<0.05);Nif+CsA组在5、7 d时,Bcl-2基因相对于空白对照组表达分别是(1.438±0.053)和(1.276±0.063),表达水平显著升高,差异有统计学意义(P<0.05); Nif组、CsA组和Nif+CsA组中TRPC1的表达水平随着时间的延长整体呈上升的趋势,差异有统计学意义(F=12.492,P<0.001),其中7 d时TRPC1基因在Nif组,CsA组和Nif+CsA组中的表达相对于空白对照组分别是(2.44±0.130)、(2.69±0.190)和(3.08±0.02),(P<0.05),且Nif+CsA组TRPC1基因表达水平最高(P<0.05),见图4。
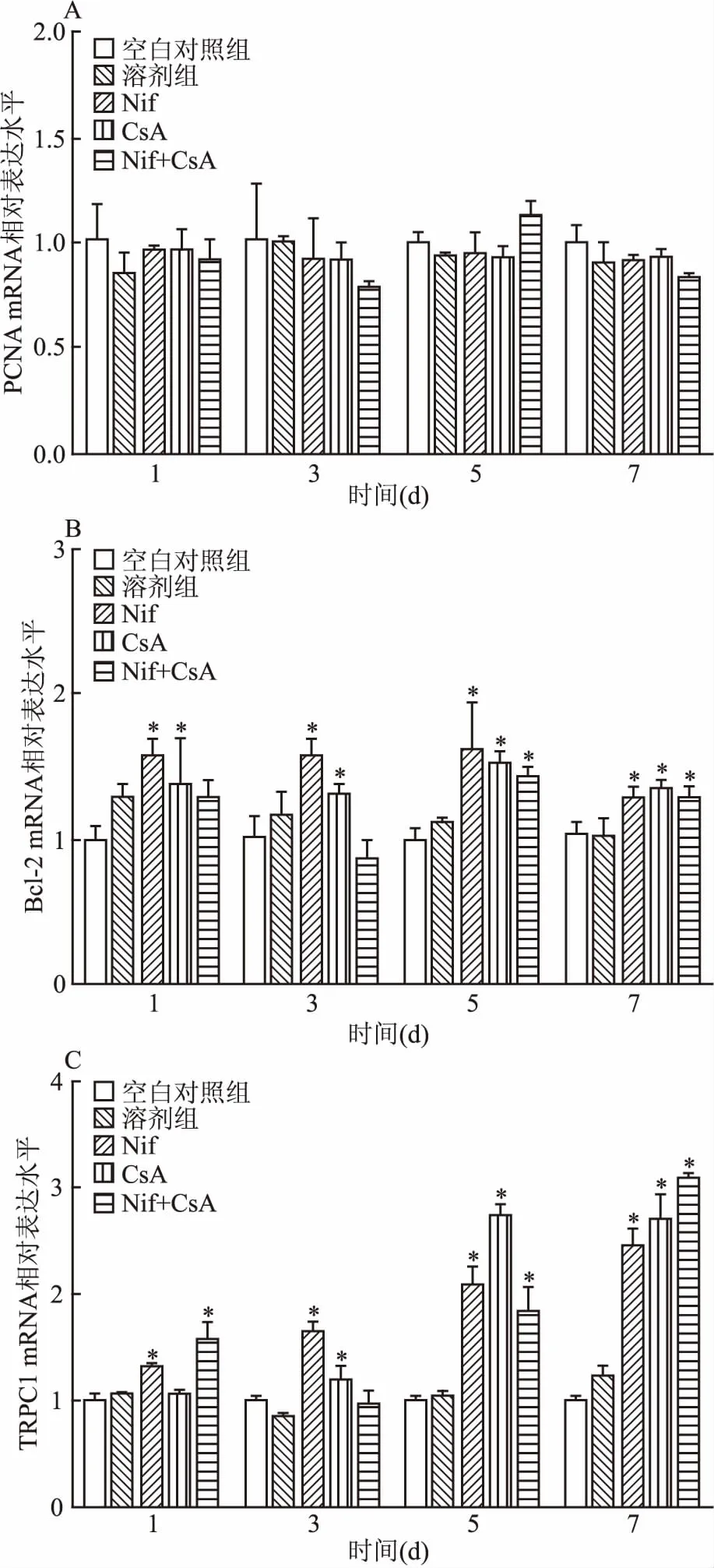
图4 Nif和CsA对HGF PCNA,Bcl-2和TRPC1基因表达的影响
A:PCNA;B:Bcl-2;C:TRPC1;与空白对照组比较:*P<0.05
2.4 单独及联合用药对HGF PCNA,Bcl-2和TRPC1蛋白表达的影响Western blot结果表明:各组PCNA蛋白表达水平无明显变化。空白对照组、溶剂组中Bcl-2和TRPC1蛋白表达水平较低,但在Nif组,CsA组和Nif+CsA组中的表达水平明显增加,而且具有时间依赖性,见图5。免疫细胞化学染色结果显示: TRPC1蛋白表达水平在空白对照组和溶剂组中较低,在Nif组、CsA组和Nif+CsA组中表达水平明显升高,见图6。
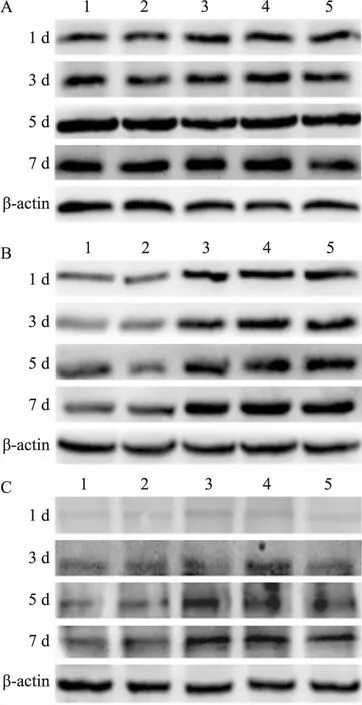
图5 Nif和CsA对HGF PCNA、Bcl-2和TRPC1蛋白表达的影响
A:PCNA;B:Bcl-2; C:TRPC1;1:空白对照组;2:溶剂组;3:Nif组;4:CsA组;5:Nif+CsA组
3 讨论
Nif和CsA是治疗高血压和器官移植术后防止免疫排斥的有效药物,但容易引起各种副作用如DIGO。而且当两种药物联合应用时,牙龈增生的程度明显加重[2],影响患者的生理和心理健康。但是目前对于DIGO的发病机制尚不明确,有研究[6]表明Nif能够升高GFs内的钙离子浓度,促进细胞的增殖,提示细胞内钙离子浓度的升高可能是钙离子拮抗剂诱导牙龈增生的扳机点。TRPC1是GFs这类非兴奋性细胞表面钙离子通道的主要作用元件之一,可能在DIGO的发病机制中发挥作用。本实验使用一定浓度的Nif和CsA单独及联合作用于体外培养的HGF,检测HGF表达TRPC1的变化情况,以期初步探讨TRPC1与DIGO发病的相关性。
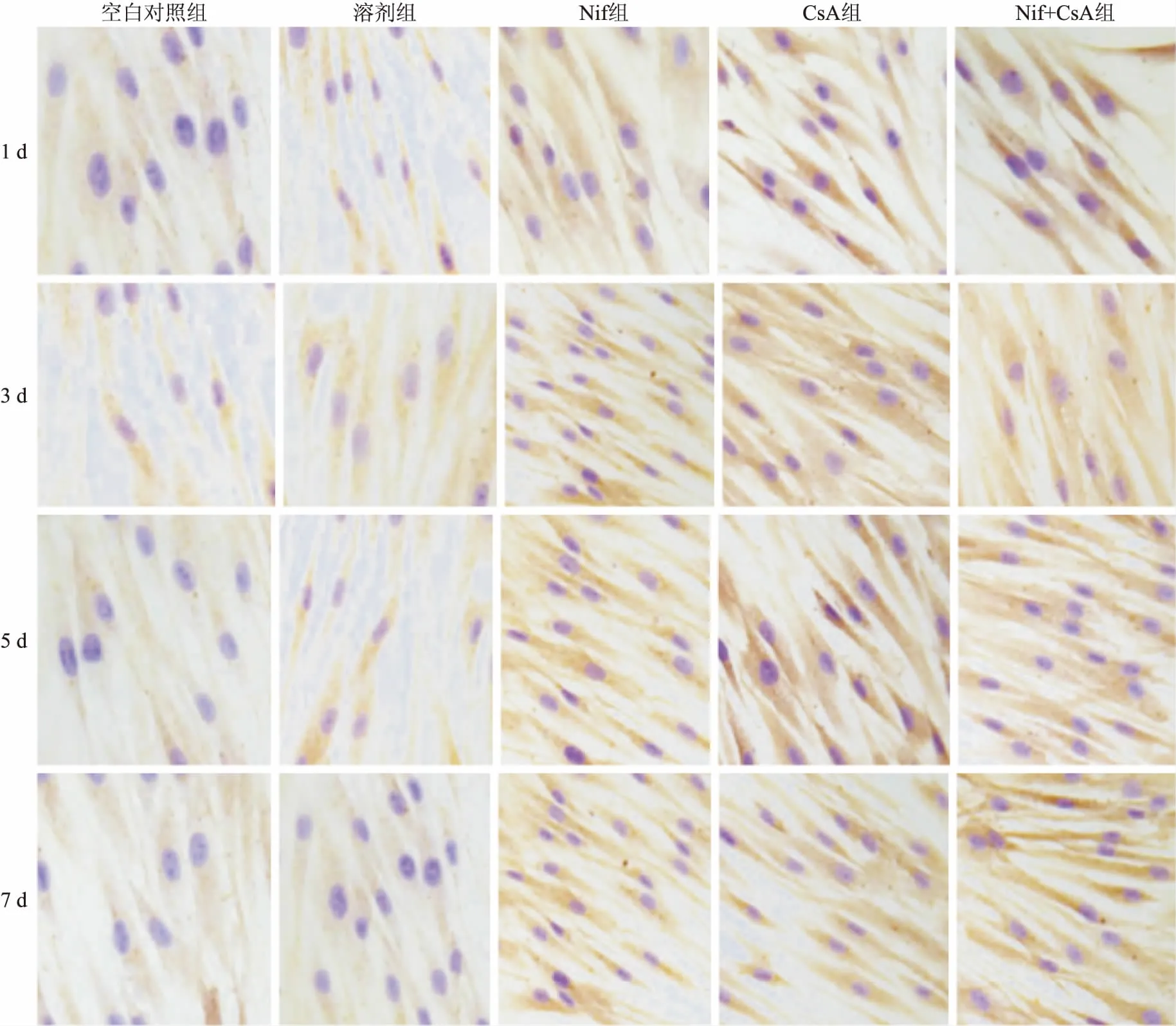
图6 免疫细胞化学染色法检测TRPC1在HGF中的表达 ×400
本实验CCK8结果显示1.0 μg/ml Nif,0.2 μg/ml CsA和1.0 μg/ml Nif+0.2 μg/ml CsA对HGF的促细胞增殖作用最明显,与Cotrim et al[7]和王艳春[8]的实验结果一致。本实验通过一定浓度的Nif, CsA和Nif+CsA作用于HGF,分别检测并比较了各组细胞PCNA和Bcl-2的表达水平。结果显示,HGF表达的PCNA不受Nif和CsA的影响,但Nif、CsA和Nif+CsA均可显著上调Bcl-2的表达,而且这种作用效果具有时间依赖性,表明Nif和CsA主要通过抑制细胞凋亡引起牙龈增生,而非促进细胞增殖,这与以往的研究结果类似[9-10]。这也验证了本实验条件下,GFs胞具有类似体内细胞增生的特性,可用于下一步分析相关基因的表达。
TRPC1 蛋白是最可能的钙库操纵的钙通道和受体操纵性钙通道的核心元件,参与细胞膜受体激活磷脂酶 C后所介导的钙离子进入。TRPC1还可以通过与其自身家族(例如,TRPC4和TRPC5)的相互作用形成不同类型的钙离子通道[11],这些TRPC通道可以产生在功能上不同的钙离子通道,有助于钙离子的转运和调节。TRPC1的表达变化可能会引起细胞质内钙离子浓度的变化,进而引起细胞增生。本实验结果表明,在Nif、CsA和Nif+CsA的刺激作用下,TRPC1的表达水平明显升高,并且这种作用效果随着时间的延长更加显著。 因此,TRPC1有可能在DIGO的发生进展中发挥一定的作用。Yang et al[12]研究显示,TRPC1在牙胚发育的钟状期和牙根形成期表达量较高,提示TRPC1可能与牙龈的发育有着密不可分的联系。另有学者报道[13],TRPC1与许多蛋白质包括离子通道亚基、受体和胞质蛋白相互作用,以介导其对钙离子信号传导的影响,并使其更有利于钙离子的信号调节。Nif和CsA均属于钙离子的拮抗剂,抑制钙离子的跨膜转运,导致胞质内钙离子浓度降低。它们长期作用于HGF,可能会引起HGF的胞质内钙离子浓度下降。TRPC1作为钙离子调节通道,感应到胞质内钙离子浓度降低,因此被促发转录和表达从而抑制细胞凋亡,引起细胞大量堆积,进而引起牙龈增生。
综上所述,本实验显示,在Nif和CsA单独及联合刺激作用下,HGF中的TRPC1蛋白表达水平升高,而且这种变化随着药物作用时间的延长更加显著,这提示TRPC1可能在DIGO相关细胞增殖和凋亡过程中发挥一定的作用。因此,进一步研究TRPC家族如何调节细胞质内钙离子浓度的变化以及如何调节细胞的生物学行为,将有利于深入理解DIGO的发病机制。

