矿区废弃地植物重金属抗性内生真菌的筛选及ITS序列分析
曾松荣,吴景婷,张翠琼,柯 野,郑秋桦
(韶关学院 英东生命科学学院,广东 韶关 512005)
尾矿库、废石堆等矿业废弃地生态修复的关键是植被恢复,因为植被恢复能够增加地表稳定性,控制重金属和水土流失,改善土壤的营养状况,改善矿区景观,因而具有良好的环境、生态、社会和经济等多方面的综合效益.然而尾矿库等矿业废弃地因为众多的理化因素,包括重金属毒性、极端的酸碱度、养分缺乏等,都会限制植物在废弃地上定居和生长,因此植被的自然恢复非常缓慢,必须对其采取积极的人工恢复措施加以干预,才能对土壤的重金属污染进行有效治理[1].本研究以粤北凡口铅锌矿废弃地的尾库矿及废石堆中优势植物的内生真菌作为研究对象,筛选出Pb、Zn抗性较高的内生真菌优势菌株,并通过对抗性菌株的形态学鉴定和ITS序列分析,确定抗性菌株的种属关系,为进一步对这些重金属抗性菌株进行促生作用筛选和盆栽促生试验奠定基础,也为探索内生真菌提高宿主植物重金属耐受性,以及对宿主植物的促生作用的机理和矿区废弃地的植被恢复,防止矿区废弃地水土流失、减轻重金属对周围环境造成的污染等工作提供依据.
1 材料与方法
1.1 材料
1.1.1 植物材料
采集粤北凡口铅锌矿废弃地尾库矿及废石堆的类芦(Neyraudia reynaudiana),艾草(Artemisia vulgaris),苦楝(Melia azedarach),苎麻(Boehmeria nivea),青葙(Celosia argentea),醉鱼草(Buddleja lindleyana)等 6 种优势植物带回实验室作为内生真菌分离的实验材料.
1.1.2 培养基
(1)PDA(Potato Dextrose Agar)培养基:马铃薯 200 g,琼脂粉 15~20 g,蔗糖 20 g,水 1 000 mL,121℃高压蒸汽灭菌20 min.(分离培养基需加入链霉素以抑制细菌生长).
(2)PDB(Potato Dextrose Broth)培养基:PDA培养基中不添加凝固剂琼脂粉.
(3)含氨苄的 LB(Luria-Bertani)培养基:氯化钠 10 g,蛋白胨 10 g,酵母膏 5 g,琼脂粉 15~20 g,水 1 000 mL,121℃高压蒸汽灭菌20 min,灭菌结束后,待LB培养基温度降至不烫手背时,以1 mL LB培养基加入1μL氨苄青霉素的比例加入,充分混匀,氨苄青霉素的浓度为100 mg/mL.
(4)查氏(Czapek)培养基:NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,蔗糖30 g,琼脂20 g,水1 000 mL,pH自然,121℃高压蒸汽灭菌20 min.
1.1.3 药品及试剂
UNIQ柱式真菌基因组抽提试剂盒、SanPrep柱式PCR产物纯化试剂盒、DNA CLONING VECTOR KIT(PMD19-T)、PCR 扩增试剂盒(Prime STAR Max)、PCR 扩增试剂盒(rTaq)、SanPrep 柱式质粒 DNA 小量抽提试剂盒、通用引物 ITS1(5‘-TCCGTAGGTGAACCTGCGG-3’)和 ITS4(5‘-TCCTCCGCTTATTGATATGC-3’)等均购自生工生物工程(上海)股份有限公司.硫酸锌、硝酸铅等化学试剂均为分析纯,产自天津大茂市化学试剂厂.
1.2 方法
1.2.1 植物内生真菌的分离
选取健康新鲜的优势植物的根部组织作为实验材料,用流水洗净后,沥干水分,剪成约2 cm长的小段,在超净工作台中置于75%的酒精中浸泡2 min后,再将根段置于0.1%的氯化汞溶液中浸泡5 min,无菌水冲洗3~5次,并分别保留最后一次冲洗的无菌水涂布平板以检验其根段表面是否杀菌彻底[2].
用无菌滤纸吸干水分,无菌解剖剪刀剪去根段两头,余下约1 cm的小段,分别按压于含重金属离子铅或锌的PDA平板上,25℃恒温培养箱中培养3~7 d,即可观察到根段样品剪切过的边缘有霉菌菌丝长出,丝状霉菌经纯化后转接到PDA斜面上培养好后置4℃冰箱保存备用.
1.2.2 重金属抗性菌株筛选
(1)将4℃冰箱保藏的六种优势植物内生真菌分别接到PDA平板上活化后,挑取其菌丝用于Pb、Zn重金属抗性菌株的筛选.使用PDB培养基,参照《土壤环境质量标准》(GB15618-1995)[3]设置培养基中Pb2+、Zn2+的浓度均为750 mg/L.在250 mL的三角瓶中装入25 mL配制好的铅或锌离子浓度的PDB培养基,分别接入植物内生真菌菌株.并做好重金属离子的空白对照.置于摇床上28℃、150 rpm,培养7 d.摇瓶结束后,4 000 r/min离心20 min,收集菌体,称其湿重.然后将称过湿重后的菌体放入培养皿中置于60℃烘箱中,直至恒重状态,称其干重.
(2)重金属耐受指数的测定
重金属耐受指数(TI)通过真菌生物量的干重来计算,公式:
耐受指数=(处理组菌丝干重/对照组菌丝干重)×100(%)[4],
以TI≥50%表示受试菌株对Pb2+或Zn2+具有抗性,反之无抗性[5].
1.2.3 重金属抗性菌株的形态学鉴定
将抗性菌株在查氏培养基培养3~5 d,分别观察它们的菌落形态特征及光学显微镜下的个体形态特征进行初步鉴定[6-9].
1.2.4 重金属抗性菌株的ITS序列分析
(1)内生真菌基因组的提取
将活化后的菌株转接于装有25 mL PDB培养基的250 mL三角瓶中28℃、150 rpm摇瓶培养,培养3~5 d.待菌丝球生长到一定的量后,用过滤的方法收集菌丝体,置于已灭菌的陶瓷研钵中,加入液氮将真菌菌丝研磨成粉末[10],然后按照UNIQ-10柱式真菌基因组抽提试剂盒说明书提取获取菌株基因组DNA,琼脂糖凝胶电泳鉴定后,置于-20℃保存或直接用于后续试验.
(2)ITS序列 PCR 扩增
使用Prime STAR Max(PCR扩增试剂盒),对提取的内生真菌基因组DNA进行ITS序列的PCR扩增,PCR 扩增,PCR 扩增体系如下:Prime STAR Mas 25 μL,DNA 模板 2 μL,ITS1 2 μL,ITS4 2μL,Sterilized dd H2O 19μL,总体积 50μL.
PCR 反应条件如下:98℃预变性 3 min,98℃变性10 s,55℃退火 15 s,72℃延伸 10 s,最后 72℃延伸 5 min,30个循环,16℃保温.PCR反应结束后,电泳检测ITS序列扩增结果后,采用SanPrep柱式PCR产物纯化试剂盒对PCR扩增产物进行回收.
(3)PCR回收纯化产物3’末端加碱基A
由于载体pMD19-T连接的PCR产物3’末端应有碱基A,而通过高保真酶(Prime STAR Max)PCR扩增出的ITS序列是平末端,为了提高连接效率,需先在扩增产物的3’末端加碱基A.将PCR产物全部转移到PCR管中,加入等体积的rTaq酶混合均匀,PCR反应条件如下:72℃ 5 min,72℃45 min,16℃保温.
对加碱基A的PCR产物进行回收,回收过程与PCR扩增产物的回收纯化相同.回收的产物用琼脂糖凝胶电泳检测PCR加碱基A产物回收的结果.
(4)ITS序列体外重组及转化
使用DNA CLONING VECTOR KIT载体试剂盒,将目的基因与载体pMD19-T连接.采用氯化钙法制备大肠杆菌DH5α感受态细胞,并将重组质粒转入感受态细胞.培养后,均匀涂布含氨苄青霉素的LB平板,培养15~20 h,从长出菌落的平板上各挑取多个单菌落分别接种至500μL含有氨苄青霉素的LB液体培养基中进行培养[11].
(5)阳性克隆的筛选
通过菌液PCR技术验证是否为阳性克隆菌.使用M13引物,上下游引物各0.8μL;rTaq酶10μL;菌液1.6μL;加入 ddH2O 6.8μL 补足,制成 20 μL 的反应体系.PCR 反应条件为:94℃ 3 min,94℃ 1 min,55℃ 30 s,72℃ 2min,30 个循环,72℃ 5 min,16℃保温.
电泳检测菌液PCR的结果后,将阳性克隆菌进行扩大培养:每25 mL的LB培养基中加入25μL氨苄青霉素和200μL菌液,120 rpm,37℃摇甁培养12~16 h后做成冻存管送往生工生物工程(上海)股份有限公司测序.
(6)序列测定和系统发育树的构建
采用双向测序法.测序结果为2条序列,互补部分可用DNAMAN进行拼接,通过BioEdit软件查找上下游引物的位置,并切除引物以外的序列,得到所需的ITS序列.将得到的ITS序列在NCBI数据库中进行BLAST,选取若干个与该序列同源性较高的序列,利用MEGA 7.0软件的邻位法(Neighbor-Joining Method)构建系统发育树,进一步确定重金属抗性菌株的种属关系[12].
2 结果与分析
2.1 内生真菌的分离
挑取PDA平板中六种植物根部组织块周围的霉菌菌丝,在PDA平板上三点接种进行分离纯化.共得到92株内生真菌,转接到斜面4℃冰箱保存.由最后一次清洗植物根段的无菌水涂布PDA平板作为对照,没有菌落生长,说明植物根段表面已经杀菌彻底,分离得到的真菌都是根部内生真菌.
2.2 抗重金属内生真菌的筛选结果
从6种植物中筛选得到的抗重金属离子Pb2+与Zn2+能力强的菌株,如表1所示.

表1 六种优势植物内生真菌在一定Zn2+和Pb2+浓度下的TI值
结果显示,筛选得到重金属抗性菌株共有19株,其中艾草4株、苦楝6株、苎麻1株、青葙4株、醉鱼草4株、类芦0株,并且有部分菌株TI>100%,这些菌株在重金属环境下比没有重金属的环境下生长更加好.表明一些土著真菌在长期持续的土壤重金属这种非生物胁迫环境中对重金属有了明显的适应,有毒的金属甚至有可能被这些抗性菌株作为微量营养元素.因此,把这些对重金属胁迫适应的真菌接种到植物,对重金属污染土壤的植物修复是有益的[13].
2.3 重金属抗性菌株的鉴定结果
2.3.1 重金属抗性菌株的形态学鉴定

图1 部分内生真菌的菌落形态
部分重金属抗性菌株在查氏培养基中的菌落形态,如图1所示.依据丝状真菌的菌落形态和菌体的个体形态特征,对重金属抗性菌株进行初步鉴定,见表2.

表2 重金属抗性菌株的形态鉴定结果
鉴定结果表明,分离纯化的19株重金属抗性菌株中的15株分别属于曲霉属(Aspergillus)、镰刀霉属(Fusarium)、木霉属(Trichoderma),WB-3、QXG-13、ZYC-11 和 ZYC-17 等 4 个菌株因孢子或子实体的结构特征不明显,无法用形态学鉴定.
2.3.2 重金属抗性菌株的分子生物学鉴定
霉菌的ITS序列的PCR产物与克隆载体16℃连接过夜,导入感受态细胞大肠杆菌DH5α中,培养后涂布含100μg/mL Amp的LB平板,生长情况良好,见图3.将挑选的单菌落至500μL含Amp(100μg/mL)的LB液体培养基中,摇床培养8~10 h.再进行菌液PCR验证,得到约750 bp的目的条带,见图4.

图3 重组受体菌在含Amp的LB上生长

图4部分抗性菌株基因组PCR产物电泳图
2.4 抗性菌株的ITS测序结果和构建系统发育树
将测序得到的ITS序列在NCBI数据库中进行BLAST对比,19株真菌ITS序列同源性如表3所示.

表3 19株内生真菌的ITS序列同源性
选取多个与测序得到的ITS序列同源性较高的序列,利用MEGA 7.0软件的邻位法(Neighbor-Joining Method)构建系统发育树[14].结果如图 5所示,图中分支上的数字表示树形置信度,括号内为NCBI数据库登录号.
ITS序列分析结果表明,19株重金属抗性菌株分属于曲霉属(Aspergillus)、镰刀霉属(Fusarium)、篮状菌属(Talaromyces)、微皮伞 属 (Marasmiellus)、木霉属 (Trichoderma)等5个属,其中15个菌株已被鉴定到种,QXG-12、ZYC-11、ZYC-17 和 QXG-13等4个菌株只能暂定到属,它们的种名有待进一步鉴定.
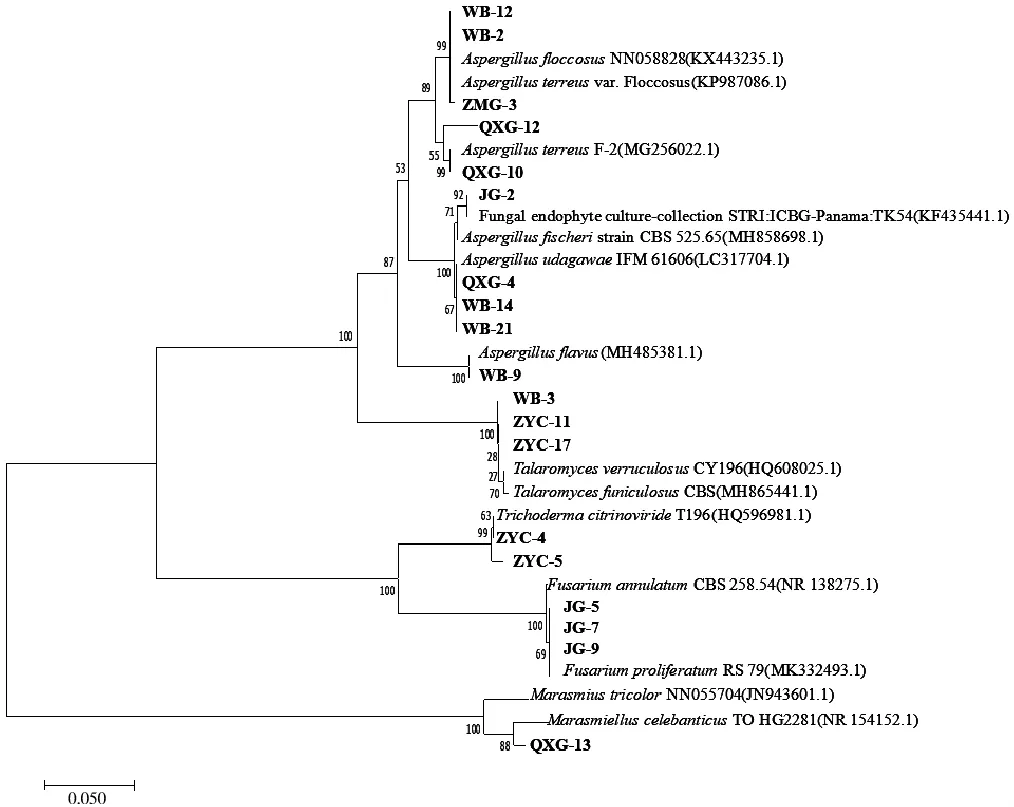
图5 基于ITS序列构建内生真菌系统发育进化树
3 结论
从矿区废弃地艾草、苦楝、苎麻、青葙、醉鱼草、类芦等六种优势植物的根部组织分离到92株内生真菌,从中筛选出抗重金属离子Pb2+与Zn2+能力较强内生真菌19株,分别属于5个属,其中15个菌株已鉴定到种,另有4个菌株暂定到属,并有1株QXG-13为国内甚少报道的隶属于担子菌的微皮伞属(Marasmiellus)[15].说明重金属抗性菌株中除了一些小型的丝状霉菌外,也存在具有大型子实体的担子菌.研究结果表明,矿区废弃地植物重金属抗性内生真菌中除了一些小型的丝状霉菌外,也存在具有大型子实体的担子菌,并显示重金属抗性菌株具有一定的多样性.
丝状霉菌的传统鉴定方法往往是以其形态学特征为基础,但基于形态学表型特征的鉴定则容易出现误判,因此对操作者的经验和熟练程度要求较高.有些丝状霉菌为不产孢子的无孢类群,缺乏孢子和子实体等结构的分类特征,因此种属鉴定就更加困难.本研究先采用霉菌的形态学进行初步鉴定,然后在此基础上进行ITS序列分析,将所得序列进行Blast同源比对,为内生真菌的菌种鉴定提供更进一步的科学依据[16-17].

