气相色谱法同时测定贝类中15种持久性有机污染物残留量
杜静,黄会,张华威,罗晶晶,宫向红,张秀珍*
(1. 山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台264006; 2. 上海海洋大学食品学院,上海201306)
有机氯农药(organochlorine pesticides,OCPs)是一类广谱杀虫剂类农药,曾被世界广泛使用。其中,六六六(hexachlorocyclohexane,HCH)和滴滴涕(dichlorodiphenyl trichloroethane,DDT)使用早[1],用量大。多氯联苯(polychlorinated biphenyls,PCBs)是一种高残毒的持久性有机污染物(persistent organic pollutants, POPs),曾被广泛应用于染料、塑料和油漆等工业产品中[2]。OCPs和PCBs性质稳定,且半衰期长,不易降解,近年的研究[3-7]证实了其在土壤、水、食品及人体中广泛存在。OCPs和PCBs均具有脂溶性,能够在生物体脂质中大量富集,因此,OCPs和PCBs对生态环境和食品安全的影响已引起了广泛关注。贝类等生物体中的OCPs和PCBs可通过食物链进入人体,造成潜在的危害,已有研究证明长期暴露于DDTs、PCBs等物质的环境中,会导致哺乳动物产生生殖毒性[8-10]、遗传毒性[11]、神经毒性[12]和免疫毒性[10]等,因此,精准检测OCPs和PCBs残留十分重要。目前,贝类中OCPs和PCBs检测的研究主要集中在分别对OCPs和PCBs进行残留检测方面,而对同时测定OCPs和PCBs残留的研究较少。本研究拟采用超声波提取技术及液液萃取-凝胶净化-固相萃取联合净化处理方法,旨在减少人工操作的误差,提高萃取净化的重现性及精确度,以更好地萃取和净化样品中目标化合物、分离杂质,并通过气相色谱-电子捕获检测器(GC-ECD)精准检测贝类中15种OCPs和PCBs的残留量。
1 材料与方法
1.1 仪器与试剂
主要仪器包括:气相色谱仪(6890N,配电子捕获检测器,美国Agilent公司);Milli-Q Gradient超纯水仪(法国Millipore公司);H2050R高速冷冻离心机(长沙湘仪离心机仪器有限公司);VORTEX 4旋涡混匀器(德国IKA公司);Laborota4001旋转蒸发仪(德国Heidolph公司);KQ-600E超声波清洗器(昆山市超声仪器有限公司);Accuprep Mps凝胶色谱仪(美国J2 Scientific公司);N-EVAPTM112氮吹仪(美国Organomation Associates公司)。
主要试剂包括:丙酮、正己烷、乙酸乙酯(色谱纯,美国Merck公司);环己烷(色谱纯,美国Tedia公司);无水硫酸钠(农残级,无需烘烤,直接使用,上海晶纯生化科技股份有限公司);实验用水均为经Millipore超纯水仪制备的超纯水。
20 g/L硫酸钠溶液:称取20.00 g硫酸钠,用超纯水溶解后定容到1 000 mL容量瓶。
8种有机氯农药标准品(α-666纯度为≥99.5%、β-666纯度为≥97.5%、γ-666纯度为≥98.6%、δ-666纯度为≥99.6%、p,p′-DDE纯度为≥98.5%、o,p′-DDT纯度为≥98.0%、p,p′-DDD纯度为≥99.0%、p,p′-DDT纯度为≥98.5%),和7种指示性多氯联苯标准品(PCB28、PCB52、PCB101、PCB118、PCB153、PCB138及PCB180,其中PCB138纯度≥99.3%,其余PCB纯度≥99.0%),均为德国Dr. Ehrenstorfer公司产品。
标准溶液的配制:分别准确称取适量标准品,用正己烷溶解,定容至100 mL,配制成100.00 mg/L单标储备液,再通过逐级稀释,配制成100.00 μg/L混合标准使用液,于4 ℃冰箱中避光保存。
凝胶色谱柱为玻璃柱(300 mm×25 mm);凝胶填料为Bio Beads(S-X3),200-400目,25 g;固相萃取柱为BE硅胶柱(1 mg/6 mL),美国Agilent公司。
1.2 样品前处理
1.2.1 样品的提取
称取10 g(精确到0.01 g)新鲜贝类匀浆样品于250 mL具塞三角烧瓶中,加入30 mL丙酮,振荡混匀,室温下超声提取20 min,静置30 min。上清液用滤纸过滤至分液漏斗中,残渣再用20 mL丙酮提取10 min,静置10 min,再次如上过滤,合并提取液,用于下一步净化。
1.2.2 液液萃取净化
向分液漏斗中加入硫酸钠溶液60 mL,正己烷30 mL,振摇1 min。静置分层后弃去下层水相,正己烷层经无水硫酸钠脱水。用10 mL正己烷分两次洗涤分液漏斗,并经无水硫酸钠脱水,最后用5 mL正己烷淋洗无水硫酸钠。收集全部正己烷置于鸡心瓶内。40 ℃旋蒸浓缩至近干。
1.2.3 凝胶渗透色谱净化
向鸡心瓶中加入10 mL乙酸乙酯-环己烷(1∶1,V/V),在旋涡仪上溶解残留物,4 000 r/min离心15 min,清液经凝胶渗透色谱装置净化,收集于鸡心瓶内,收集时间为10~16 min。旋蒸浓缩至近干。加入1 mL正己烷,在旋涡仪上混匀1 min。
1.2.4 固相萃取净化
硅胶柱用8 mL丙酮活化,用泵抽干后,再用4 mL正己烷活化,液面降至柱床表面时,将1.2.3所得样品溶液转移到柱上,流出液不收集,不抽干柱子。用10 mL正己烷-丙酮(85∶15,V/V)洗脱,收集洗脱液于离心管中,柱子不抽干,洗脱液氮吹至干,加1 mL正己烷溶解,旋涡1 min,超声1 min,待GC分析。
1.3 测定
色谱柱为DB-5毛细管色谱柱(30.00 m×0.25 mm,0.25 μm);进样口温度230 ℃,不分流进样,进样量1 μL;载气(N2)流速1.0 mL/min;检测器温度300 ℃。升温程序:初始温度100 ℃;以21 ℃/min升至200 ℃,再以4 ℃/min升至230 ℃,保持3.5 min;以25 ℃/min升至280 ℃,保持5 min。
2 结果与分析
2.1 前处理优化
2.1.1 提取溶剂的优化
预实验选择正己烷做提取剂,发现仅用正己烷提取,部分化合物如δ-666回收率低于60%。经实验,采用丙酮进行提取,与正己烷-丙酮(1∶1,V/V)的提取效果相当,得到了很好的提取效果,对有机氯农药和多氯联苯残留的平均回收率较理想。综合考虑基体干扰、样品浓缩和试剂节省等因素,选择丙酮作为最佳提取溶剂。
2.1.2 联合净化方法的优化
本实验对2种小柱的净化效果和回收率作了比较,发现Silica硅胶柱的回收率较高,净化效果较好。采用不同样品净化柱和不同比例正己烷-丙酮混合溶剂洗脱净化后15种POPs的回收率如图1所示,发现选择硅胶柱净化,同时洗脱剂正己烷-丙酮的体积比为85∶15时,所有POPs的回收率都能达到75%以上,可能是在该比例下,溶剂的极性最适,较少的色素分子能够与洗脱剂结合,洗脱时色素吸附在硅胶柱内,而同时有较多的目标化合物被洗脱剂带出。凝胶净化-固相萃取技术联用互补,消除了大部分的干扰物质,目标待测物的信噪比显著提高,从而大大提高了目标物检测的灵敏度,同时有效避免了杂质对仪器的损害。
2.1.3 色谱条件的优化
当温度以10 ℃/min速度升至230 ℃时,o,p′-DDT和p,p′-DDD不能完全分离(图2),选择以4 ℃/min升至230 ℃,保持3.5 min,o,p′-DDT和p,p′-DDD分离完全。在1.3的色谱分析条件下,15种目标物均得到了良好的分离,各组分峰形对称性比较好,保留时间适宜,且有效避免了样品中杂质组分的干扰,15种目标物的标准溶液色谱图见图3。四角蛤蜊(Mactraveneriformis)空白及其加标样品色谱图见图4、图5。空白样品的净化效果较好,色谱图杂峰少,且不影响目标化合物的分析。加标样品色谱图各组分峰形对称性较好,分离完全。
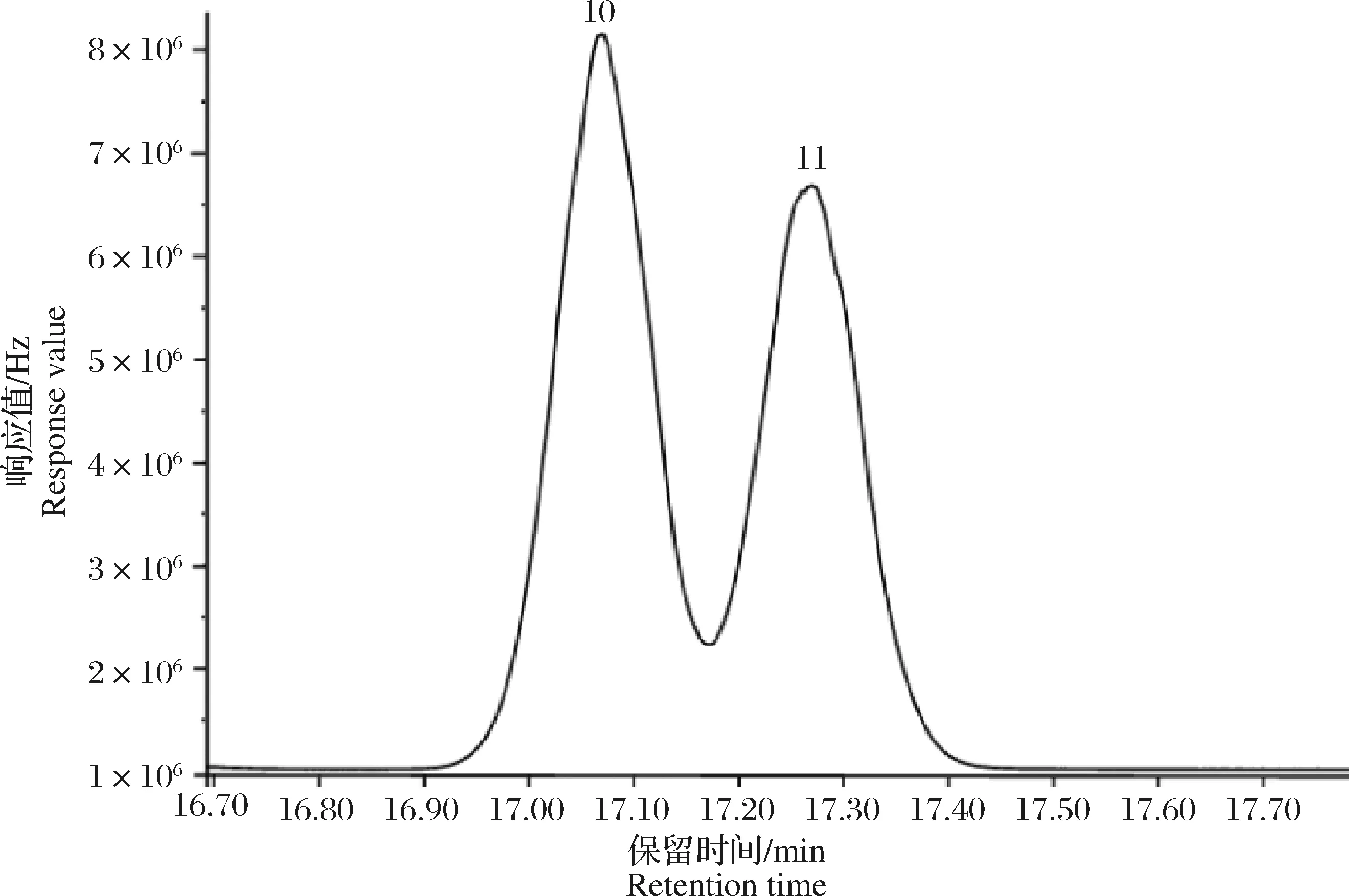
图2 峰分离不完全的GC-ECD色谱图(100 μg·L-1)Fig.2 GC-ECD chromatograms of incomplete peak separation (100 μg·L-1) 10) o,p′-DDT; 11) p,p′-DDD.
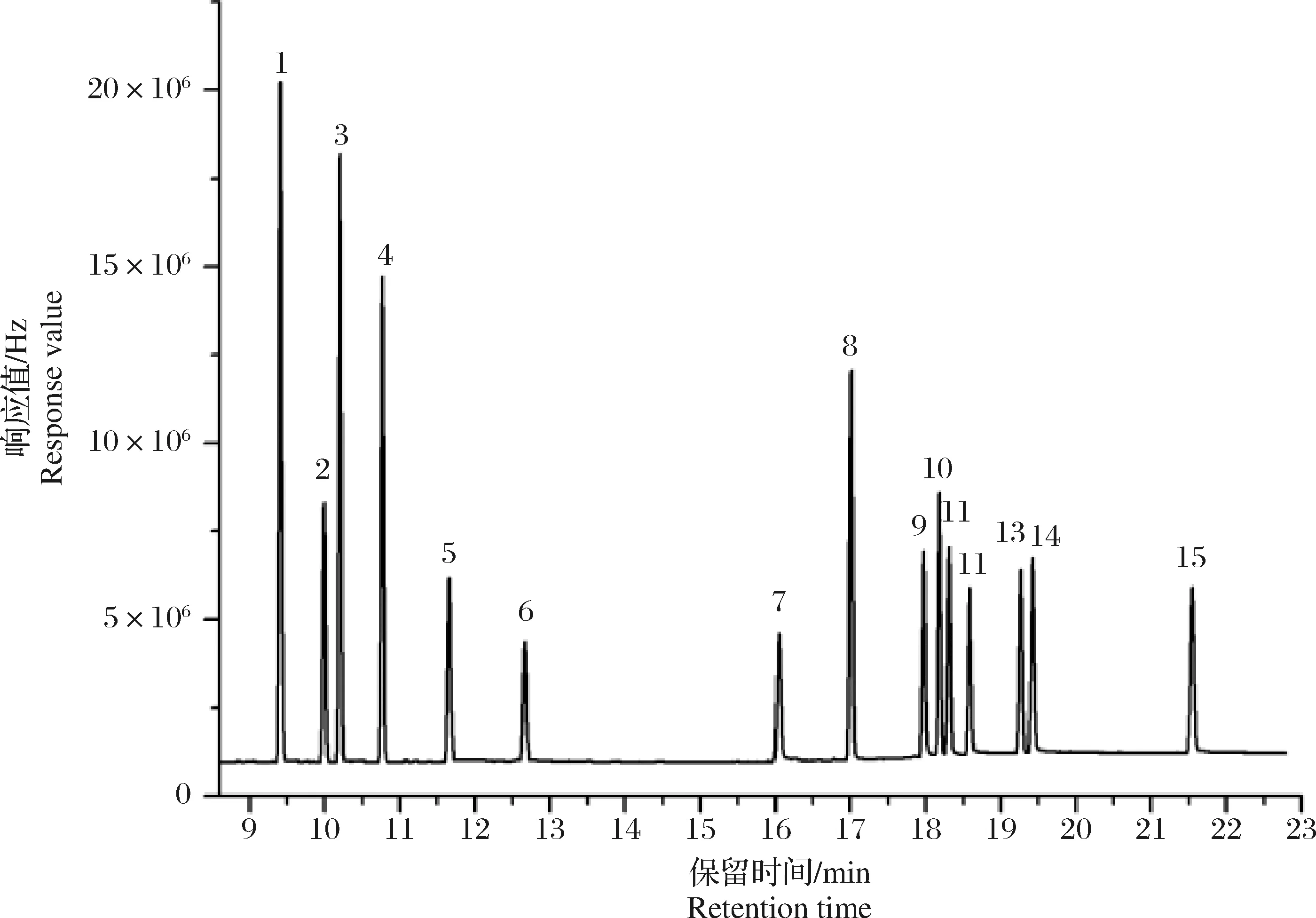
图3 GC-ECD测定的8种有机氯农药和7种指示性多氯联苯混合标准溶液色谱图(100 μg·L-1)Fig.3 GC-ECD chromatograms of 8 organochlorine pesticides and 7 polychlorinated biphenyls standard solution (100 μg·L-1)1) α-666; 2)β-666; 3)γ-666; 4)δ-666;5) PCB28; 6) PCB52; 7) PCB101; 8) p,p′-DDE;9) PCB118; 10) o,p′-DDT; 11) p,p′-DDD;12) PCB153; 13) p,p′-DDT; 14) PCB138; 15) PCB180. The same below.
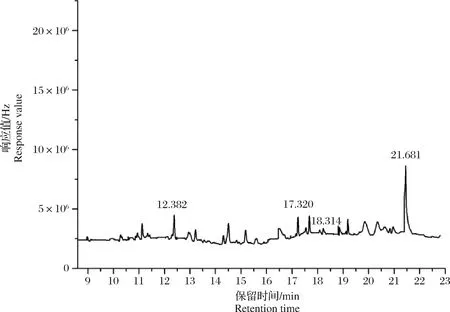
图4 四角蛤蜊空白样品色谱图Fig.4 Chromatograms of Mactra veneriformis blank sample
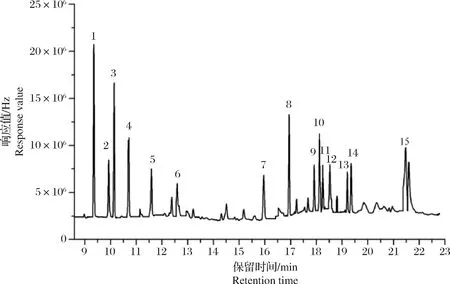
图5 四角蛤蜊加标样品色谱图(100.00 μg·L-1)Fig.5 Chromatograms of Mactra veneriformis spiked sample (100.00 μg·L-1)
2.2 定性分析方法
通过比较样品与标准溶液色谱图的保留时间定性,样品色谱峰保留时间与标准溶液保留时间的偏差≤(±0.5%)。各化合物的保留时间见表1。
2.3 方法的线性范围与检出限
15种目标物标准储备液用正己烷稀释,分别配制成1.00、2.00、5.00、10.00、20.00、50.00和100.00 μg/L 7个浓度梯度的标准系列溶液,在上述优化的色谱条件下进行GC-ECD测定后,以峰面积为纵坐标、相应的质量浓度为横坐标,制作标准曲线。以S/N=3时计算检出限(LOD),S/N=10且回收率在60.1%~111.0%范围内计算定量限(LOQ)。结果表明,15种目标化合物在1.00~100.00 μg/L质量浓度范围内与其响应值呈良好的线性关系,相关系数(r)高于0.995 0,15种POPs的检出限为0.3~0.8 μg/kg,定量限为1.0~2.0 μg/kg(表1)。
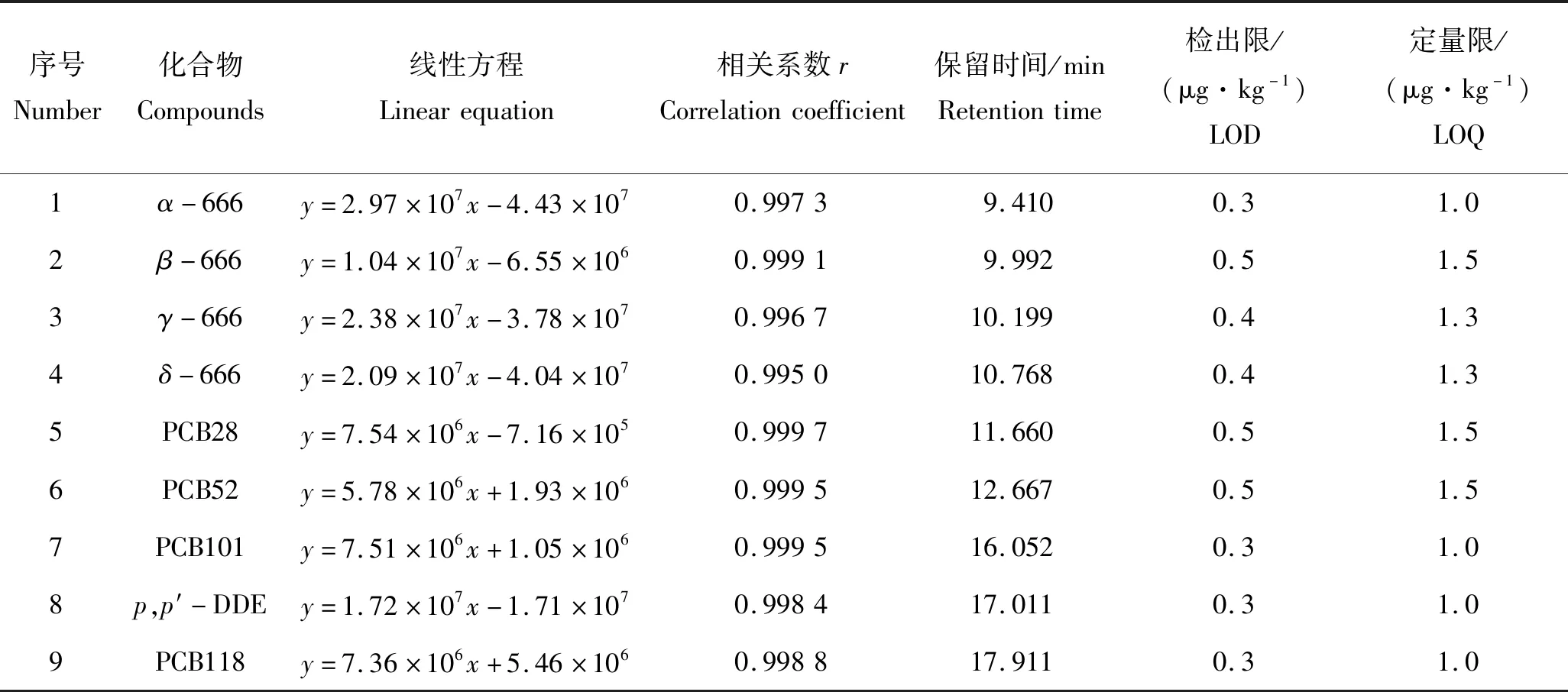
表1 15种有机氯农药和多氯联苯的线性方程、相关系数、保留时间及检出限(LOD)、定量限(LOQ)Tab.1 Linear equations, correlation coefficients, retention times, limit of detection (LOD) and limit of quantitation (LOQ) for 15 organochlorine pesticides and polychlorinated biphenyls
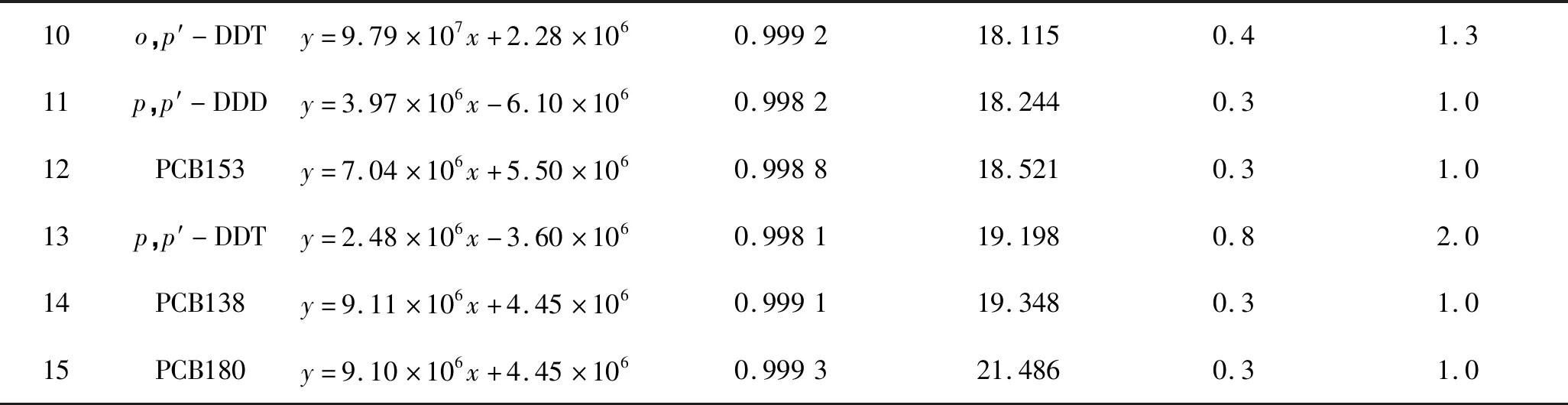
续表1,Tab.1 Continued
2.4 回收率与精密度
称取若干四角蛤蜊空白样品10.00 g(精确到0.01 g),分别取100.00 μg/L的混合标准工作溶液200、500和1 000 μL添加到空白样品中,进行2、5和10 μg/kg共3种质量浓度水平的添加,每个水平平行测定6次,进行加标回收率和精密度实验,结果见表2。由表2可知,3个加标质量浓度下,加标回收率的范围为60.1%~111.0%,相对标准偏差在1.7%~9.8%之间,表明该方法的准确度和精密度能满足对OCPs和PCBs残留分析的要求。
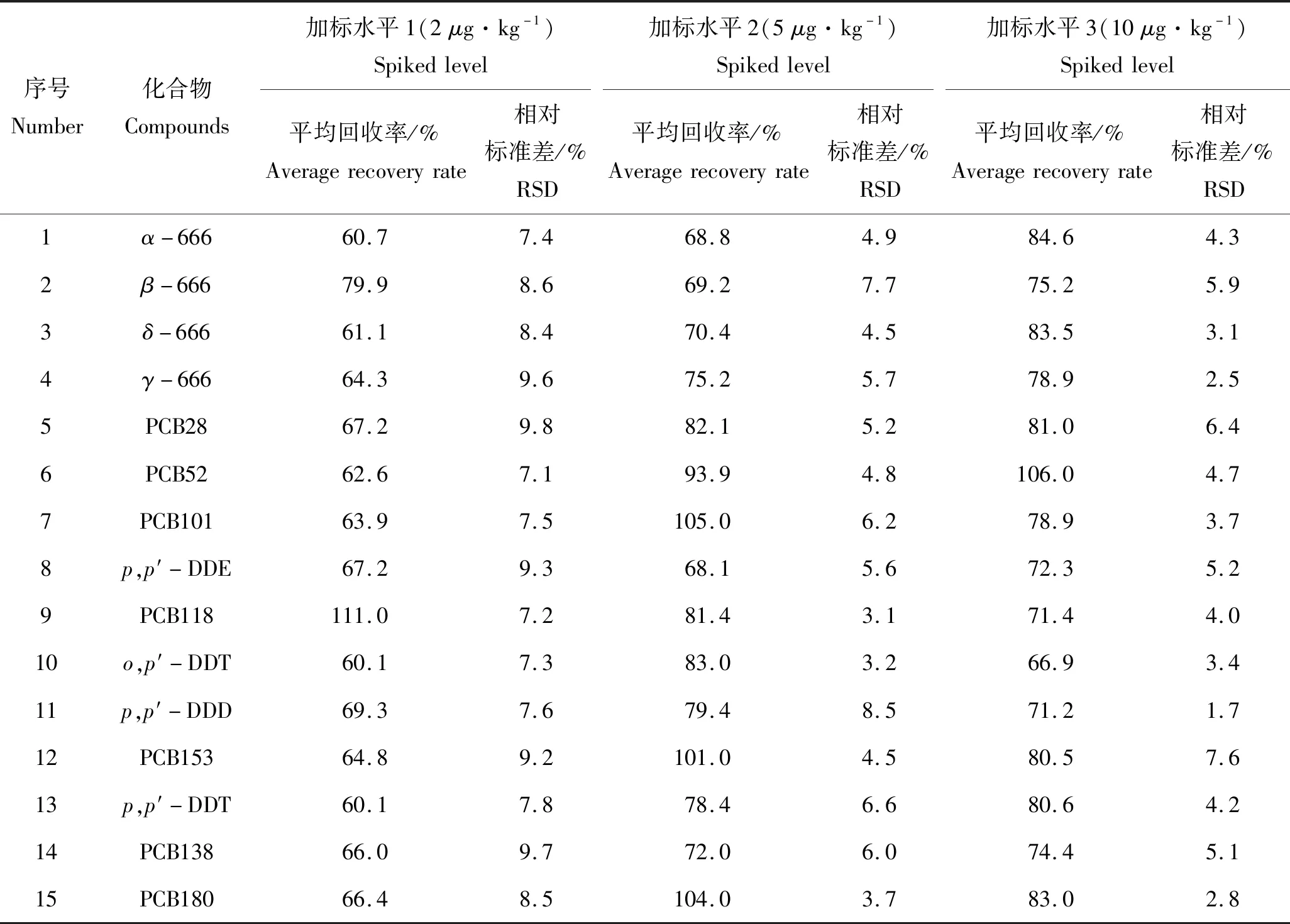
表2 不同加标水平下贝类样品中15种有机氯农药和多氯联苯的平均回收率和相对标准偏差Tab.2 Average recovery rates and relative standard deviation (RSD) of 15 organochlorine pesticides and polychlorinated biphenyls in shellfish samples n=6
2.5 实际样品检测
用本方法检测2017年8月山东省沿海牡蛎(Crassostreagigas)等15个贝类样品中8种有机氯农药和7种指示性多氯联苯的残留含量,结果表明样品中的HCHs、DDTs和PCBs的总体检出率分别为73.3%、100.0%和100.0%,检出率最高的是p,p′-DDE,其在所有样品中均有检出(表3),实际样品检测仅代表检测方法可行性,因采样数有限并不表示山东沿海地区污染现状,针对有机氯农药及多氯联苯的残留现状调研,仍需进一步调查。
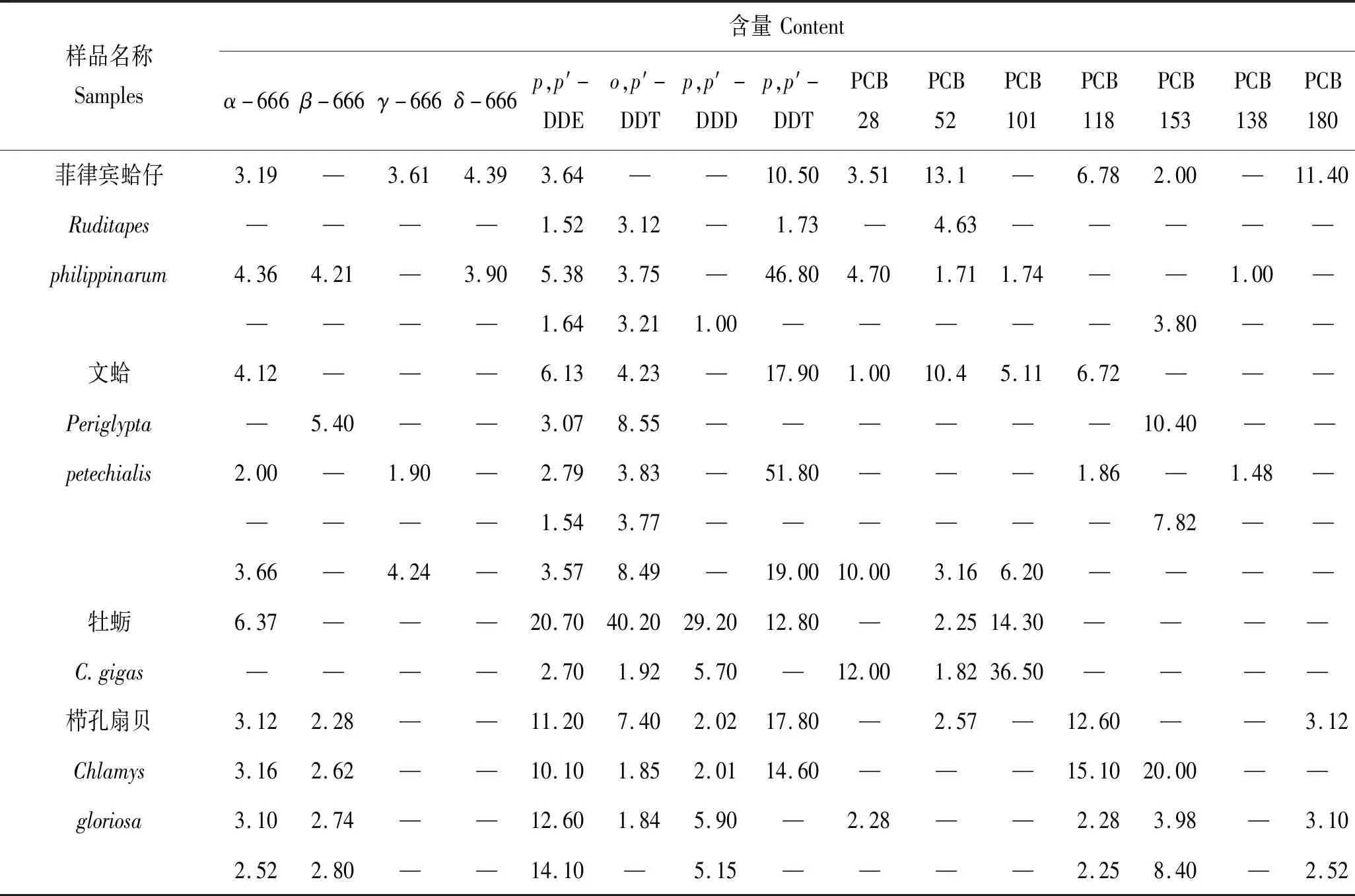
表3 贝类样品中15种POPs残留量Tab.3 Residues of 15 POPs in shellfish samples μg·kg-1
注:“—”表示未检出。
3 讨论
3.1 提取剂的选择
目前用作生物样品中有机氯农药及多氯联苯的提取剂有:单一溶剂体系(正己烷)[13-14]和混合溶剂体系(正己烷-二氯甲烷[15]、正己烷-丙酮[16]和乙腈-乙酸乙酯[17]等)。有机氯农药和多氯联苯具有低水溶性和高脂溶性的特点,对于含水量高的样品,应先用极性溶剂提取,再转入非极性溶剂中[18]。贝类含水量为80%~90%,水分含量高,非极性正己烷和水不互溶,不能完全渗透到样品中,降低提取效率。费勇等[19]用正己烷-丙酮(1∶1,V/V)作提取剂,鱼类中OCPs和PCBs等36种残留有机物的回收率为70.3%~84.8%。另有研究发现,90%丙酮水溶液可使鱼肉中蛋白质发生缓慢但彻底的变性,释放结合的氯苯类化合物,使萃取液能充分地与化合物接触并将其萃取出来,用丙酮为萃取剂时对氯苯类化合物的萃取效率最高,高于乙腈为萃取溶剂的萃取效率[20]。本实验在此基础上,尝试在生物样品中加入有一定极性、与水相相混溶的丙酮做提取剂,经丙酮提取后,在提取液中加入20 g/L硫酸钠溶液和正己烷,丙酮和水形成混合物,形成强极性的水相。根据相似相溶原理,OCPs和PCBs进入非极性的正己烷相,较低浓度的硫酸钠具有盐析作用,能减少有机溶剂在水中的溶解度,促使OCPs和PCBs进入正己烷相,从而提高萃取率。
目前用于贝类中有机污染物气相检测的前处理方法中,提取方法主要有振荡提取法[13-14]、超声提取法[21-22]等。本实验采用丙酮提取同时进行了超声处理,超声提取利用超声波空化作用,保证了提取溶液(丙酮)与样品基质的密切接触,加速了溶剂对被提取样品中目标成分的萃取作用,从而大大缩短了萃取时间。液液萃取(LLE)是基于相似相溶的原理进行物质分离,该方法所使用的有机溶剂大多低毒或无毒、无残留、容易回收,设备简单、成本低,对大部分的农药目标物提取效率较高,是一种比较稳定、可靠的前处理方法,在一般实验室内都能实现,操作也较为简单,但是其缺点是实验者的劳动强度较大。本实验使用分液漏斗振荡器解决了此问题,仪器振荡更有利于平行试验的进行,有效减小试验误差。
3.2 净化方法的选择
海洋贝类样品中含有丰富的蛋白和色素脂质[23]等有机质,提取液需经充分净化来降低杂质对痕量待测组分的干扰,以提高分析灵敏度,同时避免杂质对仪器的损害。目前用于贝类中有机污染物气相检测的前处理方法中,净化方法主要有磺化法[21-22]、固相萃取法(SPE)[17,24]和分散固相萃取法[15]等。磺化法操作过程需使用大量硫酸,存在操作安全隐患。SPE法基于液相色谱原理,具有简便安全、耗时短、节省溶剂、净化富集作用强和有利于自动化操作等优点。但目前实验室多选用手动装柱对固相萃取柱进行填料[25],操作复杂且浪费人力,同时存在方法重现性差的缺点。SPE法可以去掉分子量与目标物相近的杂质。Florisil(弗罗里硅土)作为氧化镁复合的极性硅胶吸附剂(硅镁吸附剂),早期广泛应用于柱层析,从非极性基质中吸附极性化合物,如分离有机氯农残、胺类、PCBs、酮类以及有机酸等。Silica硅胶是极性最强的小柱,填料为酸洗硅胶,硅胶的表面存在着硅醇基团(Si-OH),是强吸附的极性基团,通常从非极性溶剂中通过氢键间相互作用提取极性化合物,然后再通过提高溶剂的极性来破坏这种极性相互作用,洗脱目标化合物。但贝类样品中含有较多的蛋白质、色素和脂肪等大分子物质,单采用Silica固相萃取柱,在本研究确定的淋洗和洗脱条件下,难以达到对15种化合物的充分净化效果。凝胶渗透色谱是利用多孔凝胶对不同大小分子的排阻效应进行分离,能有效去除提取液中的蛋白质等大分子物质,减少基质干扰,进而大大提高目标待测物的灵敏度和响应值。本研究样品提取液经凝胶全自动净化后,去除了色素、蛋白质和脂肪等大分子,更好地保证了检测结果的准确性,同时大大节省了时间和人力。综合考虑,本实验将凝胶色谱净化与固相萃取净化联合使用,在凝胶净化后,采用Silica固相萃取柱进一步净化。
3.3 色谱条件的优化
气相色谱法不同的操作参数组合会产生不同的分离效果,本研究中目标待测物质HCHs、DDTs分别有4种同分异构体,PCBs有7种异构体及同系物,因此选择合适的色谱条件将其分离十分重要。其中柱的类型、载气流速、进样口温度和升温程序是影响分离效能和分析速度的主要因素。本研究重点对载气流速和升温程序进行了优化。结果发现:载气流速高时则出峰时间快,分析时间较短,得到的峰形较尖锐;载气流速过低,则出峰吋间延长,峰形较宽,不利于色谱峰的分离。因此,综合各因素的考虑结果,选择载气流速为1.0 mL/min。
本研究根据贝类样品的实际情况,选择的净化方法避免了磺化法可能造成的危险和手动装填固相萃取柱的繁琐,有效消除贝类样品基质的干扰,且自动化程度高,具有很好的重现性,准确度高,可用于大批量样品的同时操作及15种POPs多残留的同时检测。目前尚未有针对食品中PCBs和OCPs多组分同时分析的标准方法,随着调查研究工作的深入开展,开发复杂样品基质中多种POPs组分的快速同时测定技术,进一步改进样品的分析检测过程,开发更加环保和高效的样品纯化方法,并结合更准确、灵敏的仪器分析技术,对食品中POPs检测技术尤其是标准方法的成熟和完善具有重要意义。
4 结论
本研究建立并优化了贝类组织中有机氯农药和多氯联苯15种多残留同时检测的气相色谱分析方法,采用外标法定量,保留时间定性。样品采用丙酮作为提取剂,经液液萃取法、凝胶渗透色谱法和固相萃取法联合净化,有效减少了样品中基质的干扰。方法的检出限为0.3~0.8 μg/kg,定量限为1.0~2.0 μg/kg,且在1.0~100.0 μg/kg质量浓度范围内,15种持久性有机污染物均呈良好的线性关系。方法在精密度、准确度方面能满足对有机氯农药和多氯联苯检测的要求,操作安全性好,重现性好,回收率(60.1%~111.0%)符合检测要求,适用于蛋白质和色素等物质含量高的样品中有机氯农药和多氯联苯含量的同时检测。成功检测了山东沿海牡蛎等实际贝类样品中8种有机氯农药和7种指示性多氯联苯的残留量。

