拟菱形藻软骨藻酸产生影响因素及检测方法研究进展
王生福,杨傲傲,刘华雪,李修岭,李伟斯,王士满
(1. 临沂农业科技职业学院,山东 临沂276000; 2. 临沂大学生命科学学院,山东 临沂276000; 3. 中国水产科学研究院南海水产研究所,广州510000; 4. 临沂市环境监测站, 山东 临沂 276000; 5. 山东君成环境检测有限公司, 山东 临沂276000)
海洋环境尤其是海湾河口等近岸水域的污染加重及全球气候变化异常,使得有害藻华现象频发,成为突出的海洋生态灾害问题。有害藻华的大规模暴发会对渔业生产、海域生态安全以及人类和海洋生物的健康造成严重威胁[1-3]。硅藻是引起有害藻华暴发的重要类群,而拟菱形藻 (Pseudo-nitzschiaspp.)作为其中一类常见硅藻,其部分种类可产生强效神经毒素即软骨藻酸(domoic acid,DA)。最早公开报道的软骨藻酸引发的中毒事件发生于1987年,加拿大爱德华王子岛上发生因食用紫贻贝而造成人类误食死亡事件[4]。随后,由软骨藻酸引发的水生生物及人类的中毒事件陆续涌现[5-7]。虽然中国至今尚未出现DA中毒事件的相关报道,但在一些滤食性海洋生物(如双壳贝类、部分甲壳类)体内常常能检测到DA的存在,现已严重影响海产品的食用安全[8-10],DA污染问题不容忽视。为此,增加对DA生理和生态方面的研究,将有助于正确应对、及时处理其可能引发的灾害问题。目前,有关DA的研究已有较多报道,本文就DA的理化性质、产生机理及其检测分析等方面的进展进行综述,以期深入开展DA研究,更为科学合理地开发应用DA。
1 DA的发现及理化性质
DA是主要由拟菱形藻产生的一种神经生物毒素,人类摄入后能够引起记忆缺失性贝类中毒(amnesic shellfish toxins,AST或amnesic shellfish poisoning,ASP)。1958年,DA首次被Takemoto和Diago从日本的鹿儿岛县当地的树枝软骨藻(Chondriaarmatadomoi)中发现,并以该藻的日文名(domic)命名[11];1987年,DA首次于加拿大爱德华王子岛的拟菱形藻中分离出来[12]。DA作为一种强神经毒性物质,人类误食后,轻可引起腹痛、腹泻及呕吐现象,重则伴有记忆丧失、意识混乱等精神症状,甚至昏迷、死亡[7,13]。近年,拟菱形藻属的种类数量不断增多,在这些新发现的藻种中,某些藻种如巴西拟菱形藻(Pseudo-nitzschiabrasiliana)也能产生DA[14]。到目前为止,在已发现的45种拟菱形藻中,有26种确认能够产生DA[15]。图1显示的是DA从被发现到在世界沿海国家中扩散的研究历史进程(缩略版)[16],虽然中国尚未报道过DA中毒事件,但是中国沿海已检测到多种产DA的拟菱形藻,包括尖刺拟菱形藻多列型(Psuedo-nitzschiapungensf.multiseries)、多列拟菱形藻(Pseudo-nitzschiamultiseries)、伪柔弱拟菱形藻(Pseudo-nitzschiasp.cf.Pseudodelicatissima)、成列拟菱形藻(Psuedo-nitzschiaseriata)和澳洲拟菱形藻(Pseudo-nitzschiaaustralis)等。因此,DA污染问题仍存在潜在安全隐患[17-18]。
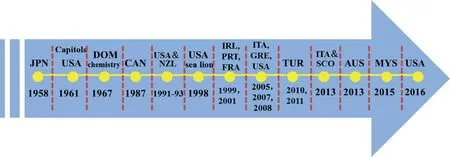
图1 软骨藻酸研究发展的历史进程[16]该历史年表显示了DA的发现历史、分离及其在不同国家发现的DA中毒事件。其中缩略字母:JPN代表日本,USA代表美国,CAN代表加拿大,NZL代表新西兰,IRL代表爱尔兰,FRA代表法国,PRT代表葡萄牙,TUR代表土耳其,ITA代表意大利,SCO代表苏格兰,AUS代表澳大利亚,MYS代表马来西亚。Fig.1 Research historical process of domoic acid[16]The timeline shows discovery, isolation and numerous domoic acid events across the global waters in various countries. JPN: Japan, USA: United States, CAN: Canada, NZL: New Zealand, IRL: Ireland, FRA: France, PRT: Portugal, TUR: Turkey, ITA: Italy,SCO: Scotland, AUS: Australia, and MYS: Malaysia.
软骨藻酸,化学名称为多莫酸,表示为[2S-[2α,3β,4β(1Z,3E,5R)]]-2-羧基-4-(5-羧基-1-甲基-1,3-己二烯)-3-吡咯烷乙酸,分子式为C15H21NO6,分子量为311.34,结构式如图2所示[5]。纯品为白色固体粉末,熔点为223~224 ℃,可溶于水(8 mg/mL),微溶于甲醇(0.6 mg/mL)。在紫外光谱区最大吸收波长为242 nm,在体积比为 1∶9的乙腈-水溶液中,以及-12 ℃的黑暗条件下,DA可保持性质稳定的时间为1年左右[19]。DA的结构在一定程度上与兴奋性氨基酸谷氨酸(glutamic acid)和红藻氨酸(kainic acid)类似,可以通过直接活化KA(kainate)受体和AMPA(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid)受体介导兴奋性神经毒,从而引起神经组织损伤[20-22]。但是其毒性效力比红藻氨酸高出2~3倍,比谷氨酸作用强烈100多倍。近年来从某些藻类中又相继分离出DA的同族化合物—异软骨藻酸A、B、C、D、E及F等物质,但这些物质的毒性均弱于DA[23-24]。
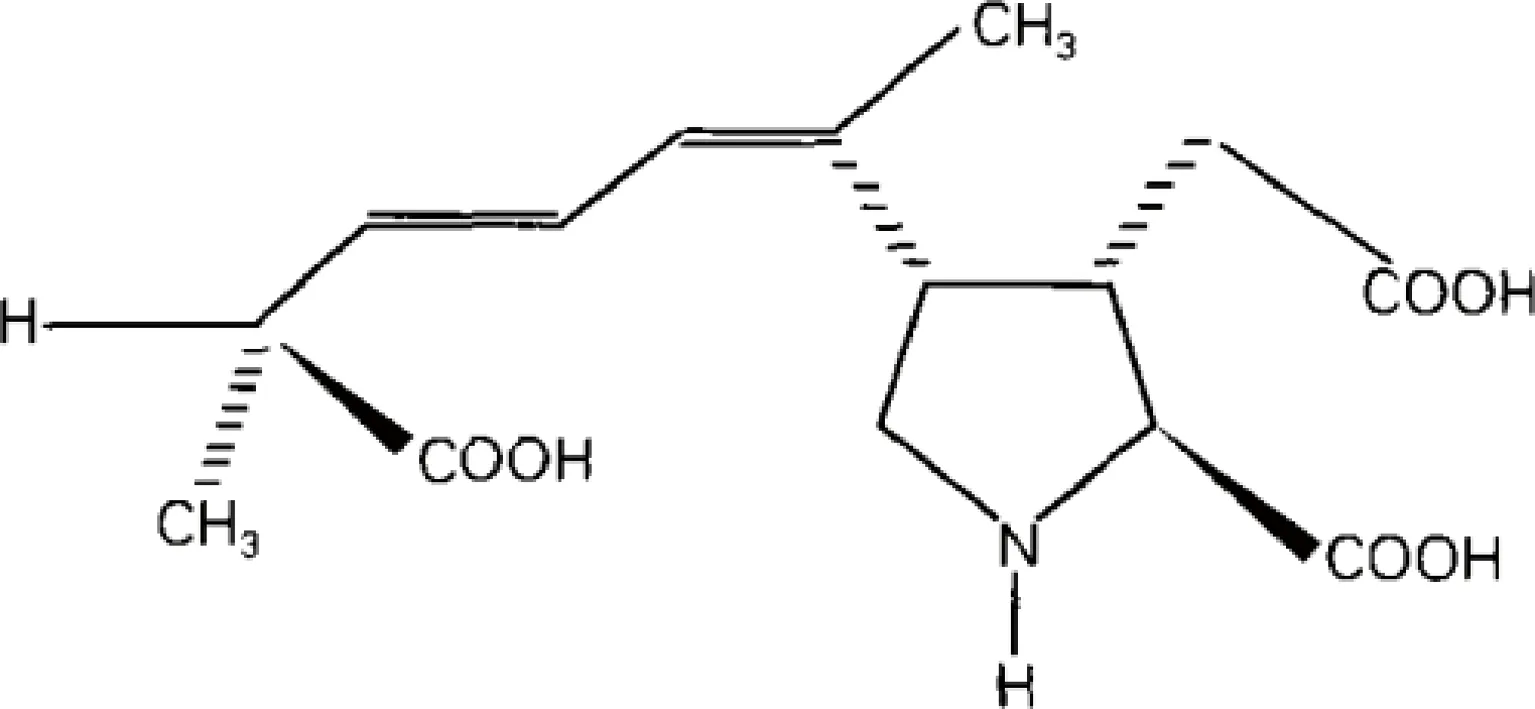
图2 软骨藻酸化学式[16]Fig.2 Chemical structure of domoic acid[16]
2 影响DA产生的相关因素
目前,基于DA转录组文库中的基因功能注释,有关DA合成途径的研究已有初步结果,DA生物合成的第一步可能是在萜烯环化酶(terpene cyclase)的催化作用下,首先由香叶基焦磷酸(geranyl pyrophosphate,GPP)与L-谷氨酸(glutamic acid,L-Glu)的N-异戊烯化反应生成N-香叶基-L-谷氨酸(N-geranyl-L-glutamic acid,L-NGG),然后再在α-酮戊二酸依赖性双加氧酶(a-ketoglutarate-dependent dioxygenase)和细胞色素P450催化完成后续的氧化反应[25]。但有关DA产生的生物和生理生化分子机制仍未充分明确。值得一提的是,不论是不同藻种的拟菱形藻还是相同藻种的不同藻株,产毒能力均有所不同,即存在种间水平和种内水平上的差异;此外,产毒能力还存在地理分布上的差异[26]。综合现有的研究结果,拟菱形藻种类产毒与否、产毒水平高低与其藻种/藻株的种类、生理状态及相关的生态因子以及环境因子密切相关。
2.1 藻种种类及生长周期
不同藻种/藻株的拟菱形藻在不同生长阶段产生DA的能力不同。早期研究发现,当多列拟菱形藻处于指数生长期时几乎没有DA产生,在稳定生长期却产生较多的DA[27]。有些种类则相反,如伪柔弱拟菱形藻和澳洲拟菱形藻,藻细胞内DA的产量会在指数生长期时逐渐增加,直至稳定生长期,最后DA被释放进入水体,引起水体DA含量的增加[28-29]。并且,相比营养限制,指数生长期会让藻细胞产生最大净DA产率[28]。而在培养从野外分离的4种拟菱形藻属的藻株过程中,发现所有藻株均在培养的第25天(稳定生长期)时检测到了DA,且澳洲拟菱形藻产生的DA量远高于其他3种[30]。可以得知,相同培养环境下,不同藻种/藻株的拟菱形藻产生DA的能力不同;即使是同一藻种,DA产量也会因生长环境的不同而产生生长速率及细胞形态的变化[15]。
2.2 营养元素
研究结果表明,在营养盐限制条件下,拟菱形藻的DA产量会明显增加[31-32]。在所有的营养盐中,硅、氮和磷等元素对DA产量变化的影响最为显著。
有研究表明,当磷营养限制时,成列拟菱形藻会产生DA;而当处于稳定生长期的藻细胞面临硅营养限制时,DA的产量会变得更多。与磷营养限制相比较,硅营养限制会更易产生大量的DA[33]。通过转录组数据分析,DA合成基因的表达活性在磷营养限制下发生显著上调[25]。在硅或磷营养限制条件下,DA的产量均能显著增加,其原因可能是细胞能通过降低自身的基础代谢活性,优先促进毒素合成基因的表达,从而促进了DA的产生[34]。当硅元素不受限制时,如果培养液中的氮磷比较高,即磷元素含量较低,DA的产量也会增加。并且,当其他基础代谢(如碳、氮、磷和硅等吸收水平)降低时,DA的产量也会增加[35]。
氮源的含量及类型均会影响DA的产量。有研究表明,当氮作为大量元素存在时,指数生长期的尖细拟菱形藻(Pseudo-nitzschiacuspidata)细胞内的DA含量会显著高于稳定生长期时的DA含量[36]。而当氮源含量相同时,通常情况下,有机氮较无机氮更能促进藻类产生DA。例如,以尿素作为氮源时,相比于使用无机氮源,指数生长期的藻细胞产生DA的量会显著增加[37]。Martin-Jézéquel 等[38]通过对两种拟菱形藻在有机氮源和无机氮源条件下产毒情况的研究发现,对多列拟菱形藻来说,当选取尿素作氮源时,DA产量最大;而对澳洲拟菱形藻而言,当用谷氨酸盐作氮源时,DA产量达到最大,此现象证实DA的产量与氮源类型有关,并且还会受到藻的种类的影响。但不同于先前研究结果的是,上述两种藻均可在氮源不能持续大量供应的情况下产生大量的DA[38]。
2.3 微量金属
DA有可能是某些微量金属元素如铁、铜的螯合物,某些种类的拟菱形藻可通过产生DA而有选择性地结合微量元素,从而增加自身必需微量元素的含量(如铁),或者是降低某些有毒的微量元素的含量(如铜),所以DA的产生可能与海水中的铁和铜离子的浓度密切相关[39]。
Maldonado等[40]通过研究多列拟菱形藻和澳洲拟菱形藻的DA产量与铁、铜含量之间的关系,发现在指数生长期,胞内和胞外的DA产量均会因铁元素的缺乏或是铜元素的过量而升高。但在多列拟菱形藻的研究中,发现胞内DA的产量会因铁元素的增加而提高[15]。但胞外DA产量除与铁元素含量有关外,还会因种群生长阶段的不同而存在差异,表现为在指数生长期和衰退期时,铁元素缺乏情况下有最大DA产量;而在稳定生长期时,结果与之相反[15]。铁在细胞生长的过程中,可能影响了某些电子传递反应(如光合作用、呼吸作用),进而间接影响了DA的产生。
锂作为一种被大家熟知的金属元素,广泛存在于土壤和水体中。锂虽然不是藻细胞内的必需元素,但它的存在却能影响细胞的生理活动[41]。在早期研究中发现,锂与拟菱形藻的DA产量之间存在联系,即高浓度的锂可以明显促进DA的产生[42]。其原因可能是由于锂具有较小的半径和较高的极性,更易取代钠离子、钾离子等阳离子,所以影响了质膜内离子泵的正常生理活动;再者,锂能与各类配体结合形成聚集体,在细胞内发挥作用[41-43]。
2.4 温度、光照
温度和光照都是非常重要的环境生态因子,二者对DA产生的影响,可能是通过直接影响单个藻细胞的生理活性(如细胞内的酶活性)或是间接影响藻细胞密度(如生长速率)来实现的。因此,DA不仅会在营养限制或是细胞状态不好时产生,在特定温度和光照状态下其产量也会发生变化。如在澳洲拟菱形藻培养过程中,温度和光照的相互作用能显著影响 DA的产量[44]。
相同培养条件下,温度对拟菱形藻产毒的影响会随藻种的不同而不同。通常,温度升高会促使更多DA的产生。比如成列拟菱形藻在4~15 ℃范围内[45]、多列拟菱形藻在5~25 ℃范围内[45]、澳洲拟菱形藻在23~30 ℃范围内,DA的产量会随温度的升高而有所增加[46]。值得注意的是,并非所有同种株系的藻类都表现如此。如在属于多列拟菱形藻的Pm4株系培养过程中,特定温度范围内,27 ℃时胞内DA的产量远低于18℃时的产量[47]。此情况可能是由于藻细胞生理和生态上不同的反应机制导致。
光照可以通过光周期和光照强度的变化来影响藻类产生DA。如早期有研究发现,成列拟菱形藻在长光周期(18 h光∶6 h暗)条件下,其DA总产量会显著增加[48]。某些种类虽然在弱光条件下能连续产生DA,但是总体而言,强光条件下DA的产量会高于弱光条件下的产量。并且,强光条件下,DA产量会随着光照强度的增加而增加[30,44]。光照能够对DA产量产生影响可能是因为光合作用为细胞提供了产生DA所需的能量。
2.5 细菌
单个细菌或细菌群落也会影响某种或某些拟菱形藻的产毒过程。如在对多列拟菱形藻的研究中发现,DA的产生与细菌存在与否密切相关[49-50]。早期研究表明,经抗生素处理得到的藻细胞虽然生长正常,但其产毒能力会比正常带菌时降低8~10倍;而当再加入原有细菌的单菌株时,DA产量会增长2~95倍。也就是说,胞外细菌的存在可以有效促进DA的产量[49]。后期研究结果也证实了该观点,即活细菌存在条件下,藻细胞中DA的产量会显著高于无菌状态下的藻细胞产量[50]。
但是,DA产量与细菌之间并非单一的对应关系,还会因拟菱形藻产毒种类的不同而不同。比如非产毒的伪柔弱拟菱形藻,生理活性就不会因原有细菌缺失或外来细菌存在而受到影响,且始终不会产生DA;产毒的多列拟菱形藻则会在无菌条件下快速生长繁殖,而在外来细菌共培养条件下则生长缓慢且只产生少量的DA[51]。DA与细菌之间的影响是相互的,研究表明,DA的存在会在一定程度上影响细菌群落的组成和结构[52]。但拟菱形藻产毒种类与细菌的具体关系尚需进一步深入研究。
2.6 其他因素
DA的产生,不仅受到营养盐、光照和温度等因素的影响,还受到其他物质及因子的影响。
1)粘土、锗酸:早期研究中,俞志明等[53-54]发现粘土矿物和锗酸均能抑制尖刺拟菱形藻产生DA,且锗酸能在锗/硅比值为35时,可完全抑制DA的产生。究其原因可能是,高浓度粘土影响了细胞的光合作用及营养环境,进而影响了DA的产生;而锗酸可能破坏了甚至中断了细胞内正常的硅化作用,破坏了藻细胞的呼吸作用、核酸和蛋白质等化合物的合成过程,从而抑制了DA的产生。
2)pH:Lundholm等[45]发现在实验室内,其他因素均不受影响的条件下,多列拟菱形藻在指数生长期后期产生的DA量会随着pH的增加(9.3~9.8)而显著增加;而在野外实际观测中,拟菱形藻暴发的赤潮水体往往有较高的pH(可以达到9甚至10左右),推测拟菱形藻暴发水域可能会有大量DA产生。pH对DA产量的影响可能是通过影响酶作用过程或碳元素含量或金属毒性作用或细菌结构来实现的(笔者认为自然水体中的pH不易调节,主要还是依赖其生态系统自我修复;若是特定区域的水体,如鱼池,有相关文献介绍均衡pH的方法,但未提及DA)。因此,pH能够影响DA产生,但DA是否会反向影响环境pH,尚需进一步研究。
3)二氧化碳(CO2):在两种不同类型的拟菱形藻中,二氧化碳的增加能够促进DA的产生,尤其是当环境中还存在磷营养限制[55]或是硅营养限制[56]。即使营养盐充足,有些藻类如多列拟菱形藻,细胞内的DA产量也会因为二氧化碳的增加而增加[57]。胞内DA合成基因的表达量会随二氧化碳压强的增加而上调[25]。伴随全球气候变暖及海洋酸化现象,研究二氧化碳变化对藻类的影响具有重要的现实意义。
4)捕食者:有研究表明,在桡足类及哲水蚤类浮游动物直接或间接存在的情况下,有毒硅藻(如成列拟菱形藻)的毒性会增加,说明有毒硅藻可能通过产毒的方式来抵御被捕食[58]。对浮游动物而言,在捕食产毒和非产毒硅藻时并没有明显的选择倾向,捕食摄入有毒硅藻后也并未对其自身产生明显影响,所以浮游动物更多的是作为一个载体,通过捕食有毒硅藻来间接地实现DA在海洋食物网中的转移和转化[59-60]。
3 DA的检测与分析
根据检测对象的不同,检测方法可分为藻体DA浓度测定、水体DA浓度测定和贝类DA浓度测定。根据检测方法的不同,又可分为生物、化学和物理检测方法等,每一种检测方法在使用时均有其各自的优点和局限性。本文对目前主要使用的检测分析方法进行介绍。
3.1 生物测定方法
小鼠生物测定方法(mouse bioassay,MBA)是检测赤潮藻毒素的经典方法,主要是通过一定年龄、大小和体重的小鼠来检测藻毒素的毒性,最后用半致死剂量来评价毒性效应。该方法最早于1987年用于DA的检测,后续发现在使用时存在很多的不确定因素(如实验动物大小、生理状态、操作技术和实验时间等),且检出限较高(适用于DA浓度在300~1 000 μg/g 的组织检测[61]),还存在可重复性较差、操作时间较长及无法区别毒素种类等缺陷,该方法已逐渐被新的检测方法所取代[62],但在毒理学研究中该方法仍有不可替代的作用。
3.2 高效液相色谱法
在液相色谱法、薄层色谱法、毛细管电泳法、氨基酸分析法和受体分析法等众多方法中,虽然高效液相色谱法在使用时需要专业仪器且所需费用相对较高,但由于其具有检测快速、重复性好和准确率高等优点,被公认为是最有效的测定方法。高效液相色谱法对贝类毒素的分析中,最成功的是对DA的分析,已被多国列为国家标准方法。中国国家标准明确规定使用反相高效液相色谱法对海产双壳类及其制品(不包括盐渍制品)进行DA含量的检测,该方法检测限为1.0 μg[63-64]。
结合高效液相色谱法和其他的检测手段,发展出一系列诸如高效液相色谱-紫外检测法(high performance liquid chromatography-ultraviolet,HPLC-UV)、高效液相色谱-荧光检测法(high performance liquid chromatography-fluorescence detection,HPLC-FLD)、高效液相色谱-串联质谱法(high performance liquid chromatography tandem mass spectrometry,HPLC-MS/MS)和高效液相色谱-电喷雾离子阱质谱法(high performance liquid chromatography-electrospray ion trap mass spectrometry,HPLC/ESI-MS)等新的检测方法(表1),在过去的20年里被用于测定贝类产品中DA的残留[8-10,65-66]。
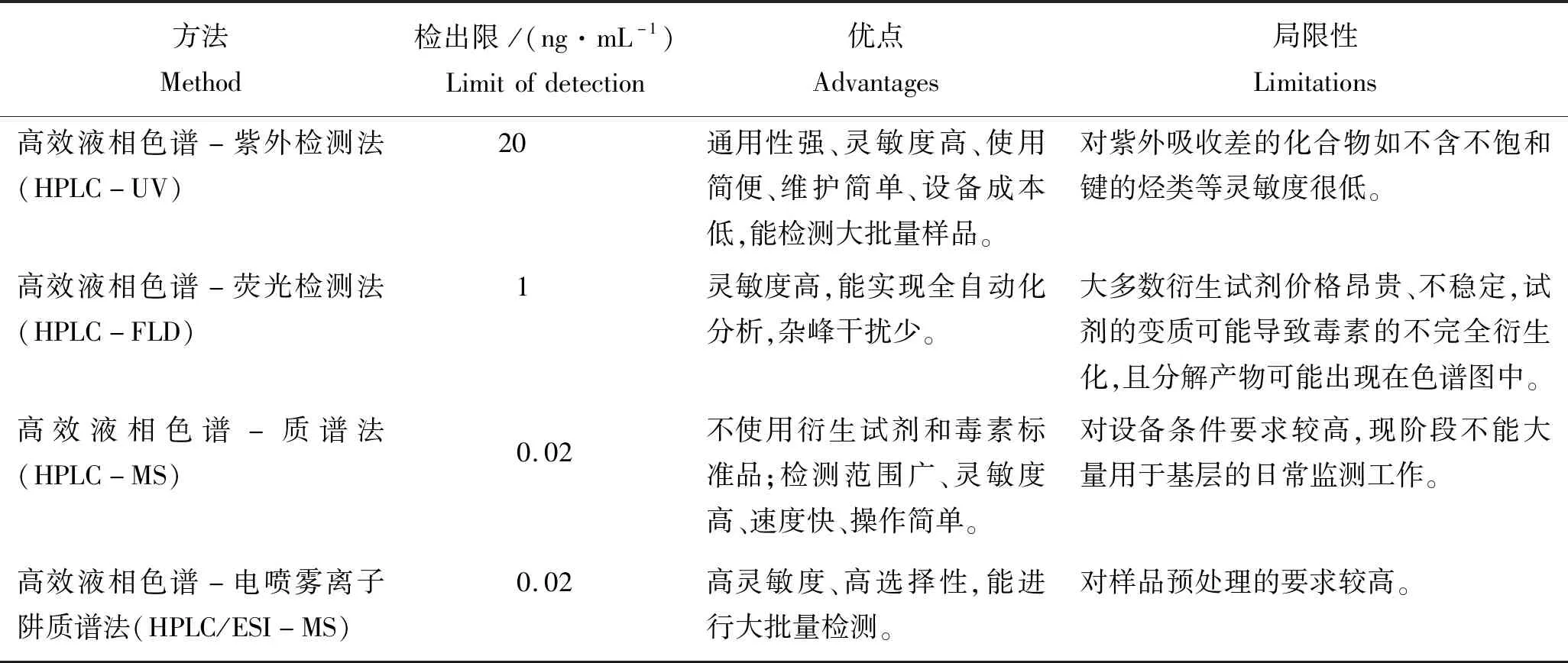
表1 HPLC各种方法的特征Tab.1 Characteristics of various HPLC methods
随后,一些经过优化的 LC-MS 技术开始应用于DA的检测。比如,利用固相萃取法结合LC-MS技术可以在痕量水平(<1 pg/mL)对DA进行检测[67];通过激光烧蚀电喷雾电离-高分辨率质谱(laser ablation electrospray ionization-high resolution mass spectrometry,LAESI-HRMS)技术,能在鲜贝组织样品中对5 μg/g的DA进行检测,该值是检出限的1/4[68];而高分辨率质谱(high resolution-mass spectrometry,HRMS)结合超高压液相色谱(ultra-high pressure liquid chromatography,UPLC)的液相色谱-高分辨质谱法(liquid chromatography-high resolution-mass spectrometry,LC-HRMS)技术,在尿样中对DA的检出限可达0.12 ng/mL[69]。
HPLC作为目前检测DA最为成熟的技术,总体来说对样品的测定较稳定,灵敏度较高,受操作和环境因素影响较小,但在测定效率、测定批量和成本方面等方面并不具优势。
3.3 酶联免疫测定
酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)是一类利用酶标抗原和抗体特异性结合原理来进行检测的分析方法,由于其具有方便快速、特异性强、检出限低、易定性定量、无需特殊设备等优点,已成为应用最广泛的免疫学检测技术。
ELISA 检测法利用抗原-抗体反应,采用特异性贝类毒素的抗体对DA进行检测和定量分析,其中使用多克隆抗体直接竞争(direct competition of polyclonal antibody)、多克隆抗体间接竞争(indirect competition of polyclonal antibody)以及单克隆抗体间接竞争(indirect competition of monoclonal antibody)检测DA含量时,其检出限能分别达到0.02[70]、0.15[71]和0.15[72]ng/mL。
ELISA检测法灵敏度高,可用于DA的快速检测。目前,国内外已经研制出多种针对DA检测的ELISA方法及其试剂盒[73-77]。其中胶体金(colloidal gold)技术发展迅速,该项技术是通过标记DA的单克隆抗体,利用竞争免疫反应,研制出胶体金免疫层析试纸条,从而进行DA的检测。国内,高利利等[78]利用柠檬酸三钠还原法制备的胶体金实现了15 min以内、灵敏度为20 ng/mL的检测方法;国外,Tsao等[79]利用从杂交瘤细胞系9F1F11中产生的单克隆抗体而制备的胶体金免疫层析试纸条,将DA的检测时间缩短至10 min以内、灵敏度提高到 5 ng/mL,真正实现DA的现场快速、批量检测。
一些改良的ELISA技术已经陆续出现并突显出自身的优势,如基于毛细管电泳的酶免疫测定(capillary electrophoresis-based enzyme immunoassay,CEEIA)技术,可以在5 min内通过电化学方法对贝类样品中的DA进行检测,灵敏度是传统 ELISA 技术的16倍[80]。此外,一项结合3种免疫学方法(固相微球法、流式荧光测定法和 Luminex xMap 技术)的多功能检测技术——流式细胞微球阵列术也被应用于DA的检测,半抑制浓度(IC50)可达到(1.9±0.1) ng/mL[81]。
尽管ELISA方法在使用中具有较多优势,但是昂贵的DA标准品、专业的酶标仪等仪器、较小的DA分子量、复杂的免疫抗原制备技术以及难以操控的现场检测操作等,都在一定程度上限制了免疫方法在DA分析中的应用。
3.4 DA其他检测方法
除较常用的高效液相色谱法、酶联免疫测定等方法外,一些其他的检测方法,如生物传感器法、毛细管电泳法和神经受体结合检测等技术也被应用于DA的检测。
生物传感器法是一种较为快捷且价格低廉的检测技术。该项技术可以将生物反应产生的信息转化成可定量处理的电信号输出,以此来测定物质的浓度。在过去的20年里,各类基于生物传感器的检测技术被广泛应用于化学污染物或是病原体的检测中[82-83]。如在食品中,运用表面等离子体共振(surface plasmon resonance,SPR)技术检测DA时,所使用的高灵敏度的抗体—单克隆抗体和多克隆抗体,其半抑制浓度可分别达到4.8~6.9 ng/L和2.3~6.0 ng/L[84]。
毛细管电泳法(capillary electrophoresis,CE)是利用不同的带电粒子在电场中具有不同的迁移速率的原理实现待测物的分离,该方法具有操作简单、成本低和易携带等特点,属于较早应用于海洋生物毒素分离和检测的方法之一[85]。国内在使用该种方法测定DA时,最低检出限为34 ng/mL。
随着技术的不断发展,其他的一些诸如纯化和氨基官能化的银纳米粒子(pure or amino-functionalized Ag nanoparticles)和表面增强拉曼散射(surface enhanced raman scattering,SERS)等新型的DA检测方法不断出现,逐步实现不同情况下DA的快速、准确检测[86]。但比较之下,以上方法在灵敏度和准确度上还远不及色谱法和免疫学方法,所以应用范围仍十分有限。
4 展望
DA作为一种神经毒素,一方面,会对水生生物和人类健康构成潜在的风险;另一方面,其具有杀虫、杀菌的作用,因此对DA的研究具有非常重要的现实意义。目前,虽然国内不断有新的拟菱形藻被发现和报道,但是对DA及拟菱形藻属研究仍十分有限,后续研究中除了需系统总结拟菱形藻在中国各个海域的分布情况、种类组成及产毒状况外,本文认为还需从以下3个方面加强科学探究。
1)加强对DA产生机制的研究,了解并掌握特定环境因子和生物因子对DA产生和分布的影响。目前,利用先进的分子生物学和基因遗传学手段,已经发现与DA产生有关的上调/下调基因、参与DA合成的酶及可能的产生机制[25,87-88]。在此基础上,通过使用酶抑制剂、基因敲除或基因沉默等手段,或许可以增加或抑制藻类DA的产生。此外,还应在有毒拟菱形藻属中广泛开展研究,而不是单纯地针对某一种类如多列拟菱形藻,从而确保研究结果的通用性。
2)改进DA的检测手段和方法。随着研究的深入,预期会有更多新的有毒赤潮藻及其藻毒素被发现和研究。目前,DA已经存在多种检测方法,但是使用中仍然存在着不同程度的局限性。高效液相色谱法具有检测快速、重复性好和准确率高等优点,被公认为是目前最有效的测定方法。但近年来,ELISA检测试剂盒因易于携带、可用于现场监测而越发受到关注,一些快速检测试纸条也正成为新的研究方向[78]。此外,通过DA的检测,可以掌握DA的地理分布,通过建立合适的模型预测生态系统中DA的产生和迁移,从而预防潜在的DA灾害等。
3)进一步探索DA的应用前景。DA作为一种天然海洋药物,比有机合成的化学药剂有着更为明显的优势,如可以作为神经生理学研究的重要材料。在预防DA毒性的同时, 应充分利用其生物活性,如利用DA对昆虫的杀灭能力,开发新型灭虫剂[5]。因此,根据DA的特性进行产品开发是发展绿色产业的一条有效途径。鉴于此,可以利用基因重组等手段筛选和培育DA高产藻株,以便进行更为科学可控的DA生产与应用。

