循环内皮微粒相关microRNA在巨噬细胞炎性反应诱发小鼠动脉粥样硬化发生的机制
孙理华, 张 颖, 曹桂秋, 李 鹏, 胡 强, 张雅玲, 幸世峰
(新疆医科大学第五附属医院心血管内科, 乌鲁木齐 830011)
心血管疾病是世界范围内导致患者死亡的主要原因,而动脉粥样硬化(AS)性炎症是心血管疾病和进一步急性并发症的主要因素[1-3],AS影响大动脉和中动脉的内膜,特别是在动脉分支部位。炎症反应的作用是心血管疾病研究的重要内容,目前许多心血管疾病的治疗方法,包括他汀类药物和血管紧张素转换酶(ACE)抑制剂,都与抗炎特性有关[4,5]。细胞间粘附分子-1(ICAM-1)和血管细胞粘附分子(VCAM-1),吸引淋巴细胞和单核细胞与内皮结合并浸润动脉壁内膜介质层,经修饰的低密度脂蛋白(LDL),如氧化的LDL(oxLDL),被证明能刺激促进炎症的产生,加速AS斑块的形成[6]。在内膜中单核细胞会向吞噬oxLDL沉积物的巨噬细胞分化,因胆固醇流出物和oxLDL清除功能受损[7],树突状细胞(dc)、中性粒细胞、肥大细胞和自然杀伤细胞(NK)细胞等免疫细胞也参与细胞内炎症的反应[8]。所以,单核细胞和T细胞在AS发病机制中的重要作用得到广泛认识和研究。Zernecke等[9]研究指出,由于动脉区域受到异常剪切应力,导致内皮微粒(EMPs)的促炎症激活,EMPs内存在内源性的非编码MicroRNAs(miRNAs), 在细胞间起着重要作用。有研究表明,冠状动脉疾病患者的循环miR-19b水平明显高于阴性对照组患者, 而miR-19b主要存在于EMPs中[10-12]。EMPs是miR-19b在血管内皮细胞和其他细胞之间的通信中的重要载体,然而miR-19b对AS进展的影响尚不清楚,因此该研究主要探讨miR-19b在AS中对炎症反应的影响。
1 材料与方法
1.1 实验动物
SPF级雄性ApoE-/-小鼠, 5周龄, 体质量15~20 g,共206只,实验组156只,对照组50只,均购自南京天邦生物科技有限公司[SCXK(苏)2015-0018],在SPF条件下饲养[SYXK(新)2018-0003]。所有的实验动物程序都符合动物管理和使用委员会的审查和批准。
1.2 仪器与试剂
EzRIPA裂解试剂盒(ATTO,Tokyo,日本); 线粒体分离试剂盒(BioChain Institute Inc., Gibbstown, NJ,美国); Pierce BCA Protein Assay Reagent试剂盒、DAB显色试剂盒(迈新生物技术有限公司); miR-19b特异性逆转录引物及逆转录试剂盒(上海生工工程有限公司); 水合氯醛(北京百顺化学科技有限公司); 甲醛、异丙醇和氨水(无锡市亚泰联合化工有限公司);苏木素(北京索莱宝科技有限公司),Immobilon-P Transfer Membran过滤器(Millipore Co., Bedford, MA,美国); 离心机(上海安亭离心机厂); 罗氏全自动免疫组化仪(上海罗氏制药有限公司; 酶标仪(美国Bio-Tek公司); PCR仪(赛飞中国有限公司)。
1.3 建立AS小鼠模型和分组
实验组ApoE-/-小鼠156只随机分为3组,患有AS模型组,NC-miRNA组及miRNA-19b抑制剂组,每组52只。对照组小鼠给予正常饮食饮水饲养。实验组3组行AS造模,喂脂胆固醇饮食(1.25%胆固醇和21%脂肪), 8周后, 3组中分别随机解剖小鼠2只, 3 000 r/min离心10 min, 检测血脂水平,取小鼠主动脉, HE染色观察主动脉组织结构, 确认造模成功。NC-miRNA组造模成功后尾静脉注射miRNA抑制剂构建AS模型小鼠为阴性对照;miRNA-19抑制组组构建AS小鼠模型后尾静脉注射miRNA-19b抑制剂,80 mg/kg,1次/d,连续注射3 d。摘眼球取血,腹腔注射质量分数10%水合氯醛,处死后解剖取胸主动脉,置于质量分数4%多聚甲醛溶液中固定,进行病理染色,部分放于-80℃冻存,备用。
1.4 观测指标及方法
1.4.1 AS病变的组织学评价 将主动脉组织固定后进行梯度蔗糖脱水, 组织沉底后取出, 投入包埋剂中浸泡使气泡排尽,包埋,-20℃恒温环境下进行冰冻切片, 体积分数60%异丙醇浸泡,油红染色液浸染, 苏木素复染, 氨水返蓝后甘油封片。在光学显微镜下对组织进行观察,将测量出的斑块面积除以计算所得的主动脉面积, 则得出斑块面积百分,并对各组的斑块面积百分比进行统计、比较分析。
1.4.2 小鼠血脂水平检测 取眼球血分离血清(离心条件3 000 r/min 10 min),检测血清中胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C) 和低密度脂蛋白胆固醇(LDL-C)指标。
1.4.3 ELISA血管炎症性因子浓度检测 BCA法测定提取的蛋白浓度。按照试剂盒说明书进行肿瘤坏死因子(TNF-α)、白细胞介素1(IL-1)、IL-6和IL-10检测,然后用酶标仪检测各孔的吸光度(A)值。EzRIPA裂解试剂盒裂解细胞, 使用线粒体分离试剂盒分离线粒体, 均按照制造商的说明书进行操作。使用Pierce BCA Protein Assay Reagent试剂盒测定蛋白质浓度。在Laemmli样品缓冲液中裂解蛋白质, 进行SDS-聚丙烯酰胺凝胶电泳, 并转移到Immobilon-P Transfer Membrane过滤器上。
1.4.4 Western blot检测小鼠血管组织中相关蛋白表达变化 取适量动脉组织样品置于1~2 mL匀浆器中球状部位,组织块尽量剪碎后加400 μL单去污剂裂解液[含苯甲基磺酰氟(PMSF)]进行匀浆,重复几次使组织尽量破碎。裂解30 min后, 在4 ℃下12 000 r/min离心5 min,取上清进行BCA检测蛋白浓度; 加入一抗(1∶200),摇床震荡2 h; 用TBST在室温下脱色摇床上洗2次,每次10 min; 再用TBS洗一次,10 min,二抗孵育2 h, 用0.01mol/L PBS洗膜3次,电化学发光(ECL)底物发光表示蛋白的相对表达量。
1.4.5 实时荧光定量PCR检测miR-19b表达及细胞凋亡实验 取液氮保存中的主动脉组织于预冷研钵内,使其一直处于液氮中研磨,最后用勺子收集粉末, 放入含1 mL trizol的1.5 mL无酶离心管中, 混匀测定总RNA浓度及纯度,采用miR-19b特异性逆转录引物及逆转录试剂盒合成cDNA(上海生工工程有限公司),随后以cDNA为模版进行荧光定量PCR反应,PCR仪设置条件为37 ℃保持15 min、85℃保持5 s、4℃至最终。取各组动脉组织检测细胞的凋亡情况,根据Annexin V-FITC/PI 细胞凋亡试剂盒进行检测。
1.5 统计数据
2 结果
2.1 AS病变的组织学比较
如图1所示,对照组小鼠内皮细胞排列整齐(图1A),AS组和NC-miRNA 组小鼠血管内皮细胞的排列较乱, 内膜厚度增加(图1B、C), miRNA-19b抑制剂组小鼠组织病变程度大大减轻(图1D)。小鼠的主动脉斑块面积百分比比较分析表明,对照组小鼠主动脉检测出粥样斑块为无,其它各组小鼠主动脉粥样斑块面积百分比大小顺序分别为:AS模型组>NC-miRNA 组>miRNA-19b 抑制剂组(表1)。miRNA-19b抑制剂组显著高于对照组,但显著低于模型组与 NC-miRNA 组 (P<0.05)。
2.2 血脂相关指标
与对照组比较,AS模型组、NC-miRNA组及miRNA-19b抑制剂组TC、TG和LDL-C 水平明显升高, 而HDL-C水平含量降低; 与模型组和NC-miRNA组比较, miRNA-19b抑制剂组TC、TG和LDL-C水平降低, HDL-C 水平则有升高 (P<0.05)(表2)。
2.3 血管炎症性因子的表达水平

图1 各组小鼠动脉血管组织病理变化 (Oil-red染色×600)

表1 各组小鼠胸腔动脉斑块面积百分比
如表2所示, AS模型组与对照组相比,IL-1、IL-6和TNF-α的水平升高,而 IL-10水平则有比较明显降低; NC-miRNA 组各指标也有相同的变化趋势; miRNA-19b抑制剂组IL-1、IL-6和TNF-α水平低于AS模型组和NC-miRNA 组,IL-10的水平则高于两组(P<0.05)。
2.4 血管组织中凋亡因子Bcl-2 cleaved-PARP和Bax的表达水平
如表4、图2所示, 与对照组比较, NC-miRNA、AS模型组的Bax和cleaved-PARP 表达量升高,但Bcl-2表达水平下调(P<0.05)。与模型组和NC-miRNA组相比,miRNA-19b抑制剂组的促细胞凋亡的蛋白Bax和cleaved-PARP表达水平下调,Bcl-2的表达水平上调。

表2 各组小鼠血脂相关性指标比较 mmol/L

表3 各组小鼠血清IL-1、IL-6、IL-10和 TNF-α含量比较 g/L
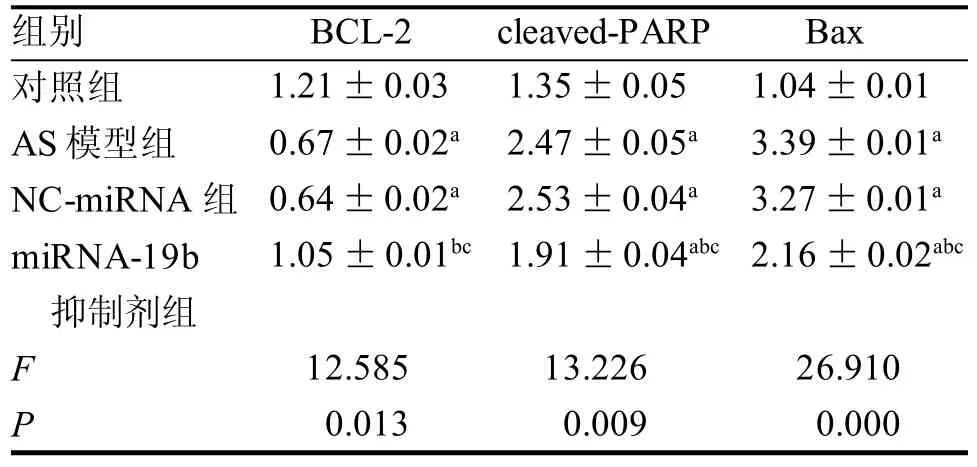
表4 各组小鼠BCL-2、cleaved-PARP和Bax的蛋白相对表达量

图2 Western blot检测各组BCL-2、cleaved-PARP和Bax蛋白表达
2.5 miRNA-19b的表达
如表5和图3所示,与对照组比较,AS模型组(2.71±0.02)和NC-miRNA 组(2.43±0.02)d的miRNA-19b的蛋白表达明显增加 (P<0.05); 与AS模型组和NC-miRNA 组比较,miRNA-19b抑制剂组(1.52±0.01)蛋白表达显著下降 (P<0.05)。

表5 各组小鼠miRNA-19b表达量比较

图3 Western blot检测各组miRNA-19b表达
2.6 各组巨噬细胞的凋亡率检测结果
与对照组比较,AS模型组、NC-miRNA组及miRNA-19b抑制剂组细胞凋亡率均升高 (P<0.05); 与AS模型组和NC-miRNA组比较,miRNA-19b抑制剂组细胞凋亡率显著降低 (P<0.05)(表6和图4)。

表6 各组巨噬细胞的凋亡率检测结果比较
3 讨论
在AS进程中,免疫和非免疫的血管细胞会释放多种促炎信使,包括细胞因子、趋化因子、生物活性脂类化合物和粘附分子,这些分子可以维持和增强局部炎症和AS病变的发展[11]。AS是一种慢性疾病,导致心力衰竭和死亡的最主要原因,AS

图4 流式细胞仪检测各组巨噬细胞凋亡率
的病理生理机制包括脂质代谢紊乱、慢性炎症血管和血细胞中促炎信号通路的上调促进了AS的发生,炎症在AS所有阶段的重要作用目前已为人所知, 目前研究主要关注一些关键的促炎调节剂在AS过程中的作用,如IL-1、IL- 6、TNF-α和IFN-γ等关键因素促炎细胞因子[12]。Qamar等[13]在临床研究中发现, IL-1在抑制治疗慢性炎性疾病方面有效果,暗示IL-1作为抗炎治疗AS的目标, 炎症涉及多种难以靶向治疗的调节和补偿机制, 抑制这些细胞因子的过度血管生成可能对抗炎治疗AS具有重要意义。
本研究表明,抑制miRNA-19b能够较明显改善内皮细胞损伤,缓解由于AS引起的血管厚度增加,减少AS斑块的面积比例。与本文结果类似,Souilhol 等[14]研究同样表明,miRNA-19b与AS发展具有相关性,miRNA-19b抑制剂组血脂指标TC、TG和LDL-C水平降低,HDL-C水平则有升高,可以解释抑制小鼠体内的miRNA-19b可以缓解AS。研究[15]表明,miRNA-19b能够减少吞噬免疫细胞的凋亡率,相关蛋白的表达量变化检测亦支持该结果。miRNA-19b经抑制后,作为细胞凋亡的标志蛋白Bax和cleaved-PARP的表达量下降, 同时具有抑制细胞凋亡作用的相关蛋白Bcl-2的表达量上升。Naugler等[16]研究表明,IL-6是急性炎症的关键介质, 可视为炎性生物标志物, IL-6是由巨噬细胞和T细胞在感染或损伤后的最初阶段产生, 以诱导免疫反应和炎症,血管平滑肌细胞也会分泌IL-6来应对炎症刺激和损伤,因为这种细胞因子是这种细胞类型的有丝分裂因子, IL-1产生的促炎症细胞因子[17], 广泛激活巨噬细胞。Canakinumab等[18]对人类特异性IL-1β单克隆抗体初步临床试验结果显示,IL-1在急性心肌梗死、中风和AS等疾病中的疗效。TNF-α是一个有效的促炎细胞因子,主要在巨噬细胞和参与系统性炎症和传播的急性期反应[19,20],TNF-α有不同的免疫调节功能,如抑制病毒复制和致癌作用, 诱导细胞凋亡和炎症,启动防御反应应对脓毒症等等[21],生产过剩的TNF-α与急性和慢性炎症有关,会对免疫介导的组织产生破坏,因此抑制这些细胞因子的过度血管生成可能对抗炎治疗AS具有重要的治疗意义。本研究结果中通过抑制miRNA-19导致IL-1、IL-6和TNF-α水平降低,IL-10的水平升高, 表明抑制miRNA-19b可以下调促炎因子,同时上调抗炎因子表达,减轻AS小鼠动脉血管组织中的炎症反应。Sun等[22]认为,抑制miRNA-19b可调节巨噬细胞的增殖凋亡,从而抑制AS的发展进程。miRNA-19b微粒广泛存在于血液、组织和细胞中,与机体多种病理生理过程有关。miRNAs是一种内源性的、长度为19~25个核苷酸的非编码RNA,在细胞间的相互作用中起着至关重要的作用,关于miRNAs的研究已经成为生命科学领域研究的热点,miRNAs与人类多种疾病密切相关。
综上所述, 循环EMPs相关miRNA-19b的存在可以减少巨噬细胞的凋亡, 并且通过上调促炎因子促进组织周围炎症的发生, 进而促进AS的发展进程。

