MAPK信号通路调节卷烟烟气诱导的炎症因子的释放
许良涛,李 翔,王蕙婷,刘克建,谢复炜,刘惠民,谢剑平
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
炎症,是组织和器官暴露于有害刺激物,如微生物病原体、化合物或有毒的细胞成分等而产生的一种复杂防御性反应[8],参与卷烟烟气诱导的多种相关疾病,例如吸烟诱导的长期不可控的炎症反应会引发肺组织损伤,最终导致COPD等慢性疾病的发生[9]。丝裂原活化蛋白激酶(Mitogenactivated protein kinase,MAPK)信号通路包括c-Jun氨基末端激酶1/2(c-Jun N-terminal kinase,JNK1/2)、细胞外信号调节激酶(Extracellular signalregulated kinase,ERK)和p38[10]。有研究结果表明,MAPK信号通路与炎症相关。Shen等[11]研究发现,特异性抑制JNK1/2可降低AP-1的转录活性和活性氧的释放水平,并通过下调肿瘤坏死因子(Tumor necrosis factor-α,TNF-α)和 白介素 -6(Interleukin-6,IL-6)来抑制百草枯诱导的急性肺损伤和细胞凋亡。He等[12]研究报道,PM2.5会明显地激活磷酸化的核因子-κB(Nuclear factor-κB,NF-κB)、p38和ERK信号通路,同时增加促炎症因子的基因和蛋白表达,最终通过炎症和氧化应激反应导致慢性阻塞性肺病的发生。然而卷烟烟气诱导的炎症相关信号通路等机制研究较少,有研究表明,卷烟烟气中的自由基不仅会激活ERK信号通路[13],而且可以通过调节肺部众多的氧化还原敏感信号系统诱导炎症的发生[14]。由此提出假设,卷烟烟气诱导的炎症反应可能通过MAPK信号通路介导。呼吸系统是卷烟烟气接触的主要靶器官。本研究中,采用人支气管上皮细胞(BEAS-2B)作为受试对象评价卷烟烟气的体外毒性效应,分别使用抑制剂SCH772984、SP600125和SB203580对ERK1/2、JNK1/2和p38进行特异性抑制,初步探讨烟气诱导的炎症因子释放与MAPK信号通路的关系,旨在为卷烟烟气诱导的炎症相关疾病的机制研究提供参考。
1 材料与方法
1.1 材料、试剂和仪器
3R4F参比卷烟(美国肯塔基大学);BEAS-2B细胞(美国ATCC细胞库)。
二甲基亚砜(Dimethylsulfoxide,DMSO,美国Amresco公司);磷酸化ERK1/2抑制剂SCH772984(S7101)、磷 酸 化 JNK1/2抑 制 剂 SP600125(S1460)、磷酸化p38抑制剂SB203580(S1076)(美国Selleck公司);蛋白分子量标准品(26617,美国Thermo Scientific公司);兔抗一抗,包括ERK1/2(4695)、磷酸化 ERK1/2(4370)、JNK1/2(9258)、磷酸 化 JNK1/2(4668)、p38(8690)、磷 酸 化 p38(4511)、β-Actin(8457)( 美国 Cell Signaling Technology公司);辣根过氧化物酶(Horseradish peroxidase,HRP)标记山羊抗兔二抗、增强型化学发光(Enhanced chemiluminescence,ECL)检测试剂盒(中国碧云天公司);哺乳动物蛋白质提取试剂(78501,美国Thermo公司);Cell Counting Kit-8试剂盒(CCK-8,日本 Dojindo实验室);人 IL-6 ELISA试剂盒(S6050)、人IL-8 ELISA试剂盒(S8000C)、IL-1β酶联免疫吸附(Enzyme-linked immunosorbent assay,ELISA)试剂盒(SLB50)(美国R&D system公司);人支气管上皮细胞基础培养基(Bronchialepithelialcellbasalmedium,BEBM)+SingleQuots细 胞 因 子(CC-3171,Clonetics)(美国Lonza公司)。
SW-CJ-2FD超净工作台(江苏省苏州安泰空气技术有限公司);聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜(美国Merck Millipore公司);60 mm细胞培养皿(430166)、96孔板(3599)(美国Corning公司);AL204-IC电子天平(感量0.000 1 g,瑞士Mettler Toledo公司);TH4-200显微镜(日本Olympus公司);HERA cell 240细胞恒温恒湿培养箱(美国Thermo公司);Spectra MAX 190酶标仪(美国Molecular Devices公司);RM20H转盘吸烟机(德国Borgwaldt KC公司);Mini TransBlot Electrophoreti蛋白免疫印迹转印槽(美国BioRad公司);3-18 K高速冷冻离心机(德国Sigma公司);FluorChem E超灵敏自动成像分析系统(美国Protein Simple公司);Nanodrop 2000分光光度计(美国Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 TPM染毒液的配制
3R4F参比卷烟放置于(22±1)℃、相对湿度(60±2)%的环境中平衡48 h。采用转盘吸烟机在ISO标准抽吸模式[15]下抽吸20支参比卷烟;用剑桥滤片( 92 mm)捕集卷烟主流烟气总粒相物(TPM),加入适量DMSO萃取剑桥滤片,超声振荡10 min,制备10 mg/mL的TPM储备液,-80℃保存。除细胞毒性测试空白对照组培养基中的DMSO浓度为0.5%,其余实验空白对照组培养基中的DMSO浓度均为0.1%(细胞毒性测试中,最高TPM染毒剂量为50 μg/mL,其余实验TPM最高染毒剂量为10 μg/mL)。
1.2.2 细胞培养和细胞毒性测试
使用BEBM细胞培养液(加SingleQuots细胞因子)对BEAS-2B细胞进行培养。细胞接种于60 mm培养皿中,接种数目为3×105/皿。在37℃、5%CO2无菌细胞培养箱中进行培养。将对数生长期的BEAS-2B细胞接种于96孔板,每孔加200 μL培养基,细胞接种数目设定为1.5×104/孔。在培养箱中培养24 h后,吸去培养基,使用磷酸盐缓冲液(Phosphate buffer solution,PBS)清洗3次,吸净PBS溶液。加入200 μL含有不同TPM浓度的培养基,染毒培养24 h后,每孔加入10 μL CCK-8试剂,并于37℃下孵育4 h。使用酶标仪在450 nm波长下测定吸光度。
(1)岩棉复合型保温模板的组成材料为岩棉保温板、冷拔低碳钢丝、聚合物保温砂浆,该模板具有免拆模、使用安全、耐火等级高、施工便捷等优点。
1.2.3 TPM染毒和抑制剂处理
细胞传代后培养24 h,细胞生长达到80%汇合,进行TPM染毒24 h,染毒前1 h对细胞进行抑制剂处理,使用4 nmol/L SCH772984抑制磷酸化的 ERK1/2,使用 50 μmol/L SP600125 抑制磷酸化的 JNK1/2,使用 10 μmol/L SB203580 抑制磷酸化的p38。
1.2.4 Western Blot实验
Western blot(WB)实验的简要流程如下:使用1.2.2节方法对细胞进行染毒,收获细胞于冰上裂解得到细胞全蛋白,使用分光光度计测定全蛋白浓度,电泳上样量为20 μg蛋白。制备5%(质量分数)的浓缩胶和8%~15%(质量分数)的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分离胶对蛋白进行分离。使用转膜装置将蛋白质转印至PVDF膜上(转膜电压100 V、转膜时间1 h)。PVDF膜于5%的脱脂奶粉中室温封闭1 h,使用含0.05%Tween 20的Tris缓冲溶液(Trisbuffered saline and Tween 20,TBST)洗膜3次,每次5 min。使用相对应的兔抗一抗于4℃下孵育过夜。次日使用TBST缓冲液洗膜3次,每次5 min。使用HRP标记的山羊抗兔二抗于室温中孵育1 h。使用TBST洗膜3次,每次5 min。然后使用化学发光法ECL试剂进行显影,使用显影仪拍照。
1.2.5 酶联免疫吸附实验(Enzyme lined immunosorbent assay,ELISA)
细胞上清液中IL-1β、IL-6、IL-8的释放水平采用对应的人抗体半定量ELISA试剂盒进行检测。实验操作步骤按试剂盒说明书进行。
1.2.6 数据统计分析
实验结果至少重复3次,数据均以平均值±标准偏差表征。使用SPSS 13.0数据处理软件对数据的组间差异进行统计分析,数据间的最小显著差异(Least significant difference,LSD)通过单因素方 差 分 析 法(One-way analysis of variance,ANOVA)检验。p<0.05时差异具有统计学意义。
2 结果与讨论
2.1 卷烟烟气对细胞存活的影响
BEAS-2B细胞经过不同浓度TPM染毒24 h后的存活率(表1)显示,TPM抑制BEAS-2B细胞存活率具有明显的剂量-效应关系。当TPM浓度大于10 μg/mL时,实验组的细胞存活率相较于对照组有明显的统计学差异。当TPM浓度为10 μg/mL时,细胞存活率为(90.0±2.0)%,结合光镜下BEAS-2B细胞形态(图1a、图1b),该浓度染毒24 h不会对细胞造成明显损伤。因此,后续的染毒条件均选择10 μg/mL染毒24 h。
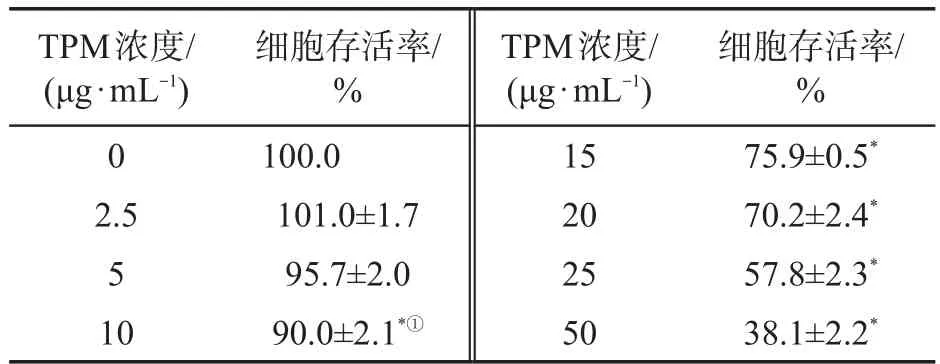
表1TPM染毒对BEAS-2B细胞存活率的影响(n=3)Tab.1 Effect of exposure to TPM on viability of BEAS-2B cells(n=3)
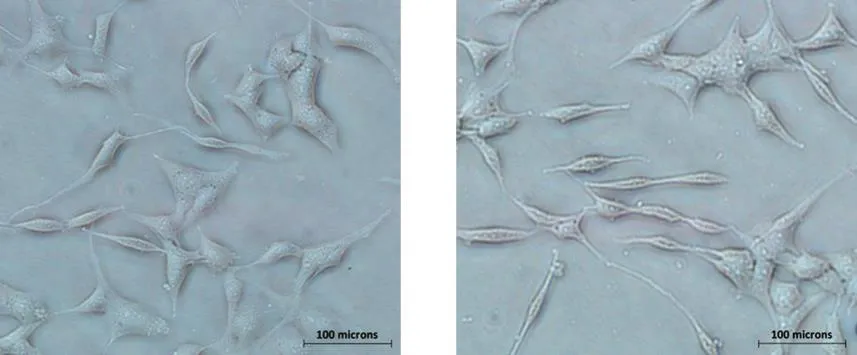
图1TPM染毒对BEAS-2B细胞形态的影响Fig.1 Effect of exposure to TPM on morphology of BEAS-2B cells
2.2 MAPK信号通路参与卷烟烟气诱导的炎症因子释放
MAPK 信号通路包括 ERKs,JNKs和 p38[16],其在免疫反应中具有重要的作用[14],因此本研究选中取ERK1/2、JNK1/2和p38信号通路进行检测。IL-1β、IL-6和IL-8被认为是炎症的关键调节者[17],所以选取炎症因子IL-1β、IL-6和IL-8进行检测。
ERK信号通路的相关结果如图2所示,TPM染毒组的磷酸化ERK1/2表达水平以及细胞上清液中的炎症因子IL-1β、IL-6和IL-8释放水平均显著升高。为进一步探究ERK1/2信号通路是否参与调控卷烟烟气诱导的炎症因子的释放,进行了ERK1/2信号通路抑制实验,在TPM染毒下的ERK1/2特异性抑制剂组中,磷酸化ERK1/2蛋白表达明显被抑制,且细胞上清液中的IL-1β、IL-6和IL-8释放水平相较于无抑制剂处理的TPM染毒组也显著减少。ERK1和ERK2信号通路在调节炎症因子的释放中具有重要作用[18]。有研究[14]表明,卷烟烟气和脂多糖诱导的炎症因子的释放是通过激活ERK信号通路来实现的,抑制ERK可显著缓解炎症;本研究的结果与其结果一致。Shin等[19]通过体内实验验证了抑制ERK信号通路可缓解卷烟烟气诱导的肺部炎症。ERK1/2可通过转录和转录后机制调节炎症因子的释放,而ERK1/2激活下游的TPL2信号通路对炎症因子的释放具有复杂的效应[18],既可刺激Toll样受体(TLR)进而诱导TNF、IL-1β和IL-10的释放[20],又可下调IL-12、干扰素β(IFN-β)和iNOS的产生[21]。
JNK信号通路具有促进炎症的作用,抑制JNK可能会成为炎症相关疾病的有效治疗手段[22]。Tian等[23]发现了一种新的治疗手段,可以明显抑制小鼠肺泡灌洗液中单核细胞趋化蛋白(Monocyte chemoattractant protein,MCP-1)、IL-2、IL-6和IL-10的释放水平,并减少肺组织中JNK和p38蛋白的mRNA水平,该方法可能会减轻卷烟烟气诱导的炎症。在本研究中,JNK1/2相关结果(图3)显示TPM染毒组的磷酸化JNK1/2水平显著升高;在TPM染毒下的JNK1/2特异性抑制剂组中,磷酸化JNK1/2蛋白被明显抑制,细胞上清液中的 IL-1β、IL-6和IL-8释放水平也显著下降。该结果从体外实验水平证明了卷烟烟气诱导的肺细胞炎症受JNK1/2信号通路调节。有研究[18]表明,很多刺激均可以通过激活上游信号通路MAP3K-MAP2K来激活JNK1/2信号通路,但是探究JNK1/2信号通路在后续炎症反应中的生理学机制较为困难,因为该蛋白的缺失会导致胚胎死亡。Martinez等[22]发现选择性敲除JNK1/2的骨髓细胞会减少巨噬细胞中部分M1型巨噬细胞特异性基因的表达,这些基因是体外IFN-γ和脂多糖刺激致病的关键基因,该结果表明巨噬细胞中JNK1/2信号通路具有促炎症作用。
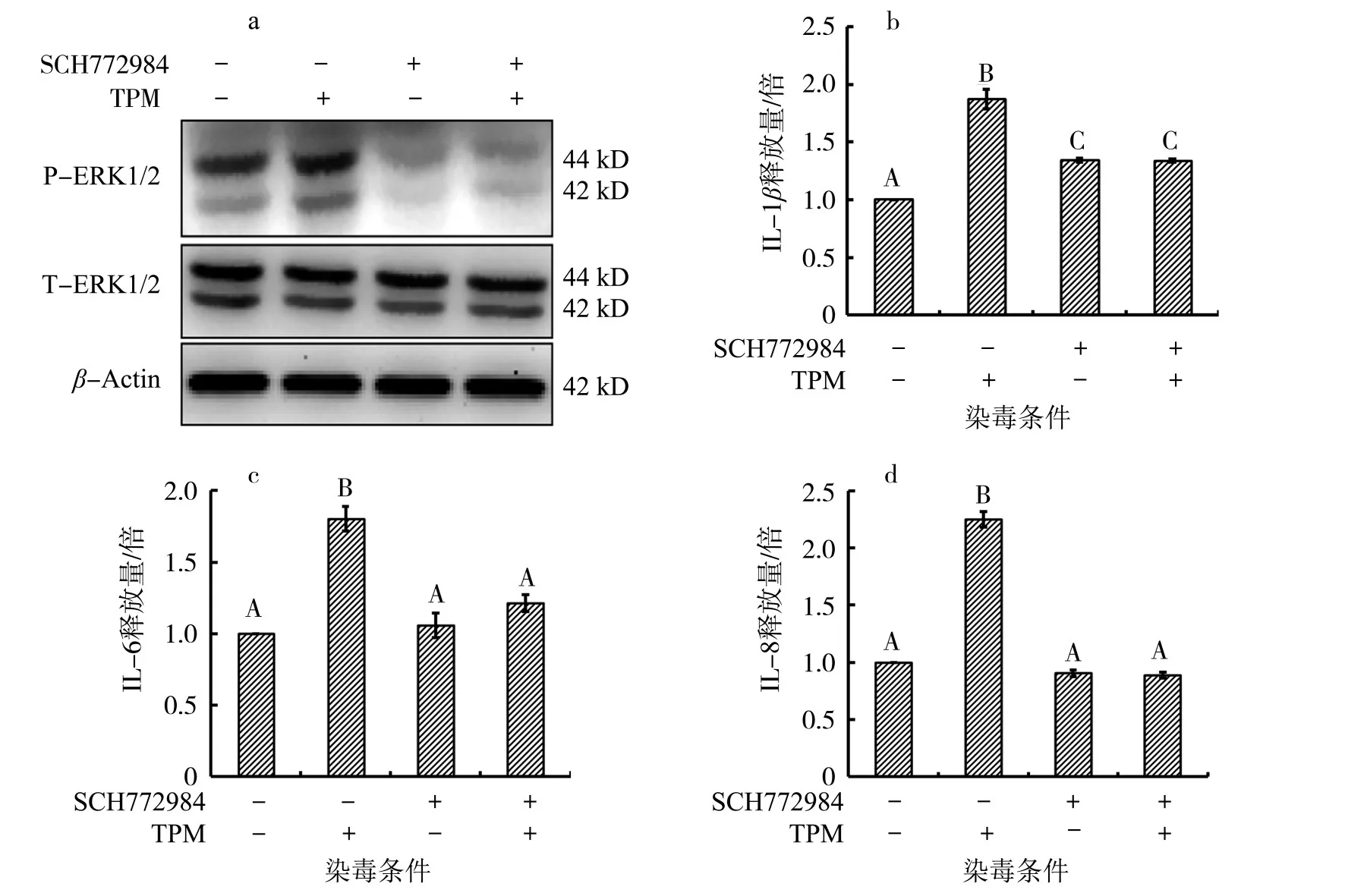
图2ERK1/2参与调控TPM诱导的BEAS-2B细胞炎症因子的释放Fig.2 ERK1/2-regulated release of inflammatory cytokines in BEAS-2B cells induced by TPM

图3 JNK1/2参与调控TPM诱导的BEAS-2B细胞炎症因子的释放Fig.3 JNK1/2-regulated release of inflammatory cytokines in BEAS-2B cells induced by TPM
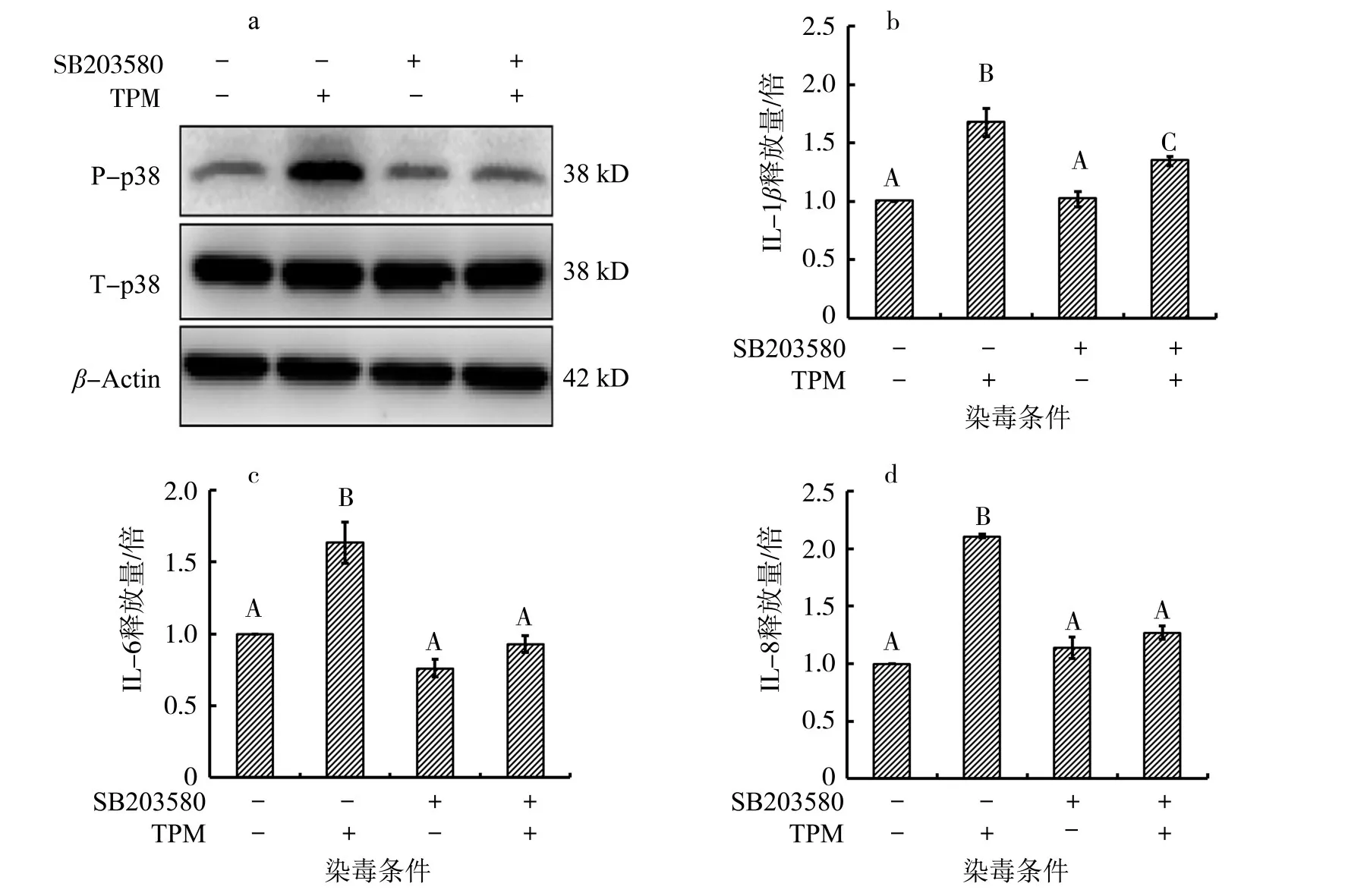
图4 p38参与调控TPM诱导的BEAS-2B细胞炎症因子的释放Fig.4 p38-regulated release of inflammatory cytokines in BEAS-2B cells induced by TPM
本研究中进一步探究了p38信号通路在卷烟烟气诱导的肺细胞炎症中的作用,结果(图4)显示,在TPM染毒组中,磷酸化的p38蛋白水平相较于对照组显著升高;在TPM染毒下,加入p38的特异性抑制剂后,磷酸化的p38蛋白表达被抑制,细胞上清液中的IL-1β、IL-6和IL-8释放水平也被显著抑制。由于p38信号通路可以通过激活负反馈信号通路抑制TLR信号通路来调控炎症,所以其在促炎症因子的产生中具有独特的作用[18]。Kang等[24]发现在p38缺失的小鼠肝脏组织内,炎症因子和趋化因子均显著升高,并募集更多的炎症细胞,表明在急性肝炎中p38信号通路起到了抗炎的保护作用;相反地,在人脂肪细胞中,脂多糖诱导的炎症是通过激活p38/NF-κB信号通路来实现的[25]。由此可以看出,p38信号通路在不同化合物的染毒以及不同暴露部位下可能发挥着不同的作用。
卷烟烟气诱导的炎症不仅受MAPK信号通路的调节,还受到其他信号通路的调控。Rom等[26]综述了在免疫系统的多种细胞体系下,卷烟烟气和烟气提取物可通过NF-κB信号通路来诱导呼吸道炎症和慢性阻塞性肺病等相关疾病;Jiang等[27]发现卷烟烟气首先激活Rac1信号通路,然后调节ERK1/2和信号转导与转录激活因子3(Signal transducers and activator of transcription 3,STAT3)信号通路来诱导小鼠肺细胞中IL-6和炎症趋化因子的释放,最终导致炎症发生;Nguyen等[28]发现Nrf2(NF-E2-related factor 2)信号通路参与细胞内氧化应激和肺部炎症的调控。这些信号通路与MAPK信号通路均参与了卷烟烟气诱导的肺细胞炎症的发生。炎症相关信号通路之间的相互关系还需进一步研究。
3 结论
①卷烟烟气染毒可以引起BEAS-2B细胞炎症因子(IL-1β、IL-6和IL-8)的释放;②卷烟烟气染毒可激活ERK1/2、JNK1/2和p38信号通路;③MAPK信号通路可调节卷烟烟气诱导的炎症因子的释放。该研究结果可为烟草制品健康风险评估提供理论参考。

