半夏胚状体植株再生最适培养基的筛选研究
陶兴魁,高贵珍, 张兴桃, 王海潮
宿州学院生物与食品工程学院,安徽宿州, 234000
半夏(Pinelliaternata(Thunb.) Breit.)是天南星科半夏属多年生草本植物,主要分布在我国长江流域以及东北、华北等地区。在《中国药典》中收录的半夏,以干燥块茎入药,是一种重要的中药材[1]。半夏含有多种化学成分,具有多种药理活性,具有降逆止呕,抗肿瘤、镇咳、抗炎等药理作用[2-3]。半夏野生资源由于过度采挖,濒临枯竭,而传统的人工栽培育种,周期长,繁殖系数不高,再加上受到病毒的侵害,导致药材出现产量不足,质量不高,药效减弱等情况[4-5]。
近些年,国内外的学者利用植物组织培养技术在繁育半夏以及品种改良工作上做了大量工作,取得了很多研究成果,一定程度上缓解了半夏药材的供应需求[6-7]。吴能表等利用半夏叶片和叶柄诱导愈伤组织,由愈伤组织增殖分化成芽,继而生根的途径进行了半夏再生植株的研究[8]。靳松等以半夏茎尖、叶柄和叶片为外植体,研究半夏不定芽和块茎的形成以及生根,建立了半夏组培快繁体系,为利用生物反应器生产半夏小块茎提供了理论依据[9]。饶茜茜等采用荆半夏的叶片、叶柄、珠芽、块茎作为外植体对荆半夏进行快速繁殖研究,结果表明,荆半夏块茎的繁殖系数最高[10]。
目前,前人的研究多是通过外植体—愈伤组织—分化生根的途径建立半夏组织快繁体系。但是通过半夏外植体—愈伤组织—细胞悬浮培养—试管胚状体诱导植株再生方面的研究还较少,因此该课题具有良好的应用前景。半夏由外植体诱导疏松愈伤组织,经细胞悬浮培养形成球形胚状体,继而形成完整植株是组织培养技术的有效途径,本研究通过试验设计获得半夏胚状体植株再生的最适培养基,为半夏组培快繁技术提供参考。
1 材料和方法
1.1 材 料
半夏材料由淮北师范大学资源植物生物学实验室提供,选用半夏试管苗茎段诱导愈伤组织,进行悬浮培养继而形成的球形胚状体。
1.2 方 法
1.2.1 培养基
配制MS培养基,1/2 MS(大量元素1/2)、1/4 MS(大量元素1/4),蔗糖30 g·L-1,pH 5.8液体培养基。
1.2.2 培养条件
每种处理接10瓶,做3个重复,在恒温光照振荡培养箱中进行振荡继代培养,转速100 r·min-1,培养温度23 ℃,光照强度2 000 lx,10 h·d-1光照下进行培养,培养40 d后统计分析胚状体成苗率。
1.2.3 正交试验设计
选用1/4 MS、1/2 MS、MS为基本培养基,附加不同浓度的植物激素细胞分裂素(KT)、生长素(IAA)、赤霉素(GA3),采用4因素3水平的L9(34)正交试验方案配制成液体培养基(见表1)。
1.2.4 数据统计与分析
采用SPSS 17.0软件进行方差分析,胚状体出苗率=接种胚状体数/出苗胚状体数×100%。
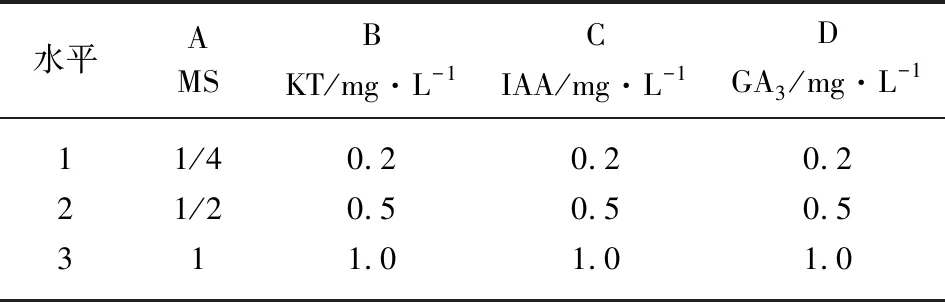
表1 正交试验因素水平表L9(34)
2 结果与分析
2.1 半夏胚状体分化培养基的筛选
培养基编号如表2所示。统计分析结果表明,1、2、3号培养基中的胚状体出现明显的白化现象即由淡绿色变为乳白色(图1),且胚状体的成苗率比其他6种培养基都低,只有35%~45%。5、6号培养基中胚状体的成苗率最高,平均值分别达到93.75%和82.27%,且长势很好(图2)。4、7、8、9号培养基胚状体成苗率在60%~75%之间。

图1 半夏胚状体分化过程中的白化现象

图2 半夏胚状体分化成的试管苗
正交试验结果的极差R值越大,则该因素影响越显著。由表2极差分析表明,因子A的R值最大,因子C的R值最小,即MS对胚状体诱导再生苗的影响最大,而IAA影响最小。4种因素对半夏胚状体再生植株的影响大小依次为:MS>KT>GA3>IAA。正交表中的均值K越大,则代表该因子的某水平越好。表2结果表明,MS的均值K2>K3>K1,说明当MS大量元素浓度小于1/2时,胚状体的出苗率随着MS大量元素的浓度上升而上升;当高于1/2时,成苗率随着MS大量元素浓度上升而下降,因此1/2 MS最适宜诱导胚状体成苗。1/2 MS的A2B1C2D3,A2B2C3D1和A2B3C1D2培养基中,状体诱导成苗最高,平均成苗率可达83.67%。KT的均值K2>K3>K1,说明当KT浓度小于0.5 g·L-1时,胚状体的成苗率随KT浓度的上升而上升;KT浓度大于0.5 g·L-1时,胚状体的成苗率随着KT浓度的上升而下降,因此KT 0.5 g·L-1为胚状体再生植株的适宜浓度。
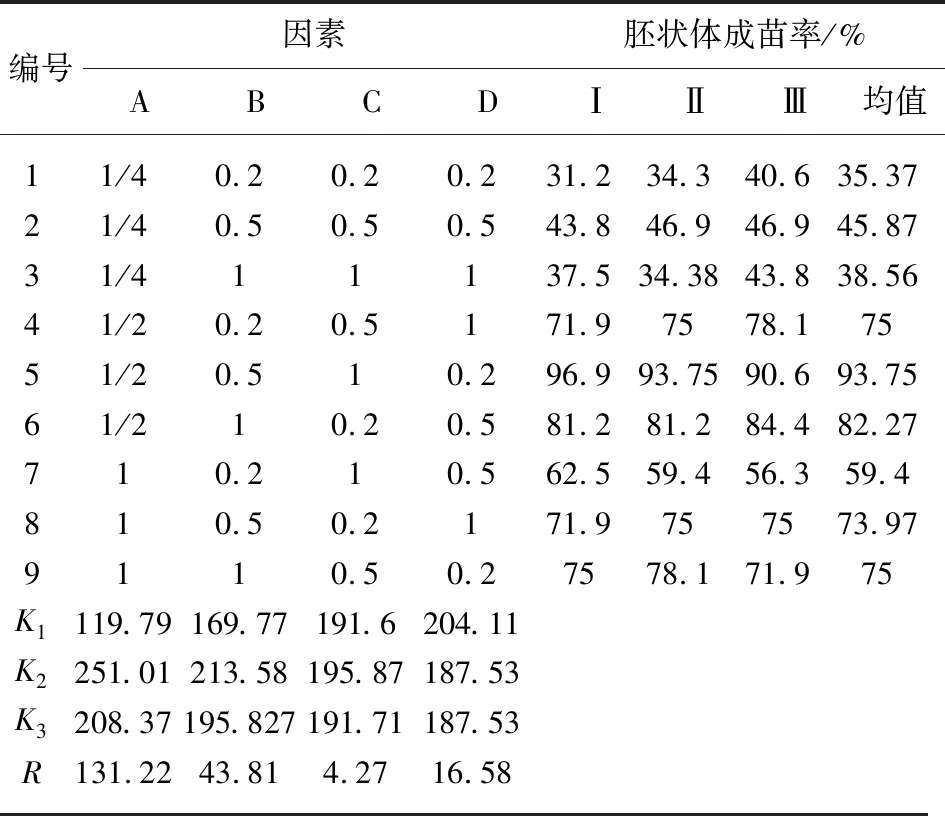
表2 不同培养基对半夏胚状体诱导再生苗的影响
单从诱导胚状体成苗率的角度看,极差分析的结果可以得到,半夏胚状体分化为再生植株培养基的最优组合为A2B2C2D1。通过验证试验结果显示胚状体的诱导成苗率高达98%(表3),显著高于正交表中的9种培养基,从而验证了A2B2C2D1培养基为半夏胚状体分化成苗的适宜培养基,即1/2 MS+KT 0.5 g·L-1+IAA 0.5 g·L-1+GA30.2 g·L-1。
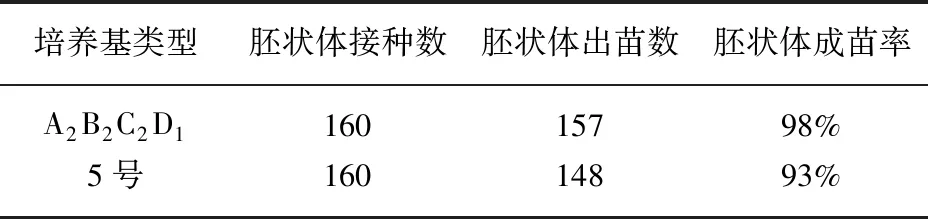
表3 验证试验结果
通过方差分析(表4),因子MS、KT对半夏胚状体诱导再生植株的影响均达到了极显著(P<0.01),GA3和IAA对半夏胚状体诱导再生植株的影响无显著差异。MS是影响半夏胚状体分化成苗的主要因素,结果与极差分析的结果相吻合。因此得出,半夏胚状体分化成苗的最适培养基为1/2 MS+KT 0.5 g·L-1+IAA 0.5 g·L-1+GA30.2 g·L-1。

表4 试验结果数据的方差分析
3 结 语
细胞分裂素和生长素共同调控植物细胞的生长,当细胞分裂素与生长素的比值较大时,可以促进芽的形成,当细胞分裂素与生长素的比值较小时,可以促进根的生成,但是具体的激素浓度和组合情况则要根据不同药用植物的种类、品种、生长发育状况等,采用单因素试验设计、正交设计,通过观察实验现象,得出最佳的激素配比[11]。植物的体细胞胚胎是获得植物再生植株(组培苗)和人工种子,进行植物种群快速繁殖的重要材料[12]。如何高效优质地生产植物体细胞胚,通过体胚进行植物再生已成为近些年的热门研究[13-15]。
本试验研究发现,1/4 MS培养时,胚状体分化过程中发生了白化现象,可能是1/4 MS培养基中的大量元素浓度太低,不能满足细胞器官分化的需要;MS培养时,胚状体分化成苗率不高;1/2 MS时,胚状体的成苗率最高,为最适宜的MS大量元素浓度,说明适当降低大量元素的浓度有利于胚状体分化成苗。综合分析正交试验结果,适宜半夏胚状体诱导植株再生培养基为:1/2 MS+KT 0.5 g·L-1+IAA 0.5 g·L-1+GA30.2 g·L-1。因素MS,KT对半夏胚状体诱导再生植株的影响均达到了极显著,低浓度的KT和IAA有利于胚状体分化成完整植株,细胞分裂素的存在是胚状体分化成完整植株的重要因素。GA3和IAA的影响无显著差异,GA3对半夏胚状体的分化成苗影响不显著,可能是因为在大部分植物组织中,内源GA3的含量是足够的,不需要在培养基中添加额外的GA3。本研究通过液体悬浮培养半夏球状胚状体途径获得再生试管苗,为半夏的再生体系提供新途径,新方法,为半夏大规模细胞培养及其次生代谢产物的提取奠定基础。

