人参皂苷Rg1对大鼠脊髓缺血再灌注损伤中survivin蛋白表达及细胞凋亡的影响
叶劲涛,宋焕瑾,李锋涛,林 磊,薛建利,吴 昊,程 斌
(1. 西安交通大学第二附属医院,陕西西安 710004;2. 汉中市中心医院,陕西汉中 723000)
脊髓损伤的病理过程包括原发性损伤和继发性损伤,脊髓的继发性损伤在原发性损伤的基础上发生,脊髓缺血再灌注损伤(spinal cord ischemia-reperfusion injury, SCII)和炎症反应所产生的细胞外毒素、自由基和炎症介质等引发神经细胞坏死和凋亡,是脊髓继发性损伤的病理基础[1]。
许多研究证实,哺乳动物细胞凋亡主要通过两条途径,外源性凋亡配体途径的激活需要配体与所谓的细胞表面的死亡受体相结合,从而激活半胱天冬酶-8(cysteine aspartic acid specific protease-8, Caspase-8);内源性途径可被代谢、基因等其他因素所激活,导致线粒体完整性被破坏及线粒体通透性改变,该过程导致细胞色素C(cytochrome C, Cyt C)释放。Cyt C一旦释放入胞质,随即组成一个大的超分子复合物apoptosome,从而激活起始因子Caspase-9。无论何种刺激,最终会激活起始caspases,使其下游的caspases活性增高,导致细胞凋亡[2]。凋亡抑制蛋白(inhibitor of apoptosis proteins, IAPs)是一组内源性的抗凋亡因子,它能抑制FasL、Cyt C以及化疗药物引起的细胞凋亡。人类凋亡抑制蛋白家族是唯一的内源性caspase抑制物,该蛋白家族已被发现8种蛋白,其中存活素(survivin)在缺血再灌注相关领域被广泛研究[3-4]。
人参(ginseng)是五加科多年生草本植物,中医应用人参已有两千多年,具有广泛的药理作用。人参的化学成分包括人参皂苷(ginsenosides)及人参多糖(ginseng polysaccharides)等,其中人参皂苷具有抗凋亡、抗氧化、促进记忆、抗衰老、抗疲劳、促进体能恢复、抗焦虑等作用[5-6]。也有相关研究指出,人参皂苷在脑缺血再灌注损伤中起到保护作用[7]。本实验旨在探讨人参皂苷Rg1对于SCII后survivin蛋白及细胞凋亡的影响。
1 材料与方法
1.1 实验动物及主要试剂成年健康雄性SD大鼠120只,6~8周龄,体质量200~230 g,购自西安交通大学医学部实验动物中心,动物等级为清洁级(clean animal)。将实验动物按随机数表法分为4组。动物饲养及实验操作获西安交通大学医学部动物实验管理委员会的批准并符合其动物实验管理条例。人参皂苷Rg1粉剂:上海研生生物技术科技有限公司,有效成分>98%。SP免疫组化试剂盒、DAB试剂:北京博奥森生物技术有限公司。苏木素伊红染液:温州康泰生物科技有限公司。survivin大鼠单克隆抗体、Caspase-9大鼠单克隆抗体:美国Santa Cruz公司。PBS(0.01 mol/L,pH 7.4):实验室自备。
1.2 方法
1.2.1大鼠急性脊髓缺血再灌注损伤模型的建立及分组 所有动物术前禁食12 h,不禁水。药物组大鼠脊髓缺血前30 min腹腔注射人参皂苷Rg1 30 mg/kg[8-9],药物质量浓度为10 mg/mL,术后立即注射1次相同剂量药物。术前采用苯巴比妥钠40 mg/kg腹腔麻醉。颈部备皮消毒后取颈正中切口显露大鼠左侧颈总动脉,与监护仪连接的置入PE50导管,监测近、远端血压(近端导管连接放血装置)。消毒后取大鼠尾根部约1 cm处显露尾动脉,置入PE50导管并连接监护仪,监测远端血压。消毒后沿左侧腹股沟切开暴露左侧股动脉,将F2 Fogarty导管置入,置入10.8~11.4 cm,使得球囊位于左锁骨下动脉分支处。充盈球囊,阻断胸主动脉,同时立即通过放血装置开始放血,将近端平均动脉压维持在45 mmHg。胸主动脉阻断10 min后,放松球囊,恢复胸主动脉血流,将所放出的血液匀速回输。术后皮下注射0.4 mL硫酸鱼精蛋白4 mg。将动物放置于25~30 ℃的保温箱,等待动物苏醒后放回饲养笼中。分别设立4个观察时间点(6、12、24、48 h),即6、12、24、48 h 4个亚组。脊髓缺血组:麻醉满意后采用经股动脉插入Fogarty导管阻断胸主动脉的方法构建大鼠脊髓缺血模型。脊髓缺血再灌注组:在麻醉、脊髓缺血完成后拔除导管,开始再灌注。观察时间点同药物组,亦有4个亚组。假手术组:本组大鼠将接受同其他处理组相同的麻醉与手术,但不诱导脊髓缺血及进行再灌注处理。假手术组、脊髓缺血组各有12只大鼠,脊髓缺血再灌注组及人参皂苷Rg1药物组各有48只大鼠(每个亚组12只)。
1.2.2标本采集 动物按组分别于脊髓缺血完成,再灌注6、12、24、48 h时心脏采血、处死。麻醉后,打开动物胸腔,心脏采血3 mL,室温下放置2 h后1 000 r/min离心10 min取上清,-20 ℃冰箱保存待测。部分动物立即取出腰段脊髓组织,长度约1 cm,用于Western blot及RT-PCR检测。其余动物行左心室升主动脉插管,同时剪开右心房,250 mL生理盐水快速灌洗后,40 g/L多聚甲醛先快后慢继续灌注约30 min左右,至右心房流出清亮多聚甲醛、动物尸体僵硬即可。立即同法取出腰段脊髓组织,放入4 ℃、40 g/L多聚甲醛中后固定24 h,再放入自来水中浸洗24 h,中间换水2~3次,进行石蜡包埋,于腰3节段2 mm范围内连续切片,厚度为10 μm。
1.2.3大鼠后肢神经运动功能评分 分别在干预后各观察时间点,采用大鼠后肢神经运动功能评分(Basso Beattie and Bresnahan score, BBB score)方法[8],对假手术组、脊髓缺血再灌注组及药物组大鼠后肢神经运动功能进行评分。参加评分人员为熟悉评分标准而未参加本组实验人员。
1.2.4免疫组织化学染色 各组脊髓组织石蜡切片脱蜡,梯度乙醇和蒸馏水复水,30 mL/L H2O2孵育30 min,0.01 mol枸橼酸盐缓冲液行抗原热修复,滴加封闭液,室温20 min,滴加survivin/凋亡诱导因子(apoptosis-inducing factor, AIF)一抗(1∶100),湿盒内4 ℃过夜;滴加生物素化二抗工作液,室温20 min;滴加SABC,室温15 min。DAB显色,苏木素轻度复染,自来水冲洗,梯度乙醇脱水,二甲苯透明。采用高清晰彩色医学图文分析系统,每张切片取5个不同视野拍片,进行图像分析,计数脊髓前角survivin/AIF阳性神经元。
1.2.5Western blot检测大鼠脊髓组织survivin及Caspase-9蛋白的表达 配置单去污剂裂解液(PMSF)、电泳缓冲液、转移缓冲液、10×丽春红染液、TBS缓冲液、TBST缓冲液等实验所需主要试剂。用采集的脊髓标本制备脊髓组织样品蛋白,考马斯亮兰法测定脊髓组织蛋白含量后备用。经灌胶、上样、电泳、转印后,将膜用TBS浸湿,移至平皿(内有封闭液)中,使用摇床室温下封闭1 h。将一抗用TBST稀释(1∶200)加入密封袋,并装入PVDF膜,封闭密封袋。室温孵育2 h,再上摇床室温下用TBST洗15 min,共洗3次。使膜与二抗(1∶2 000)稀释液在室温下孵育2 h,上摇床室温下用TBST洗10 min,共洗2次。再用TBS洗10 min。使用ECL法显色后,于Bio-Rad凝胶成像仪上选择免疫印迹协议,进行200 s(每隔2 s)拍照,保存图片。
1.2.6RT-PCR检测大鼠脊髓组织survivin及Caspase-9 mRNA的表达 抽提组织的总mRNA:取出部分冻存组织,将其置于玻璃匀浆器中,按3 mL/100 mg组织比例加入Trizol进行提取。将提取RNA溶于20 μL去核酸酶水中,-80 ℃冻存备用。所提取的总RNA用紫外分光光度仪分析RNA含量和纯度,测定其A260和A280的吸光度,并根据A260/A280的比值评估RNA的纯度。10 g/L琼脂糖凝胶电泳鉴定RNA完整性。
逆转录反应:总反应体系20 μL,含2 μL样品RNA,9 μL DEPC水,1 μL OLigodT,1 μL RNA酶抑制剂,2 μL dNTPs(10 mmol/L),4 μL 5×M-ML Vbuffer,1 μL M-MLVRT。反应条件为:70 ℃ 5 min→42 ℃ 60 min→70 ℃ 10 min,终止反应。
PCR扩增:参照GenBank中的survivin、Caspase-9和β-actin的cDNA序列,合成目的基因survivin、Caspase-9及β-actin的引物(survivin上游引物:5′-TGGACAAACAAAGAGCCAAGAA-3′,下游引物:5′-TAGAGCAAAGCCACAAAACCAA-3′;Caspase-9上游引物:5′-CCAGAGATTCGCAAACCA-3′,下游引物:5′-CCTGACAGCCGTGAGAG-3′;β-actin上游引物:5′-ATTGTAACCAACTGGGACG-3′,下游引物:5′-TCTCCAGGGAGGAAGA-
GG-3′),总反应体系20 μL,包括cDNA 3 μL,1 mmol/L dNTPs 10 μL,10×Taq聚合酶buffer 5 μL,目的基因和β-actin上下游引物各2 μL(10 mmol/L),Mg2+3 μL,去离子水24 μL,Taq酶1 μL。反应条件为:变性94 ℃ 30 s,退火60 ℃ 30 s,延伸72 ℃ 30 s,反应循环数为28。
电泳配制:20 g/L琼脂糖凝胶,使用其对扩增产物进行电泳,拍照。
1.3 统计学处理所有数据均应用SPSS 18.0软件进行软件分析。实验结果采用均数±标准差表示,组间比较采用Student-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠BBB评分结果从表1可以看出,再灌注开始后大鼠的BBB评分即出现显著下降,至12 h下降至最低,此后缓慢上升,到再灌注后48 h仍处于较低水平(P<0.05)。药物组各亚组值虽都较假手术组降低,但与单纯缺血再灌注组相比,各时间点值均上升(P<0.05)。
表1 不同组别大鼠各时间点的BBB评分结果
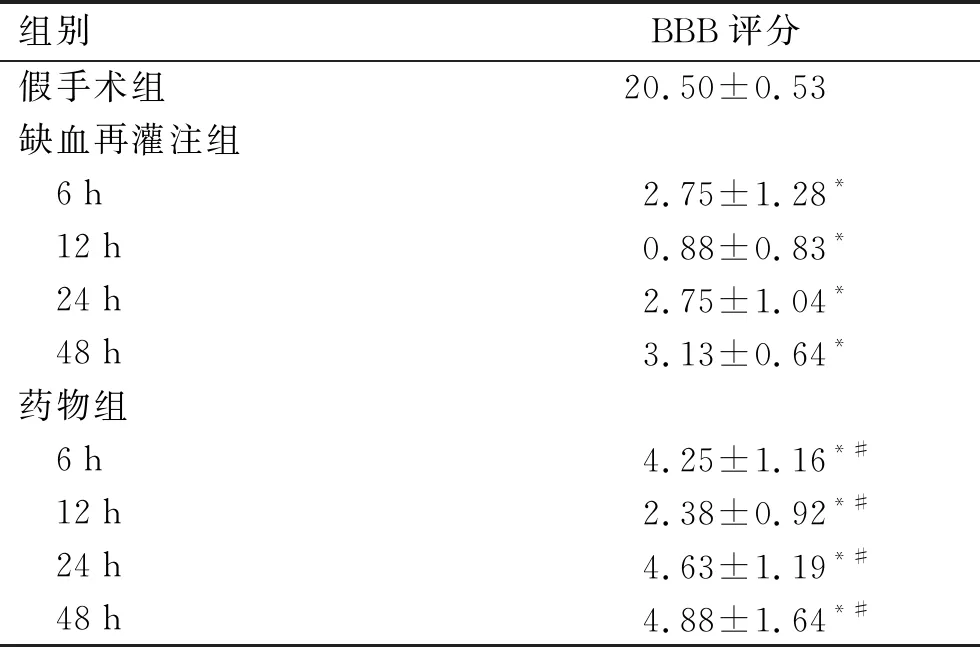
组别BBB评分假手术组20.50±0.53缺血再灌注组 6h2.75±1.28* 12h0.88±0.83* 24h2.75±1.04* 48h3.13±0.64*药物组 6h4.25±1.16*# 12h2.38±0.92*# 24h4.63±1.19*# 48h4.88±1.64*#
与假手术组比较,*P<0.05;与缺血再灌注组对应时间点比较,#P<0.05。
2.2 各组大鼠脊髓survivin、AIF蛋白免疫组织化学染色结果从表2中可以看出,缺血前脊髓组织survivin基本不表达,胞质内AIF蛋白及凋亡神经细胞基本没有出现。缺血后survivin及AIF蛋白阳性细胞开始增多(P<0.05),survivin蛋白位于胞质,AIF蛋白位于胞质和(或)胞核。药物组各亚组survivin蛋白阳性细胞均较脊髓缺血再灌注组增多(P<0.05),而AIF阳性细胞计数值均较缺血再灌注组减少(P<0.05)。神经元凋亡与人参皂苷Rg1诱导的survivin蛋白表达呈负相关,与AIF蛋白水平呈正相关(图1、图2)。
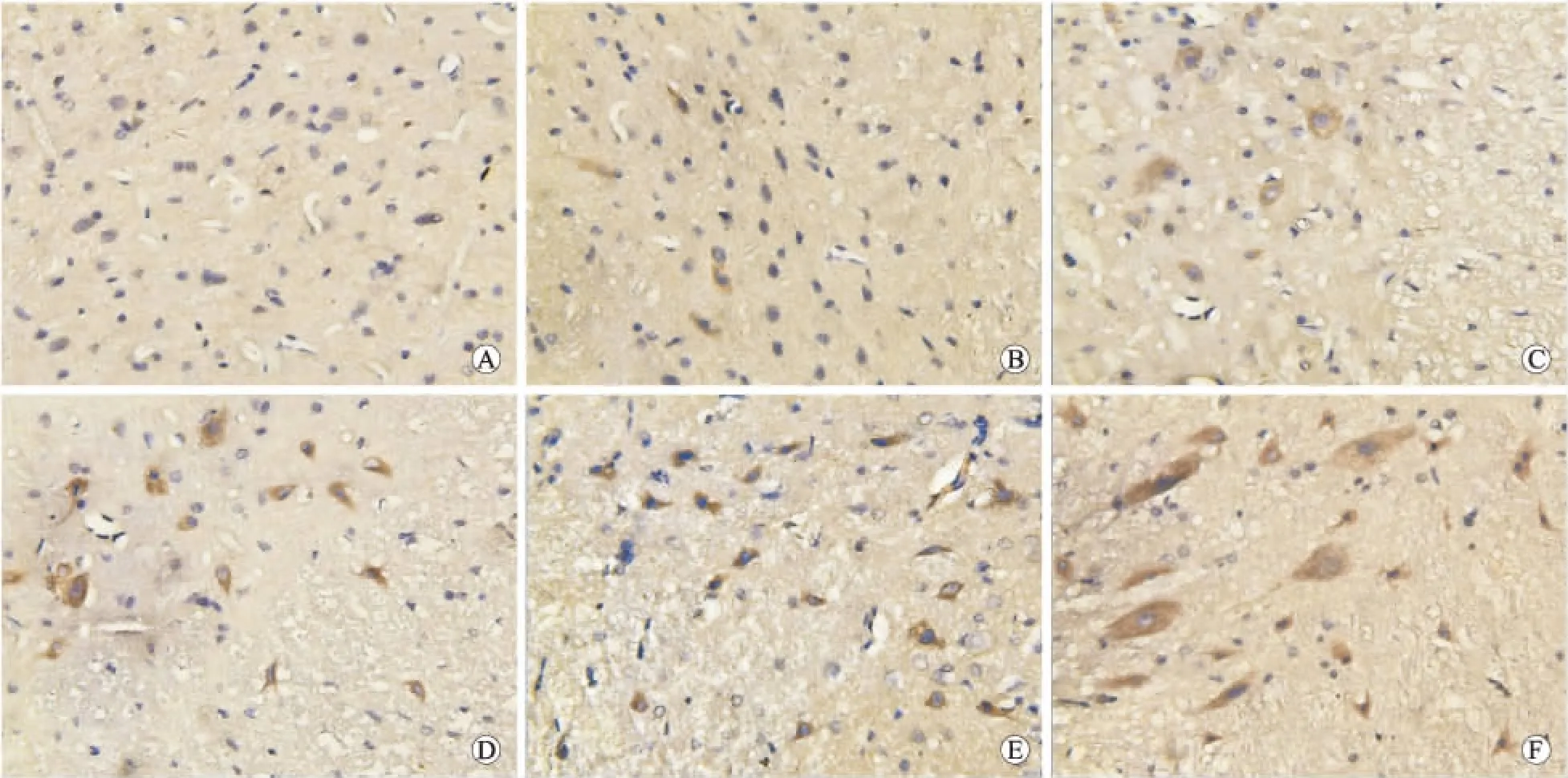
图1 大鼠脊髓survivin免疫组化染色结果
Fig.1 The immunohistochemical staining of survivin in the spinal cord
A:假手术组;B:脊髓缺血组;C:脊髓缺血再灌注组6 h;D:药物组6 h;E:脊髓缺血再灌注组48 h;F:药物组48 h(n=12,×400)。
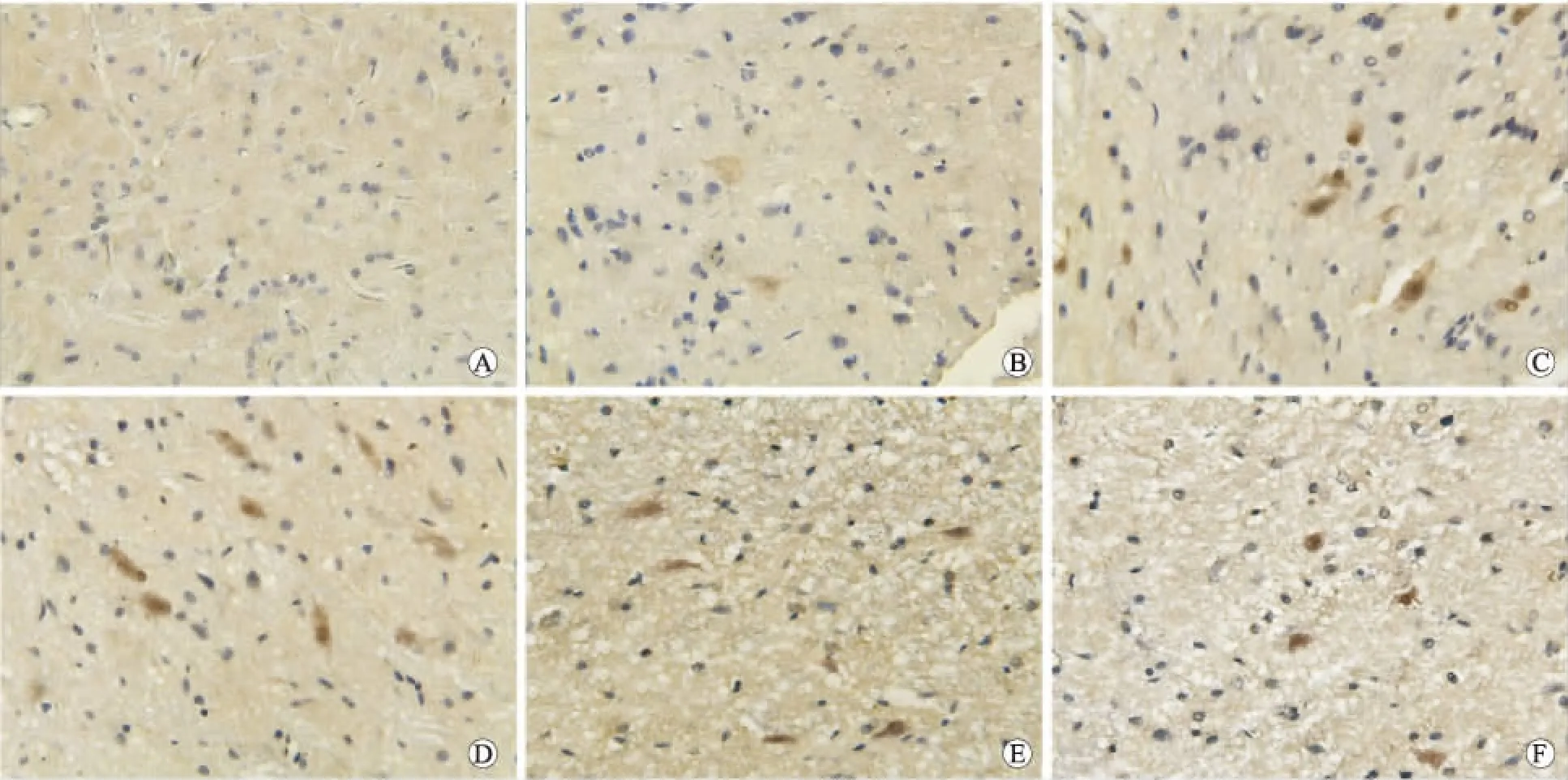
图2 大鼠脊髓AIF免疫组化染色结果
Fig.2 The immunohistochemical staining of AIF in the spinal cord
A:假手术组;B:脊髓缺血组;C:脊髓缺血再灌注组6 h;D:药物组6 h;E:脊髓缺血再灌注组48 h;F:药物组48 h(n=12,×400)。
2.3 各组大鼠脊髓survivin、Caspase-9的Western blot检测结果从表3中可以看出,缺血前脊髓神经元survivin及Caspase-9蛋白基本不表达,缺血后即见少量表达,至再灌注后表达继续上升。survivin蛋白到再灌注后48 h仍有上升趋势,Caspase-9蛋白自再灌注12 h表达至高峰后开始下降。药物组各亚组值与单纯缺血再灌注组相比,survivin含量各时间点值均上升,Caspase-9含量各时间点值均下降(P<0.05,图3)。
2.4 各组大鼠脊髓survivin、Caspase-9的RT-PCR检测结果从表4中可以看出,缺血前脊髓神经元survivin及Caspase-9基因基本不表达,缺血后即见少量表达,至再灌注后表达继续上升。survivin基因到再灌注后48 h仍有上升趋势,Caspase-9基因自再灌注12 h表达至高峰后开始下降,药物组各亚组与单纯缺血再灌注组相比,各时间点值均下降(P<0.05,图4)。
表2 不同组别大鼠各时间点脊髓组织survivin及AIF阳性细胞计数结果
组别survivinAIF假手术组0.40±0.770.50±0.78缺血组5.23±2.22*4.50±2.30缺血再灌注组 6h11.57±3.43*10.13±3.95 12h17.47±3.88*16.07±4.29 24h22.43±3.94*9.47±3.08 48h24.20±4.34*9.10±3.24药物组 6h14.97±4.62*#8.17±2.94 12h21.70±3.91*#11.97±3.34 24h27.50±3.76*#6.53±3.08 48h27.57±4.35*#7.10±3.10
与假手术组比较,*P<0.05;与缺血再灌注组对应时间点比较,#P<0.05。
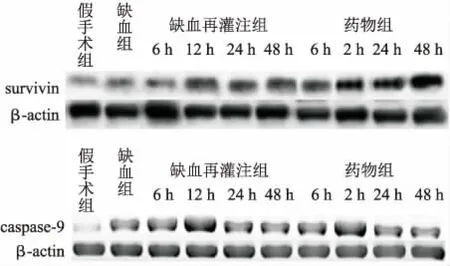
图3 大鼠脊髓Western blot检测结果
Fig.3 Expressions of survivin and Caspase-9 in spinal cord tissues
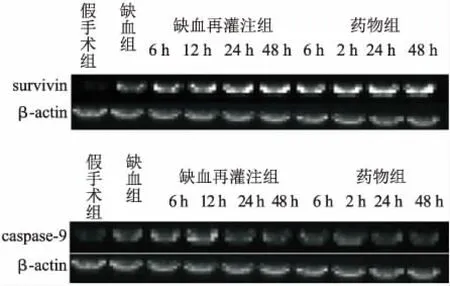
图4 大鼠脊髓RT-PCR电泳结果
Fig.4 Results of spinal cord RT-PCR electrophoresis
表3 不同组别大鼠各时间点脊髓组织survivin及Caspase-9蛋白表达的比较
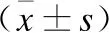

组别survivin/β-actinCaspase-9/β-actin假手术组0.02±0.010.08±0.01缺血组0.32±0.03*0.90±0.08*缺血再灌注组 6h0.40±0.02*1.75±0.06* 12h0.45±0.03*1.91±0.04* 24h0.49±0.02*1.54±0.06* 48h0.52±0.02*1.47±0.05*药物组 6h0.46±0.04*#1.64±0.05*# 12h0.50±0.02*#1.81±0.04*# 24h0.59±0.04*#1.42±0.03*# 48h0.61±0.03*#1.38±0.05*#
与假手术组比较,*P<0.05;与缺血再灌注组对应时间点比较,#P<0.05。
表4 不同组别大鼠各时间点脊髓组织survivin及Caspase-9基因表达的比较
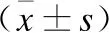

组别survivin/β-actinCaspase-9/β-actin假手术组0.14±0.020.23±0.02缺血组0.56±0.03*0.51±0.06*缺血再灌注组 6h0.64±0.04*0.62±0.04* 12h0.73±0.04*0.89±0.05* 24h0.81±0.03*0.53±0.03* 48h0.80±0.03*0.52±0.04*药物组 6h0.70±0.05*#0.53±0.03*# 12h0.81±0.04*#0.75±0.03*# 24h0.87±0.00*#0.42±0.05*# 48h0.86±0.03*#0.44±0.04*#
与假手术组比较,*P<0.05;与缺血再灌注组对应时间点比较,#P<0.05。
3 讨 论
SCII是由于脊髓损伤、外科手术等原因造成的,由于其损伤机制复杂,且其中存在很多不可逆的病理生理过程,至今仍被认为是一种无特殊治疗方法的疾病。多年来,人们对其机制进行的大量的基础研究和临床观察,认识到其是造成脊髓神经损伤的一个重要因素。SCII的机制包括兴奋性中毒与酸中毒、氧化应激及自由基造成的损伤、炎性浸润、高能磷酸化合物的缺乏、细胞凋亡等。各损伤机制相互联系,构成一个复杂的网络[9]。程序性细胞死亡(programmed cell death, PCD)在正常细胞动态平衡中具有很重要的作用。有研究认为,凋亡是一种能量依赖、程序性的细胞死亡,并且从形态学特征上描述了细胞皱缩、膜起泡、染色质浓缩、DNA碎裂。同时,该进程的失调与许多疾病相关,如癌症、自身免疫紊乱及神经退变性疾病及缺血。实验性动物模型如阶段性脊髓缺血显示,细胞的存活/死亡信号通路参与了SCII的发病。凋亡的形态学及生化证据在实验性脑缺血损伤动物模型中已被找到。本研究发现,人参皂苷Rg1干预后,大鼠后肢神经运动功能药物组较缺血再灌注组明显改善,说明人参皂苷Rg1对于大鼠SCII后功能恢复确实有一定的作用。通过对AIF的检测,可以得知人参皂苷Rg1对于由脊髓缺血再灌注损伤引起的凋亡具有干预作用,然而具体干预的途径尚未可知。AIF的结果亦表现出凋亡在脊髓缺血再灌注的发生过程中起到了重要作用,抑制凋亡可以明显减轻脊髓缺血再灌注后的损伤。
参与哺乳动物凋亡的一系列caspases的特征性改变已被观测到。到目前为止,14种哺乳动物caspases已被确认,至少有8种在凋亡过程中起重要作用。凋亡caspases有2种:起始因子(如Caspase-8、Caspase-9、Caspase-10)及执行因子(如Caspase-3、Caspase-7)。起始caspases作为单体存在,并通过可以导致它们激活的凋亡蛋白酶联合募集结构域(caspase-associated recmitment domains, CARDs)或死亡效应域(death effector domain, DED)与其他蛋白相互作用。被激活的起始因子裂解并激活了执行因子的前体。激活的执行caspases依次裂解细胞中其他的与凋亡进程有关的蛋白底物。已有多项研究证实,caspases参与SCII过程。在神经元死亡过程中,caspases的重要性已被认识。Caspase-3、Caspase-9是参与凋亡的主要的2种caspases,而一些caspases如Caspase-11及Caspase-12仅在病理条件下激活[10-12]。有很多证据可证明神经缺血能引起caspases激活。在局灶及全脑缺血的动物模型中,发现在神经元死亡之前有Caspase-3的活性上调。在动脉粥样硬化导致的中风发生数小时内,可见Caspase-3前体水平升高[13]。Caspase-2是一种启动酶,位于线粒体凋亡途径的上游,当Bax从胞质转位于线粒体时激活该酶,从而诱导CytC和第2种线粒体源性caspase激活蛋白的释放,而后激活Caspase-9[14]。Caspase-9是凋亡的线粒体途径中的关键分子,可通过裂解Caspase-3酶原等效应caspases,切割多二磷酸腺苷聚合酶[poly(ADP-ribose)polymerase, PARP]和多种其他细胞内的底物,最终导致细胞凋亡[15]。多种人参皂苷的信号传递途径均与凋亡有关。亦有研究证实,人参皂苷的干预确有促进/抑制细胞凋亡活动的作用。Caspase-9基因表达及蛋白含量在正常脊髓中处于低水平,自脊髓缺血后开始上升,至再灌注12 h至高峰后开始下降。药物组各亚组值与单纯缺血再灌注组相比,各时间点Caspase-9的表达及含量均下降(P<0.05),说明在人参皂苷Rg1干预下Caspase-9表达下降。而脊髓缺血再灌注中凋亡是由Caspase-9作为主要的起始因子,而人参皂苷Rg1对于Caspase-9的抑制作用,亦考虑与其抑制线粒体途径的凋亡有关。线粒体参与了坏死及凋亡途径,这依赖于凋亡信号的强度。神经组织缺血的严重打击使得线粒体生成ATP功能障碍。尽管caspase依赖的凋亡需要ATP,但是ATP的突然下降仍能诱导细胞死亡[16]。活体实验证实,在死亡刺激下,线粒体通透性升高,使得CytC、procaspase-9及Apaf-1释放。在ATP或dATP存在时,Apaf-1与Cyt C形成多聚复合体。procaspase-9募集Apaf-1及Cyt C复合体,并自我裂解,这个全酶被称作apoptosome,启动了下游凋亡级联[17]。在一过性及永久性神经缺血中,caspase-9激活Caspase-3,这一切均强烈提示在脑缺血后,线粒体介导的凋亡通路机制有caspases参与。人参皂苷Rg1通过稳定线粒体外膜,减少了Cyt C释放入胞质的量。而在人参皂苷Rg1干预下,caspase-9的mRNA含量减少,可能与procaspase-9无法与Cyt C及Apaf-1结合形成apoptosome而在细胞内堆积有关,推测这其中有一个负反馈机制,但这并未得到证实。从以上研究结果可确定,人参皂苷能够抑制某些在凋亡信号转导途径中具有重要作用的分子,进而达到抑制细胞凋亡的目的。
人survivin基因位于第17号染色体的q25带上,基因长度14.7 kb,相对分子质量16 500,含有4个外显子和3个内含子,其转录编码产生一个由142个氨基酸组成的蛋白质[18]。survivin的组织分布具有明显的细胞选择性,主要在胚胎组织及胸腺、胎盘等成熟组织中表达。除了抗凋亡外,survivin参与细胞有丝分裂的调控,其mRNA在G1期表达极低,S期为G1期的6倍,G2/M期则增高至40倍;survivin还参与血管生成的诱导,survivin还可通过促进肿瘤血管内皮细胞的存活而起到放疗抵抗的作用[19]。目前多数研究着眼于肝癌、肺癌、宫颈癌等肿瘤的研究,也有部分研究涉及脑及肾缺血再灌注损伤,而对于SCII未曾涉及。从实验中可见,正常大鼠脊髓神经元基本不表达survivin蛋白,从脊髓缺血后即见survivin基因少量表达,蛋白含量增高,至再灌注后基因表达及蛋白含量继续上升,至再灌注后48 h仍有上升趋势。其含量变化与caspase-9及AIF表达相反,提示survivin蛋白可能通过抑制caspase-9表达而达到抑制凋亡的目的。AIF位于线粒体内膜,是位于线粒体的核基因编码的黄素蛋白,分子质量为67 ku,具有NADH氧化活性。SCII过程中,线粒体膜受损,AIF通过线粒体膜被释放入细胞质,移位进入细胞核,激活核酸内切酶G,将DNA分子切割为50 kb左右的片段,诱导非caspase依赖的凋亡[20]。在神经系统,AIF移位发生在各种不同的毒性攻击之后,包括NMDA介导的兴奋性中毒、全脑缺血、局灶性脑缺血等过程中[21]。本课题组前期的研究也表明,在兔SCII模型中,可以见到血清及脊髓组织中AIF明显升高,而灯盏细辛预处理可以抑制这种变化[22]。同理,在本实验中可见缺血再灌注组中AIF明显升高,而在人参皂苷干预组AIF值则明显低于缺血再灌注组,说明人参皂苷也具有相同的功能。
综上所述,本研究结果显示,在大鼠SCII过程中,人参皂苷Rg1可通过促进survivin表达从而抑制caspase-9的表达,起到抑制凋亡的目的,发挥保护作用。这为人参皂苷Rg1在临床上的应用提供了动物实验依据。

