5种血清学标志物对急性呼吸窘迫综合征的诊断和预后预测价值
曾宪飞,卢东雪,张西京,李军民
(1. 武警陕西省总队医院检验科,陕西西安 710054;2. 空军军医大学西京医院麻醉科,陕西西安 710032)
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是肺泡毛细血管膜损伤所致的肺脏急性炎症过程,以弥漫性肺泡损伤、肺血管内皮和肺泡上皮屏障破坏、肺间质和肺泡内蛋白渗出及炎性细胞浸润、毛细血管血栓形成等为病理特征,临床表现为顽固性低氧血症及难治性急性呼吸衰竭,病死率高达35%~50%[1]。目前缺乏特异的血清标志物,严重影响了ARDS的早期诊断和及早治疗,已成为其高死亡率的重要原因之一[2]。
血管生成素(angiopoietin 2, Ang-2)是内皮激活及其功能失调和屏障破坏的潜在标志;Ⅱ型肺泡细胞表面抗原(krebs von den lungen 6, KL-6)主要由增殖和激活的肺泡Ⅱ型上皮细胞分泌,可能成为肺泡损伤的直接标志物;肺表面活性蛋白D(surfactant protein D, SP-D)主要来源于肺泡Ⅱ型上皮细胞和下呼吸道Clara细胞,是评价气血屏障完整性的指标,具有肺组织特异性;血管性血友病因子(von Willebrand factor, vWF)可用于评价内皮细胞损伤程度,也是透明膜的组份之一;白介素8(interleukin-8, IL-8)是机体炎症反应的重要细胞因子,主要生物学活性是趋化和激活中性粒细胞。结合ARDS肺损伤机理和病理特征,理论上上述5种蛋白或细胞因子都可能成为肺损伤标志物。本研究主要观察血清Ang-2、KL-6、SP-D、vWF和IL-8在ARDS中的变化,以及早期诊断和预后评价价值,拟为降低ARDS病死率提供临床依据。
1 资料与方法
1.1 研究对象采用前瞻性研究设计,连续收集2016年12月至2018年1月西京医院重症医学中心和武警陕西省总队医院重症医学科收治的49例ARDS患者作为研究队列,参照“柏林定义”(2012)[3]进行ARDS诊断和分度。以同期连续收集的50例非ARDS患者作为对照组。研究纳入标准:年龄18~89岁,入ICU前氧合指数>300 mmHg,签署知情同意书;排除肿瘤、血液病、慢性肾脏疾病、自身免疫性疾病、孕妇、使用免疫抑制剂、心肺复苏后、慢性肺部疾病致急性呼吸衰竭。本研究经医院医学伦理委员会审核批准。
1.2 研究方法研究对象入重症医学中心(科)时(T1)、诊断为ARDS时(T2)采集静脉全血4 mL,室温放置60 min后2 500×g离心10 min,加样枪吸取血清-80 ℃保存。收集入选患者年龄、性别、BMI、原发疾病等基本资料,检测并监测血气分析、C反应蛋白、血常规、血生化等,记录急性生理学与慢性健康状况评分系统(APACHEⅡ)评分、Murray肺损伤评分、序贯器官衰竭评分(SOFA)。随访病例28 d,记录住院时间、病死率。
通过酶联免疫吸附实验(ELISA)检测血清Ang-2、KL-6、SP-D、vWF、IL-8水平,检测试剂为R&D Systems(Ang-2、SP-D)、Abcam(vWF、IL-8)和USBiological Life Sciences(KL-6)产品,按操作说明书进行。
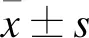
2 结 果
2.1 患者的临床基本资料研究对象的基本资料见表1。ARDS组和非ARDS组的年龄、性别构成、BMI、原发疾病构成比差异无统计学意义(P>0.05)。ARDS组PaO2/FiO2低于非ARDS组(P<0.001),APACHEⅡ评分、Murray肺损伤评分、SOFA评分高于非ARDS组(P<0.005),两组间住院时间和28 d病死率差异有统计学意义(P<0.05)。不同程度ARDS分别为轻度11例(22%)、中度21例(43%)、重度17例(35%)。
2.2 血清标志物水平的变化血清标志物在两个时间点的水平见表2。在T1(入科时)时间点,ARDS组5种标志物水平高于非ARDS组(P<0.05)。T1时间点和T2(诊断ARDS时)时间点比较,ARDS组在T2的氧合指数低于T1(P<0.05),5种标志物水平均高于T1(P<0.05)。ARDS患者中死亡组(n=17)与存活组(n=32)比较(表3),死亡组的Ang-2、KL-6、SP-D、IL-8水平均高于存活组(P<0.05);但两组间vWF水平差异无统计学意义(P>0.05)。
表1 ARDS与非ARDS患者的临床基本资料
Tab.1 Clinical characteristics of the ARDS and non-ARDS patients
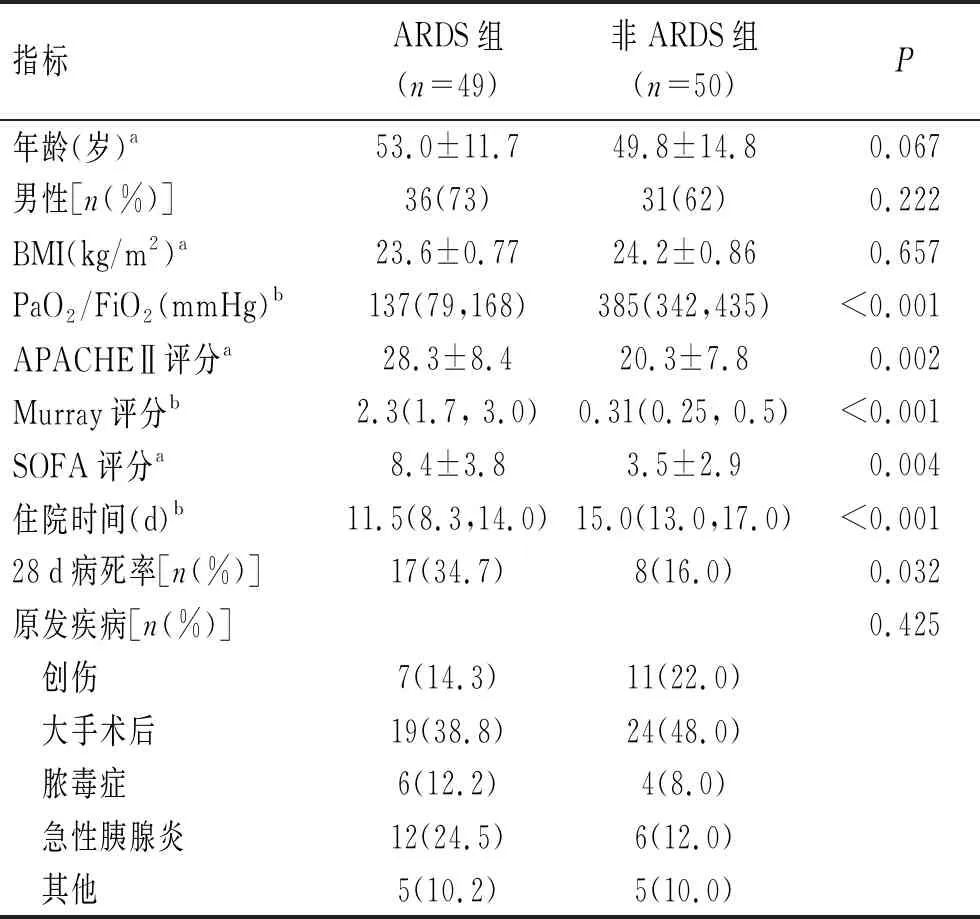
指标ARDS组(n=49)非ARDS组(n=50) P年龄(岁)a53.0±11.749.8±14.8 0.067男性[n(%)]36(73)31(62)0.222BMI(kg/m2)a23.6±0.7724.2±0.860.657PaO2/FiO2(mmHg)b137(79,168)385(342,435)<0.001APACHEⅡ评分a28.3±8.420.3±7.80.002Murray评分b2.3(1.7, 3.0)0.31(0.25, 0.5)<0.001SOFA评分a8.4±3.83.5±2.90.004住院时间(d)b11.5(8.3,14.0)15.0(13.0,17.0)<0.00128d病死率[n(%)]17(34.7)8(16.0)0.032原发疾病[n(%)]0.425 创伤7(14.3)11(22.0) 大手术后19(38.8)24(48.0) 脓毒症6(12.2)4(8.0) 急性胰腺炎12(24.5)6(12.0) 其他5(10.2)5(10.0)
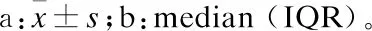
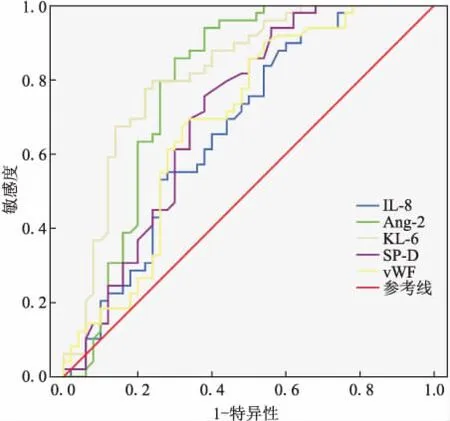
2.3 血清标志物早期诊断ARDS的效能评价通过ROC分析(图1),5种血清标志物(T1)诊断ARDS的曲线下面积(AUC)由大到小为:KL-6>Ang-2>SP-D>vWF>IL-8。其中,KL-6在截点2.9 ng/mL诊断ARDS的灵敏度0.765,特异度0.792,阳性预测值0.796,阴性预测值0.760。血清标志物(T1)两两联合诊断ARDS,最大AUC达0.869(95%CI: 0.795, 0.942)(KL-6+Ang-2)。
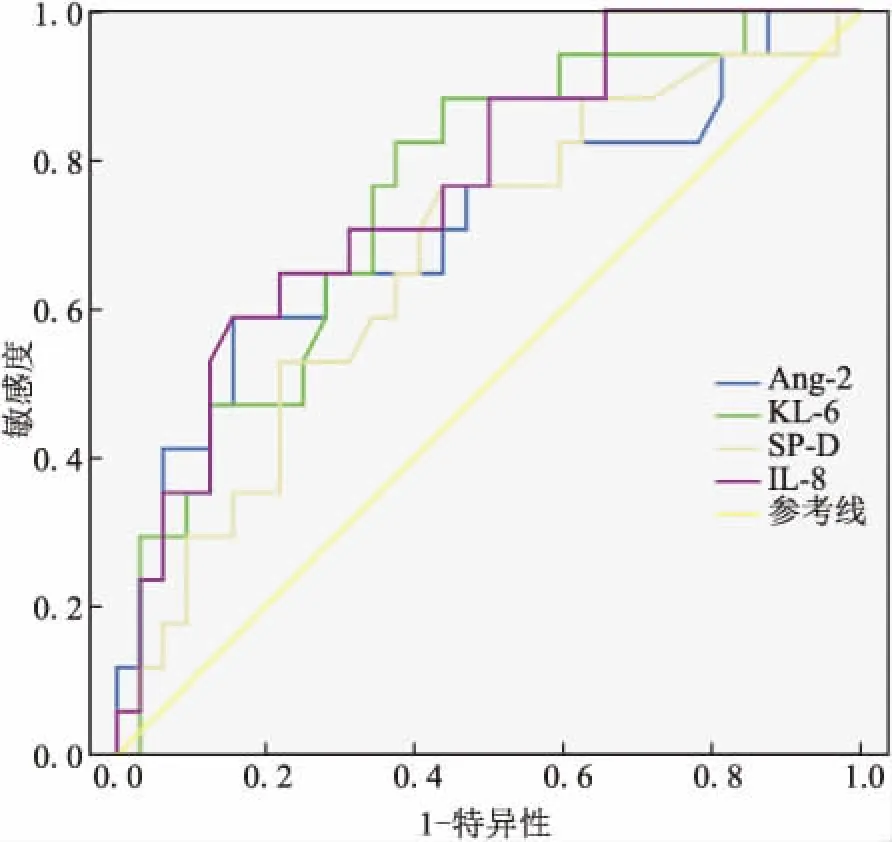
2.4 血清标志物预测患者预后的效能评价应用血清标志物(T2)预测ARDS预后(图2),结果表明,IL-8、KL-6、Ang-2、SP-D曲线下面积与0.5进行比较,差异有统计学意义(P<0.05),各标志物诊断截点及相应的灵敏度、特异性,阳性预测值(PPV)、阴性预测值(NPV)见图2;vWF-AUC与0.5比较差异无统计学意义(P=0.308),对预测ARDS预后的价值不大。5种标志物两两联合预测ARDS预后(图3),AUC排前两位的分别是IL-8+KL-6,IL-8+Ang-2。
3 讨 论
美国-欧洲共识会议(American-European Consensus Conference, AECC)(1994)和“柏林定义”(2012)[3]依据临床特点、影像学表现和动脉血气分析对ARDS进行临床诊断和分度,不但难以实现早期诊断,也仅具有中等水平的诊断灵敏度和特异性[4-5],至少10种疾病容易被误诊为ARDS[5]。发掘可靠、稳定、易获取的ARDS诊断、预后预测标志物尤为重要,利于提高诊断和预测能力,实现早诊断早治疗。本研究观察了5种血清生物学标志物在ARDS中的变化,以及预测其发生发展和临床预后的价值。这些标志物涉及肺脏内皮屏障破坏、肺泡损伤、机体炎症反应等多个方面。
表2 各组患者不同时间点血清标志物水平的比较
Tab.2 Serum levels of the biomarkers at different time points
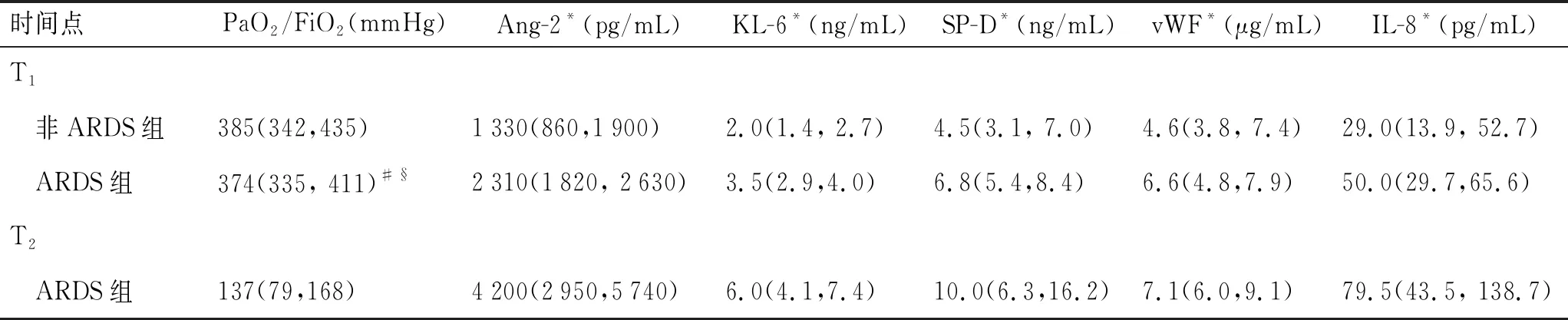
时间点PaO2/FiO2(mmHg)Ang-2*(pg/mL)KL-6*(ng/mL)SP-D*(ng/mL)vWF*(μg/mL)IL-8*(pg/mL)T1 非ARDS组385(342,435)1330(860,1900)2.0(1.4, 2.7)4.5(3.1, 7.0)4.6(3.8, 7.4)29.0(13.9, 52.7) ARDS组374(335, 411)#§2310(1820, 2630)3.5(2.9,4.0)6.8(5.4,8.4)6.6(4.8,7.9)50.0(29.7,65.6)T2 ARDS组137(79,168)4200(2950,5740)6.0(4.1,7.4)10.0(6.3,16.2)7.1(6.0,9.1)79.5(43.5, 138.7)
3组间比较,*P<0.001;与非ARDS组比较,#P=0.454;与T2ARDS组比较,§P<0.001。
表3 ARDS患者死亡组与存活组标志物水平的比较(T2时间点)
Tab.3 Serum levels of the biomarkers in death and survival ARDS patients at T2time-point

组别Ang-2(pg/mL)KL-6(ng/mL)SP-D(ng/mL)vWF(μg/mL)IL-8(pg/mL)死亡组5690(3830, 6730)* 7.4(6.6, 9.2)#14.1(10.0, 18.2)* 8.0(7.2, 10.0)§139.5(62.3,154.3)*存活组3540(2940,5130) 5.0(4.0, 7.3)8.5(6.3,13.2) 7.1(6.1,11.1)58.2(36.2,90.5)
与存活组比较,*P<0.001;与存活组比较,#P=0.004;与存活组比较,§P=0.308。
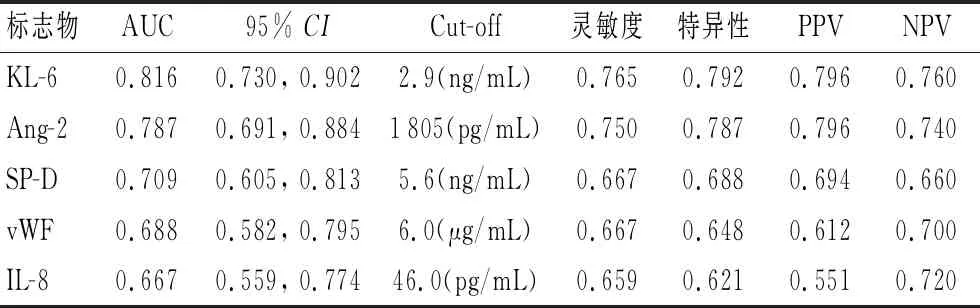
标志物AUC95% CICut-off灵敏度特异性PPVNPVKL-60.8160.730, 0.9022.9(ng/mL)0.7650.7920.7960.760Ang-20.7870.691, 0.8841805(pg/mL)0.7500.7870.7960.740SP-D0.7090.605, 0.8135.6(ng/mL)0.6670.6880.6940.660vWF0.6880.582, 0.7956.0(μg/mL)0.6670.6480.6120.700IL-80.6670.559, 0.77446.0(pg/mL)0.6590.6210.5510.720
图1 血清标志物(T1)诊断急性呼吸窘迫综合征的ROC分析
Fig.1 ROC of biomarkers at T1time-point for ARDS diagnosis
AUC:曲线下面积;95%CI:95%可信区间;Cut-off:截点值;PPV:阳性预测值;NPV:阴性预测值。
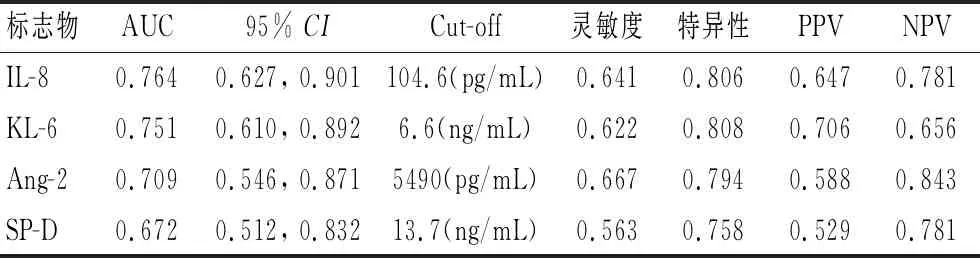
标志物AUC95% CICut-off灵敏度特异性PPVNPVIL-80.7640.627, 0.901104.6(pg/mL)0.6410.8060.6470.781KL-60.7510.610, 0.8926.6(ng/mL)0.6220.8080.7060.656Ang-20.7090.546, 0.8715490(pg/mL)0.6670.7940.5880.843SP-D0.6720.512, 0.83213.7(ng/mL)0.5630.7580.5290.781
图2 血清标志物(T2)预测预后不良的ROC分析
Fig.2 ROC of biomarkers at T2time-point for poor prognosis
AUC:曲线下面积;95%CI:95%可信区间;Cut-off:截点值;PPV:阳性预测值;NPV:阴性预测值。


标志物组合AUC95% CIIL-8+KL-60.8290.715, 0.943IL-8+Ang-20.7890.651, 0.926图3 血清标志物(T2)联合预测预后不良的ROC分析Fig.3 ROC of biomarker panels (T2 time-point) for poor prognosisAUC:曲线下面积;95% CI,95%可信区间。
研究结果表明,在未发生ARDS时(入科时,T1),ARDS组血清标志物水平高于非ARDS组,随着病情进展,诊断ARDS时(T2)标志物水平高于T1,表明5种标志物均有可能成为诊断标志物;ARDS病例中死亡组与存活组比较,Ang-2、KL-6、SP-D和IL-8水平在T2均不同程度升高,证明它们可能是预后判断的良好指标。上述结果与文献报道一致[6-8]。进一步行ROC分析,KL-6和Ang-2具有较好的诊断准确度(AUC为0.70~0.90),联合KL-6+Ang-2可提高诊断效能(AUC:0.869),但5项指标联合(Ang-2+KL-6+SP-D+vWF+IL-8)未明显提高AUC[0.878(95%CI: 0.807, 0.949)],且5项指标联合应用难度大、成本高,KL-6+Ang-2是本研究中最佳的ARDS诊断组合。2014年,一项纳入54项研究3 753人的Meta分析表明[9],KL-6是诊断ARDS最相关的血清标志物,比值比为6.1(95%CI: 3.0, 12.1),本研究中KL-6诊断效能最高,具有最大AUC(0.816),与上述Meta分析结论一致。
目前,国内外大多采用入院第1天或入院几天后的标志物水平预测ARDS死亡[8,10-11]。然而,重症患者病情发展快,理论上以“入院时间点”作为观察点不及“病情变化时间点”更反映预后,原因是前者固定,但后者(本研究中的T2)属动态时间点,不同患者、病情的T2不同。但在动态时间点预测ARDS预后鲜见报道。AGRAWAL等[12]报道了采血后6 h内发生急性肺损伤重症患者的血清标志物水平的预测价值,时间点与本研究T2接近,但样本量小(n=19)。研究结果证实,T2时间点预测效能好于固定时间点。王冉等[13]报道,入组24 h内Ang-2血清水平预测24 d死亡AUC为0.67,本研究T2Ang-2水平预测28 d死亡的AUC更高(0.71)。
IL-8在急性肺损伤中发挥中性粒细胞趋化效应。一项大样本研究(n=528)证明,血清IL-8与其他指标(APACHE Ⅲ+年龄+SP-D+IL-8)联合预测死亡的AUC为0.834[14];CARTIN-CEBA等[15]评估了6种标志物的预后预测价值,只有发生ARDS后1 d内的血清IL-8水平与多器官功能衰竭密切相关。本研究表明,4种标志物中IL-8预测28 d死亡的AUC(0.764)最大,具有中等预测价值,其余标志物的AUC不理想,与上述研究一致。本研究中,IL-8与KL-6联合应用可提高预测效能(AUC 0.829),而4项联合(Ang-2+KL-6+SP-D+IL-8)预测死亡的AUC为0.833,相对于“IL-8+KL-6”无差异,考虑到难以应用4项指标的联合预测模式,本研究认为,“IL-8+KL-6”模式可满足临床需求。
关于vWF预测ARDS死亡的研究,袁超等[6]报道,诊断ARDS第1天vWF预测死亡的ROC-AUC为0.91。然而,本研究中死亡组和存活组在诊断ARDS时(T2)血清vWF并无统计学差异(P=0.308,表3),二元Logistic回归分析证实vWF不具有预测ARDS死亡的价值(OR=1.002,P=0.748),ROC分析的AUC为0.589(95%CI: 0.424, 0.755),与AUC 0.5无统计学差异,这些结果不支持vWF作为死亡预测标志物,与宗晓龙等[8]的研究结果相似。研究结果的差异可能与研究对象不同有关。有研究表明[10,16],肺内源性ARDS和肺外源性ARDS的vWF水平有统计学差异,但孰高孰低尚有争议,CALFEE等[16]报道,肺内源性ARDS的血浆vWF水平低于肺外源性ARDS,但ZHENG等[10]研究结果却正好相反。所以,纳入对象中肺内外源性ARDS所占比例不同可能导致结论不一,需更大样本量、区分肺内外源性ARDS及统一vWF检测方法的多中心研究获得结论。
通过设立不同时间点、运用多种血清标志物诊断和预测ARDS及预后的研究,本研究认为,危重患者入院时血清KL-6和Ang-2水平可早期诊断ARDS;诊断ARDS时的血清IL-8和KL-6可预测28 d死亡,同时,上述标志物联合应用更具临床价值。研究结论为血清标志物的临床应用,对促进ARDS早诊断早治疗、降低死亡率具有实际意义。

