Turbohawk减容治疗下肢动脉硬化闭塞的短期疗效观察
秦 皓,张 波,魏 莉,刘亚民
(西安交通大学第一附属医院:1. 周围血管科;2. 手术麻醉部,陕西西安 710061)
近年来,周围动脉疾病(peripheral artery disease, PAD)特别是下肢动脉疾病对人群健康和医疗系统造成越来越大的影响和负担,若不积极治疗,可进展为重症肢体缺血(critical limb ischemia, CLI)。在非血运重建的CLI患者中,约50%的患者将在1年进行大截肢,据文献报道膝上和膝下截肢的围手术期死亡率分别为5%~10%和15%~20%[1]。既往开放式手术血运重建下肢动脉血供一直是CLI的首选治疗方法[2]。近年来,随着腔内技术的提高和经验的积累,以及介入器材的不断更新和进步,经皮腔内血管成形术(percutaneous transluminal angioplasty, PTA)及支架植入术(percutaneous transluminal stenting, PTS)治疗下肢动脉缺血的适应证极大拓展,作为一种有效的非手术方法己广泛应用于临床。但是,在股-腘动脉应用PTA或PTA+PTS治疗后的远期通畅率依然不理想,单纯PTA的2年通畅率仅有30%,而PTA+PTS治疗股腘动脉的2年一期通畅率也仅有64.2%[3]。这可能与股腘动脉病变局部力学环境及斑块病变弥漫等相关。如何提高下肢动脉腔内治疗的远期通畅率,是亟待解决的重要临床问题。经皮动脉斑块旋切术是针对此而新兴的微创腔内技术。西安交通大学第一附属医院自2016年率先在陕西省开展下肢动脉硬化闭塞症的血管腔内斑块旋切减容术,取得了良好的短期效果,现报道如下。
1 资料与方法
1.1 一般资料2016年7月至2017年10月西安交通大学第一附属医院施行的15例行下肢动脉血管腔内斑块旋切术患者作为旋切组,回顾性分析临床资料;将同期内治疗的284例下肢动脉硬化闭塞患者,按1∶1匹配选择15例作为对照组,保证两组间年龄、性别、临床表现、动脉硬化危险因素及下肢动脉闭塞部位、长度等参数匹配(P>0.05)。所选患者术前均完善踝臂指数(ABI)、下肢动脉CTA及TASC分期等相关评估。
1.2 药物治疗所有患者在积极控制动脉硬化危险因素基础上,均给予肠溶阿司匹林100 mg/d+氯比格雷75 mg/d的双联抗血小板治疗(DAPT)72 h以上,若CYP2C19基因型提示为中间代谢或慢代谢型,则每日更换2次氯比格雷为替格瑞洛90 mg[4]。术中按80~100 IU/kg静脉推注普通肝素进行全身肝素化。围手术期给予生理盐水1 mL/(kg·h),持续6~24 h预防造影剂肾病[5]。术后继续给予双联抗血小板聚集治疗并持续3月,阿司匹林继续服用。
1.3 手术操作Turbohawk斑块旋切组:术中采用健侧股动脉穿刺入路,应用“翻山技术”将Cook 7F抗折长鞘置入病变侧髂外动脉。路图引导下应用VER导管指引,用Terumo 0.035亲水导丝通过股腘动脉病变段。通过时导丝尽可能不呈袢推进,减少内膜下通过概率。跟入导管造影证实位于病变远端血管真腔后,更换Abbott Commond ES 0.014导丝。置入美国EV3 Turbohawk TM斑块旋切系统到达病变部位,先试行通过病变部位,若可通过则回退至病变近端开始旋切操作,若直接通过受阻则置入3 mm球囊对病变进行预扩张。旋切操作时由助手打开旋切系统开关,术者将Turbohawk导管由旋切靶病变近端向远端以约2 mm/s的速度缓慢推进,当推进至靶病变远端8~10 mm处时,助手关闭旋切系统开关,撤回Turbohawk导管至靶病变近端。用Turbohawk导管尾端的方向控制旋钮调整旋切刀头方向约90°后再重复如上操作。共旋切前、后、左、右共4个象限,平均每个象限旋切2~3次。旋切结束后撤出Turbohawk导管,取出收集仓中的斑块碎片。造影观察靶血管通畅情况,若靶病变部位残余狭窄>70%,则再次置入Turbohawk旋切导管针对靶病变斑块凸起方向进行2次旋切1~3次;若残余狭窄>50%且<70%,则置入与靶血管直径匹配球囊进行后扩张;若残余狭窄<30%,则不再予继续旋切或球囊后扩张。
球囊扩张+支架置入(PTA+PTS)术:对照组均采用传统PTA+PTS治疗。入路建立工作导丝轨道操作方式同上。置入3 mm球囊扩张导管对靶病变进行预扩张,再根据靶病变血管直径置入匹配球囊导管进行后扩张。球囊品牌包括Cordis Savvy Long、Boston Mustang及Boston Sterling SL。后扩张后造影观察靶血管情况,在最狭窄、钙化严重及限流夹层处“点式”置入支架,支架产品包括Cordis Smart Control、Abbott Absolute、EV3 EverFlex。支架置入后再次造影,根据情况置入球囊导管行支架内后扩张。
1.4 观察指标观察比较两组患者术中支架置入率、术后临床症状缓解率,术后3月及6月的ABI变化,应用超声检查血管通畅率。
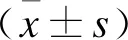
2 结 果
2.1 两组患者基线数据的比较两组患者的一般资料、临床表现及客观检查指标差异无统计学意义(P>0.05),具有可比性(表1、表2)。
表1 两组患者一般资料的比较
Tab.1 Comparison of general data between the two groups

组别例数男性[n(%)]年龄(岁)吸烟[n(%)]高血压[n(%)]糖尿病[n(%)]高脂血症[n(%)]旋切组1513(86.7)69.10±7.912(80.0)13(86.6)10(66.6)11(73.3)对照组1512(80.0)70.07±9.513(86.7)14(88.8)12(80.0)10(66.7)
表2 两组患者临床表现和客观评估的比较
Tab.2 Comparison of clinical manifestations and objective indicators between the two groups

组别例数症状[n(%)]间歇性跛行静息痛ABITASC分期[n(%)]ABCTA示病变位置[n(%)]股动脉上段股动脉下段旋切组1510(66.7)5(33.3)0.54±0.082(13.3)13(86.7)3(20.0)12(80.0)对照组1511(73.3)4(26.7)0.51±0.123(20.0)12(80.0)4(26.7)11(73.3)
2.2 两组患者观察指标的比较两组患者均为单侧肢体治疗,均成功重建靶病变血流,技术成功率100%。旋切组15例患者中,有1例球囊后扩张后出现限流夹层,置入Abbott Absolute支架1枚,支架置入率6.7%(1/15);对照组15例患者中有13例患者置入支架,支架置入率86.7%(13/15),其中Cordis Smart Control 3枚、Abbott Absolute 8枚、EV3 EverFlex 2枚,2例患者球囊后扩张后无残余狭窄及内膜片撕裂征象,未予置入支架。旋切组术后测术侧ABI 0.83~1.12,平均1.01±0.23;对照组术后术侧ABI 0.81~1.09,平均0.97±0.21,两组患者临床症状均得到缓解,症状缓解率100%。
术后3月随诊资料,旋切组有1例患者ABI<0.8,下肢动脉超声显示术侧肢体血管再狭窄>50%,通畅率93.3%(14/15),因患者无明显症状未予2次干预;对照组有2例患者ABI<0.8,下肢动脉超声提示,1例支架再狭窄50%~79%,另1例提示支架内闭塞予2次球囊扩张术,通畅率86.7%(13/15)。
术后6月,旋切组1例患者ABI<0.8,下肢动脉超声提示为血管狭窄50%~79%,给予2次球囊扩张,通畅率93.3%(14/15);对照组有4例患者ABI<0.8,下肢动脉超声提示3例支架内再闭塞,1例支架内狭窄70%~99%,通畅率73.3%(11/15),均予2次球囊扩张,术中发现其中1例患者支架连接桥断裂(表3)。
表3 两组患者术后临床指标的比较
Tab.3 Comparison of postoperative clinical indicators between the two groups

组别例数支架置入率*(%)症状缓解[n(%)]ABI术后3月ABI<0.8通畅率(%)重返手术[n(%)]术后6月*ABI<0.8通畅率(%)重返手术[n(%)]旋切组156.715(100)1.01±0.23193.30193.31(6.7)对照组1586.715(100)0.97±0.21286.71(6.7)473.34(26.7)
两组患者的支架置入术率和治疗后6月指标组间差异有统计学意义,*P<0.05。
3 讨 论
目前,随着血管疾病治疗理念的更新,血管腔内技术的不断进步和经验积累,介入器材的日新月异,越来越多的下肢动脉疾病患者和CLI患者的首选治疗方式是血管腔内治疗。但是,下肢动脉硬化的钙化病变是影响腔内治疗远期效果的重要因素,并且严重钙化是确定是否补救置入支架的重要指标[1,6-7]。有研究结果显示,单纯PTA组与支架组治疗后12月的再狭窄率分别为67%和37%,支架断裂率2%,支架组6、12、24月的再狭窄率分别为24%、37%、45.7%[8]。LAIRD[9]结果显示,PTS与PTA组12月的非重返手术率分别87.3%和45.1%,3年为75.5%和41.8%。有研究对支架内再狭窄(in-stent restenosis, ISR)进行分级(Ⅰ级局限性狭窄、Ⅱ级弥漫性狭窄、Ⅲ级完全闭塞),2年的Ⅰ、Ⅱ、Ⅲ级ISR的发生率分别为49.9%、53.3%和84.8%[10]。这提示,虽然PTS较单纯PTA有较高的通畅率,但支架置入后的远期通畅率并不理想,依然存在较高的ISR发生率和重返手术率。
股腘动脉PTA及PTS术后发生再狭窄的主要机制包括血栓形成、血管弹性回缩、内膜过度增生。尽管指南推荐单抗血小板治疗PAD,但这很可能还不够[11-13]。而目前在PAD的腔内治疗后暂没有证据推荐最佳抗血小板治疗方案。本研究中所有患者均基于并参考与冠心病(CAD)有关的研究给予双联抗血小板聚集(DAPT)治疗,即使应用相同的DAPT方案,在心血管和外周血管的结果可能存在差异。研究表明,与冠脉PCI术后相比,PAD腔内治疗患者中氯吡格雷无反应的发生率高出30%[14]。可见,抗栓治疗不充分可能是PAD患者腔内治疗后管腔狭窄的一个重要因素。本研究中所有患者根据CYP2C19基因分型,筛查出对氯比格雷应答率中/低的患者并更换为替格瑞洛治疗,所有患者未发生急、慢性血栓事件。
现阶段的研究发现,再狭窄的发生是由于动脉损伤后的自我修复过程中的一种失衡状态,其本质是一种各种炎症介质等介导的自愈反应[15]。NANCY[16]综合文献报道,股腘动脉段支架有较高的断裂率,可达65%。这可能是由于股腘动脉的解剖因素使其较其他外周血管有更特殊的周围力学环境,除承受周围肌肉的挤压力外,还有肌肉、关节活动时所产生的扭力、拉伸力、压缩、弯曲等复杂的生物应力,导致其自身形态随肌肉、关节的活动而改变[17-18],从而使该段血管PTS后支架所承受作用力过大而产生支架断裂,也可能与ISR的发生密切相关。由此,对于股腘动脉段的腔内治疗“Leave Nothing Behind”的无支架理念逐渐产生[19-20],应用腔内减容、药物涂层球囊(drug-coated balloons, DCB)、可降解生物支架(bioresorbable vascular scaffold, BVS)等减少股腘动脉的支架异物残留以提高远期通畅率。
斑块腔内旋切技术是利用斑块旋切导管对靶病变进行切割清除,以减少斑块体积和减少失血量的有效方式[21]。目前,国内应用的斑块旋切导管是美国EV3公司的Silverhawk和Turbohawk,其由切割导管和驱动手柄两部分组成。切割导管的头端是锥形的斑块收集仓,切割刀头非工作时位于收集仓内。收集仓的尾端为切割工作窗口,启动驱动手柄时切割刀头回退至工作窗口并与导管形成夹角,刀头位于窗口顶部与靶病变斑块贴合并高速旋转,往前推进导管时刀头将靶病变处斑块刮下。在一次切割结束后,关闭驱动手柄,将切割刀头送入收集仓的同时将刮下的斑块碎片推入收集仓内。切割导管与驱动手柄的连接处有方向调节旋钮,可转动调整切割窗口与导管夹角的朝向以调整切割刀头指向。Turbohawk为Silverhawk后的新型升级产品,其切割刀头由原来的1组刀片增加至4组刀片,刀片的转速由原来的8 000 r/min增加至10 000 r/min,增加了切割效率,更适合坚硬的钙化病变。本研究中旋切组患者的支架置入率明显低于对照组,术后6月的管腔通畅率高于对照组,重返手术率较对照组相对降低。分析原因为斑块旋切过程中针对严重狭窄、钙化病变进行斑块旋切,不但减少了管腔内斑块体积,并且在旋切过程中割断了斑块的纤维环,再辅以球囊扩张能够更好撕裂斑块纤维,减少了弹性回缩的发生;另外,旋切组有较低的支架置入率,减少了因支架断裂等机械性因素导致的再狭窄发生。国内外均有在Turbohawk使用过程中应用远端保护装置来预防旋切过程中栓塞事件的发生[22-23]。但本研究中旋切组的15例患者均未应用远端保护装置,且无远端栓塞事件发生。考虑原因可能是我院开展旋切技术初期挑选病例主要为A、B级的TASC患者,病变长度相对短且以严重狭窄、次全闭塞为主;并且在操作过程中缓慢推进旋切导管,切割完毕后助手前推驱动手柄开关至底部并锁定,防止回撤导管时斑块碎屑自收集仓中脱落。若助手将驱动手柄开关推至底部感觉收集仓内容物满时,应退出旋切导管清理收集仓后再进行下一次切割,以有效避免斑块碎屑导致栓塞事件概率。
综上所述,应用Turbohawk旋切系统治疗下肢动脉硬化疾病安全有效,对比传统PTA+PTS治疗方式在短期内取得了相对满意的效果,其远期效果仍需进一步随访观察。但是,单纯斑块旋切治疗中远期的效果并非很满意[23-24],这可能与旋切后的内膜损伤导致的内膜修复、过度增生等反应相关,尽管有文献报道,联合药物涂层球囊(DCB)技术可能有更好的远期通畅率[25],但仅仅是小样本的单臂研究,尚需通过今后的多中心大样本随机对照临床研究进一步验证。

