阿帕替尼在晚期肿瘤中的疗效及安全性分析
王瑾,张延顺,王勇,付宝宝,王琛琛
(安徽淮南市第一人民医院肿瘤血液科,232001)
在恶性肿瘤的流行过程中,常常出现复发、转移、而在肿瘤的发生及转移过程中,研究发现肿瘤新生血管发挥重要作用。然而早1971年,Folkman博士首次提出了肿瘤生长和转移需要血管生成的过程的观点,即通过抑制肿瘤血管的生成可以达到治疗肿瘤的目的。目前的研究已经证实许多通路参与了肿瘤新生血管的形成,比如血管内皮生成因子(VEGF)及血管内皮生成因子受体(VEGFR)介导的通路。目前在晚期肿瘤的治疗中,国内外均提出了抗肿瘤血管生长因子治疗[1-2],阿帕替尼作为我国自主研制抗血管生成药物,其应用的疗效及安全性如何?本文对30例肿瘤晚期患者(二线及以后治疗)应用阿帕替尼进行了经验总结。
1 资料与方法
1.1 一般资料 回顾性分析我科2016年12月至2018年4月接受甲磺酸阿帕替尼治疗的30例晚期肿瘤患者病历资料,男20例,女10例;年龄范围26~82岁,平均年龄57.3岁;≤65岁22例、>65岁8例;美国东部肿瘤协作组(ECOG)评分1分6例、2分13例、3分11例;治疗时机在二线为12例、三线及以后为18例;单药治疗为24例,联合化疗为6例。
所有患者均为Ⅳ期患者,既往接受二线或二线以上治疗失败或疾病进展的患者。
1.2 方法 所有患者均接受甲磺酸阿帕替尼治疗,初始剂量为250 mg或500 mg,部分患者联合化疗,所有患者均在早餐后服用,1次/天,28 d为一个治疗周期,治疗期间患者出现与阿帕替尼相关的Ⅳ度不良反应或患者出现不可耐受的不良反应时,予以停药。
1.3 观察指标 根据 实体瘤的疗效评价标准(RECIST )评价标准,肿瘤的疗效评价分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。总缓解率(RP)=(完全缓解+部分缓解)/100%,疾病控制率(DCR)=(完全缓解+部分缓解+稳定)/总病例数%。无进展生存期(PFS):从患者开始接受阿帕替尼治疗开始计算起至疾病进展、死亡或失效。总生存期(OS):从患者接受阿帕替尼治疗开始至患者死亡或失效。不良反应:参照WHO颁布的抗肿瘤药物不良反应CTCAE 4.0版,体系评分,分为Ⅰ—Ⅳ度。
1.4 随访 采用出院病例,门诊复查,电话回访等方式进行随访,末次随访截止日期为2018年5月1日,随访时间以月为单位。肿瘤预后评价指标:PFS。
1.5 统计学处理 采用SPSS 17.0统计学软件进行分析。不同因素对RP和DCR的影响采用χ2检验。PR+SD组和PD组的生存分析建立Kaplan-Meier生存模型,生存率的组间比较采用Long-rank检验。影响生存期的多因素分析采用Cox回归模型。检验水准α=0.05。
2 结果
2.1 近期疗效观察 本研究所选病例中,查阅病历,30例患者均具有完整的临床资料,经患者知情同意均口服阿帕替尼联合或不联合化疗治疗。根据RECIST评价标准,其中无CR患者,PR患者4例,SD为15例,DCR为63.3%,PD 7例。
2.2 阿帕替尼不良反应 发生率根据不良反应分级,出现Ⅳ级不良反应有1人,已停药。见表1。

表1 30例晚期肿瘤患者不良反应及分级(例)
2.3 阿帕替尼与晚期肿瘤患者生存期的关系 在30例随访病例中,其中死亡病例5例,占19.23%(5/26),发现PR+SD组PFS高于PD组,具有一定的生存优势,两组之间差异有统计学意义(P=0.039)。见图1。
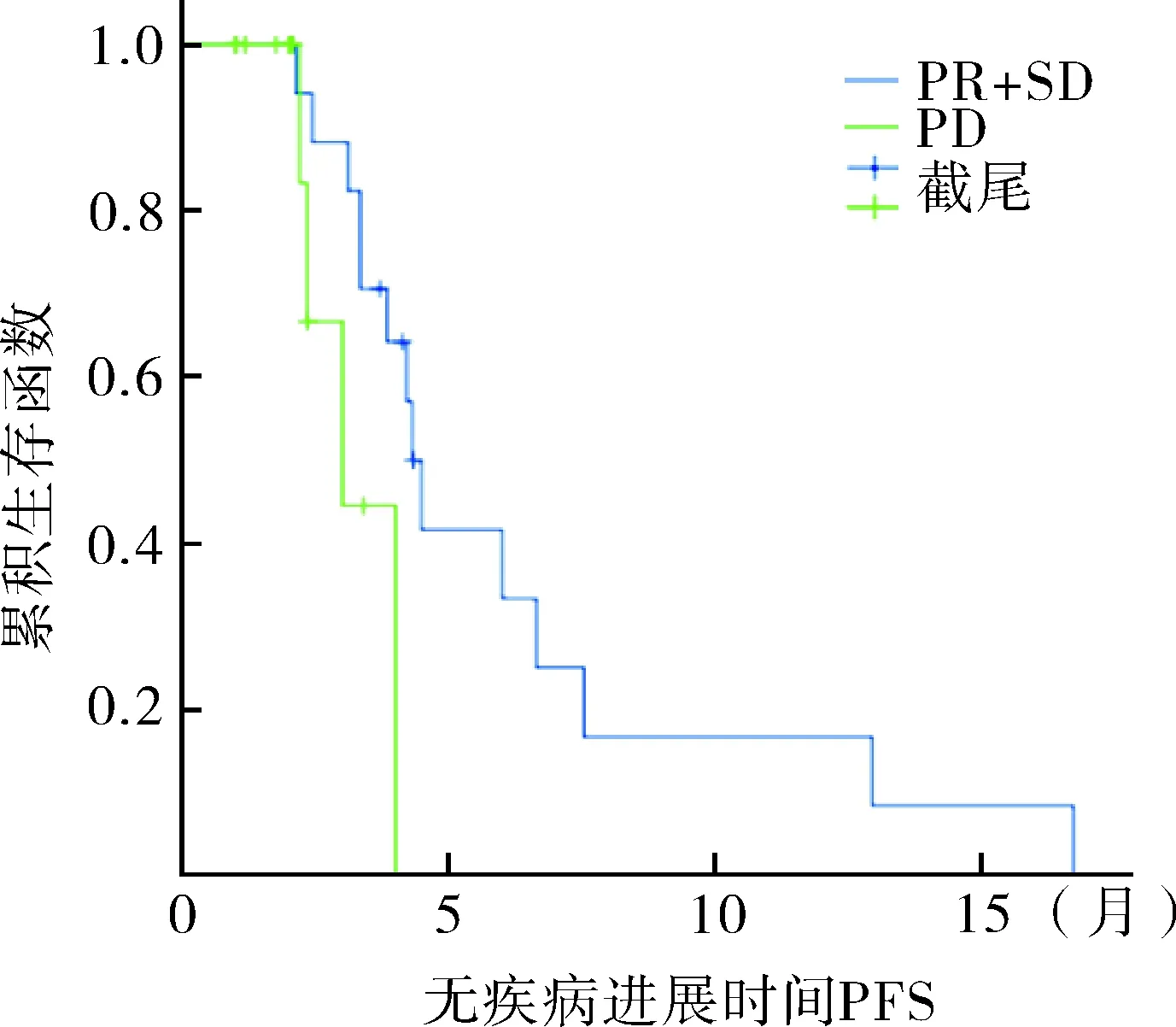
图1 30例晚期肿瘤患者PR+SD组与PD组无进展生存期的比较
2.4 生存影响因素分析 建立COX比例风险回归模型,进行本研究资料的生存影响因素分析,纳入性别等6个自变量。COX回归分析结果:性别、年龄、ECOG评分、高血压、乏力、手足反应均不是影响患者无进展生存期的预后因素(P>0.05)。见表2。
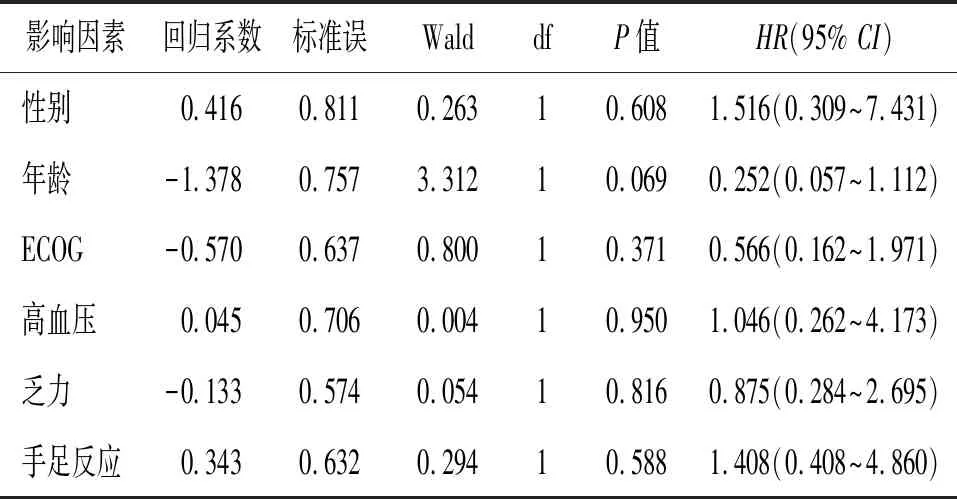
表2 30例晚期肿瘤患者COX模型多因素分析
3 讨论
针对抗VEGFR的药物价值,在目前的临床试验中,已经证明了晚期实体肿瘤中的抗癌活性。
临床前研究证实,肿瘤的生长方式或转移,在没有持续促进新血管形成的情况下受到阻碍[3-4],血管VEGF及其受体已被证明在生理肿瘤血管生成中起重要作用。VEGF家族有活的配体(VEGFα、VEGFβ、VEGFC、VEGFD)和胚胎生长因子和三种酪氨酸激酶(VEGFR-1,2和3)在VEGF受体中,VEGFR-2表达局限于血管系统,并且似乎在血管生成中起关键作用。VEGF和VEGFR-2结合是癌症血管生成的一个关键因素,它诱导VEGFR-2下游分子的激活,并导致对血管内皮的后续影响,包括增加细胞的通透性,增殖和血管生成所必须的迁移,因此对各科恶性肿瘤的治疗可能是一种值得研究的治疗方法。
甲磺酸阿帕替尼,一种针对血管VEGFR-2的小分子酪氨酸激酶抑制剂是中国食品药品监督管理局(CFDA)批准的第一代口服抗血管药物,该药物用于治疗晚期胃癌,在目前的临床试验中,阿帕替尼也证明了在肝细胞癌[5]、肉瘤[6]和乳腺癌[7]方面的抗肿瘤活性,2012年的ASCO会议上,研究发现在高级别非鳞状细胞癌患者中抗血管生成治疗具有潜在的生存优势。此外会议报道了三名具有EGFR野生型的晚期NSCLC患者接受了阿帕替尼的二线治疗,取得了部分效果。
阿帕替尼是一种有效的针对VEGFR-2、PDCFR-β、RET.c-src和C-Rit的酪氨酸激酶抑制剂。它能有效抑制人脐静脉内皮细胞(HVVEC)的增殖、迁移和血管形成,阻止微血管萌发,在各种已建立的肿瘤异种移植体外模型上显示抗肿瘤功效。此外阿帕替尼还可逆转实体肿瘤中AABCB-1和ABCG-2介导的多药耐药性。
本研究显示阿帕替尼在临床应用过程中,出现的不良反应主要为手足反应,高血压,乏力,口腔黏膜损害及皮疹,这与姚艺玮等[8]在晚期胃癌中的观察结果相似。在手足反应中,出现Ⅰ度或Ⅱ度皮损居多,Ⅲ度皮损在药物减量后好转。2例患者出现了重度乏力,经临床检查诊断为亚临床甲减,予以甲状腺素治疗后好转,未影响阿帕替尼药物服用。1例患者出现消化道出血,经临床检查发现凝血功能异常,停用阿帕替尼后好转,而后予以减量服用,未再出现类似症状。然而在国内的文献中未见此种不良反应报道。值得注意的是在本研究中,出现1例Ⅳ度不良反应(高血压),该患者收缩压在200以上,同时伴有声音嘶哑,蛋白尿(3+++),治疗后效果不佳,最终停药。
曹恒等[9]在NSCLC的研究中证实了阿帕替尼在疗效评价为PR的患者中,其PFS显著延长,P<0.05,认为疗效评价PR可以作为其独立预后指标。在本研究中,30例晚期肿瘤患者,失访3例,死亡11例,所有患者均临床资料齐全。随访发现PR+SD组较PD组具有生存优势,两组之间差异有统计学意义(P=0.039)。进一步的COX比例风险模型显示性别、年龄、ECOG、高血压、乏力、手足反应均不是影响生存的独立预后因素。这与姚艺玮、曹恒等的研究结果有差别,可能是所选瘤种、观察生存时间以及所选患者种族不同导致。
综上所述,阿帕替尼在晚期肿瘤患者二线及二线以后治疗中,临床效果及安全性值得肯定。随着对肿瘤领域不断深入的研究,相信在不久的将来,抗肿瘤血管生成药物——甲磺酸阿帕替尼,将会在更多的治疗领域发挥作用,为更多的晚期肿瘤患者提供治疗机会,以及提高生存期。

