miR-34a-5p通过调节Nrf2-Keap1信号通路介导年龄相关性白内障氧化应激的实验研究
唐雷 徐曼华 王妍茜 彭正虹 康刚劲
白内障是一种常见的老年性疾病,随着年龄的增加,其发病率呈上升趋势,然而其发病机制不明已成为其非手术治疗的瓶颈。以往对白内障发病机制的研究表明,白内障的发生与氧化损伤密切相关,白内障患者前房和晶状体内活性氧(reactive oxygen species,ROS)含量明显高于正常人[1-2]。此外,体外研究证实,过氧化氢(H2O2)可诱导白内障患者晶状体上皮细胞凋亡和晶状体混浊,其参与了白内障的发生发展过程[3-4]。microRNA是一类微小的非编码RNA,通过与靶基因的3’-非翻译区(3’-UTR)的互补序列结合,可诱导靶基因降解或翻译抑制[5]。近年来,人们发现许多microRNA在人晶状体上皮细胞的氧化损伤中起调节作用,进而参与白内障的发生发展[6]。此外,有研究报道,miR-34a-5p表达上调与老年性核性白内障的发生发展相关[7],其机制有待进一步功能研究揭示。因此,本研究探讨了miR-34a-5p是否介导年龄相关性白内障的氧化应激以及miR-34a-5p在年龄相关性白内障中潜在的病理机制。
1 材料与方法
1.1 材料收集2017年12月至2018年3月西南医科大学附属医院行白内障超声乳化术的年龄相关性白内障患者45例(45眼)前囊标本,其中男25例、女20例,年龄56~76(64.3±8.5)岁。另收集新鲜正常前囊标本30例(30眼),来自西南医科大学附属医院眼科库及天津瑞吉因科技生物有限公司提供,其中男16例、女14例,年龄55~70(61.1±8.2)岁。本实验经西南医科大学附属医院伦理委员会批准,所有患者均签署知情同意书。
永生型人晶状体上皮细胞系(HLEB-3)购自北卡罗来纳州苏伦生物技术研究所(中国)。用含体积分数10%胎牛血清(Gibco,美国)、100 ×103U·L-1青霉素、100 g·L-1链霉素(Thermo,美国)的DMEM培养基(Invitrogen,美国)培养HLEB-3,然后在 37 ℃、含体积分数5%CO2培养箱中培养。将HLEB-3接种于24孔细胞培养板中培养24 h后,达到80%~85%纯度后用含400 μmol·L-1H2O2的无血清DMEM培养基为实验组,以无血清DMEM培养基为对照组。
1.2 方法
1.2.1 实时定量聚合酶链反应(RT-PCR)根据使用说明书,用Trizol试剂(Invitrogen,美国)提取总RNA,然后使用TaqMan逆转录试剂盒(Applied Bio.,美国)将总RNA逆转录为cDNA。采用TaqMan miRNA(Applied Biosystems,美国)检测miR-34a-5p,U6作为内源性对照。对于靶基因Nrf2的RT-qPCR分析使用引物脚本RT试剂盒(Takara,中国)逆转录总RNA,使用TaqMan通用Master Mix Ⅱ试剂盒(Applied Bio.,美国)检测Nrf2 mRNA表达,β-actin被指定为内源性对照。miR-34a-5p和Nrf2的引物购自Teal Fisher(美国);Nrf2引物序列:上游引物为5’-TCGCAGGGTC-TCTCTCTCTCATCC-3’,下游引物为5’-TGCAGGTCAACTGGTGTCGGT-3’;β-actin引物序列:上游引物为5’-CATCCGTAAAGACCTCTCTCTCT-CTCCCCCCCAAC-3’,下游引物为5’-ATGGAGCCCCACCGATCCACA-3’。PCR在ABI 7500(Applied Bio.,美国)RT-qPCR系统上进行。进行3个独立的实验,并进行2-ΔΔCt定量分析miR-34a-5p和Nrf2相对表达水平。
1.2.2 内源性ROS检测用2’,7’-二氯荧光黄二乙酸酯(DCFH-DA)荧光探针检测内源性ROS。将HLEB-3接种于96孔板,每孔10×103个细胞,培养16 h。贴壁后,将细胞暴露于400 μmol·L-1H2O20 h、1 h、4 h、8 h。将细胞在37 ℃培养箱中孵育20 min后用PBS洗3次。最后用多功能酶标仪测定DCFH-DA的荧光强度。DCFH-DA的平均荧光强度代表HLEB-3中ROS的水平。激发波长为485 nm,发射波长为530 nm。
1.2.3 相关microRNA转染miR-34a-5p模拟物、模拟物对照、miR-34a-5p抑制剂和抑制剂对照均由天津瑞吉因生物有限公司生产和购买。用慢病毒载体感染HELB-3,诱导miR-34a-5p在HLEB-3中过度表达和抑制表达。使用慢病毒载体进行实验,根据相关操作使用说明感染细胞。感染后将细胞孵育8 h,然后在新鲜培养基中进行培养,进行进一步实验。
1.2.4 HLEB-3增殖检测分别用慢病毒载体感染HLEB-3后,诱导miR-34a-5p的过表达和抑制表达,分别于0 h、24 h、72 h向样品中加入Alamar蓝试剂(美国Invitrogen,10%的样品体积)。培养4 h后,用多波长紫外可见分光光度计(TECAN,Mannedorf,瑞士)测定570 nm和590 nm吸光度(A)值。以模拟物对照和抑制剂对照感染的细胞作为对照。
1.2.5 蛋白质印迹实验采用放射免疫沉淀法(RIPA)提取总蛋白,用蛋白酶抑制剂鸡尾酒裂解缓冲液(Pierce,美国)和BCA试剂盒(Thermo,美国)测定蛋白浓度。100 g·L-1NuPAGE Bis-Tris预制凝胶(Invitrogen,美国)中每孔加入40 μg蛋白质样品,用于蛋白质的电泳分离。然后将蛋白质转移到PVDF膜上。用50 g·L-1脱脂奶粉在室温下阻断膜1 h,然后与不同的一级抗体:兔抗Nrf2(11000,Abcam,美国)和兔抗甘油醛-3-磷酸脱氢酶(GAPDH)(12000,Abcam,美国)在4 ℃共孵育一晚。然后加入接合的山羊抗兔IgG(H+L)二级抗体(12500,Promega,美国)并在室温下孵育2 h。使用Image J软件进行分析。
1.2.6 靶基因预测利用miRanda、TargetScan 及PicTar数据库预测了miR-34a-5p的潜在靶基因,其中Nrf2在miR-34a-5p的3’UTR上有结合位点。
1.2.7 双荧光素酶报告基因分析荧光素酶报告载体购自天津瑞吉因生物有限公司,采用QuickChange闪电试剂盒(Stratagene,CA,美国)进行定点诱变。将表达的miR-34a-5p质粒、Nrf2野生型和突变的3’-UTR荧光素酶报告基因共转染到HEK293T细胞中。Renilla luciferase(PRL TK载体,PROMEGA,美国)作为对照。荧光素酶信号用双荧光素酶报告物测定系统进行测量。

2 结果
2.1 年龄相关性白内障晶状体组织中miR-34a-5p和Nrf2的mRNA表达正常晶状体前囊组织中miR-34a-5p的相对表达量为1.03±0.29,Nrf2 mRNA的相对表达量为1.31±0.39;年龄相关性白内障晶状体前囊组织中miR-34a-5p的相对表达量为2.69±0.99,Nrf2 mRNA的相对表达量为0.64±0.25。与正常晶状体前囊组织相比,年龄相关性白内障晶状体前囊组织中miR-34a-5p表达显著升高,Nrf2 mRNA表达显著降低(P<0.001);Nrf2蛋白在年龄相关性白内障晶状体前囊组织中表达也显著降低(Nrf2/β-actin:0.47±0.04、0.30±0.04,P<0.001)。见图1。
2.2 氧化应激模型中miR-34a-5p和Nrf2的表达及内源性ROS的水平和细胞活性与对照组相比,实验组HLEB-3中miR-34a-5p表达显著升高,Nrf2表达显著降低,随着时间的延长,miR-34a-5p和Nrf2的异常表达越明显(P<0.001),Nrf2蛋白在含400 μmol·L-1H2O2的HLEB-3中表达也明显降低(P<0.001)。见图2。
此外,与对照组相比,实验组中内源性ROS的水平显著升高,HLEB-3细胞活性显著降低,随着时间延长,内源性ROS的水平和HLEB-3细胞活性异常越明显。见图3。

图1 正常晶状体前囊和年龄相关性白内障晶状体组织中Nrf2蛋白的表达
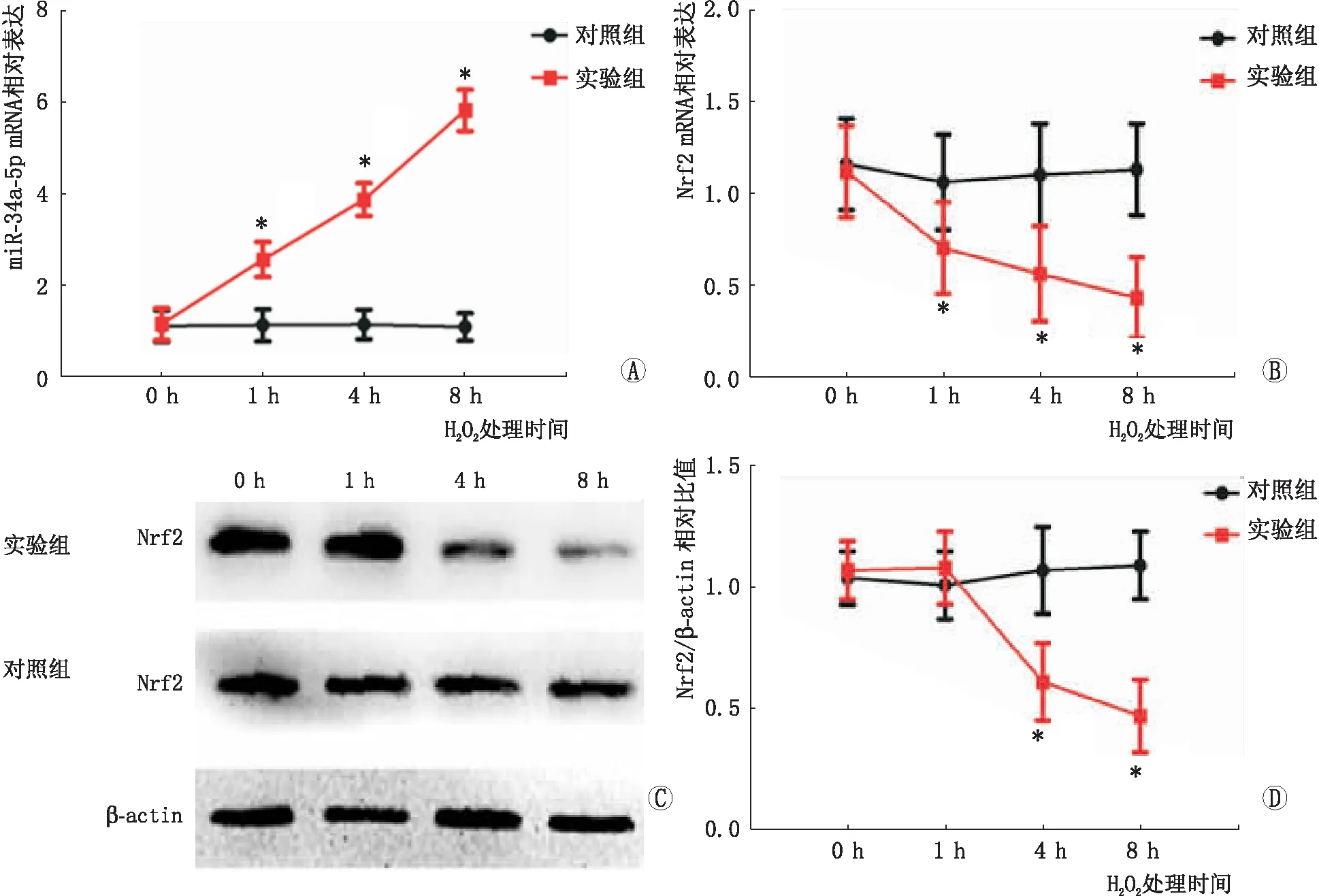
图2 氧化应激模型中miR-34a-5p和Nrf2的表达。A:miR-34a-5p表达;B:Nrf2 mRNA表达;C、D:Nrf2蛋白表达;与对照组比较,*P<0.05
2.3 miR-34a-5p对内源性ROS水平和HLEB-3细胞增殖影响将miR-34a-5p模拟物感染HLEB-3后,miR-34a-5p表达显著升高,Nrf2表达显著降低,内源性ROS水平显著增加,HLEB-3细胞增殖活性显著降低(P<0.001)。然而,在miR-34a-5p抑制剂感染HLEB-3后,miR-34a-5p表达显著降低,Nrf2表达显著升高,内源性ROS水平显著降低,HLEB-3细胞增殖活性显著增强(P<0.001)。见表1和图4。
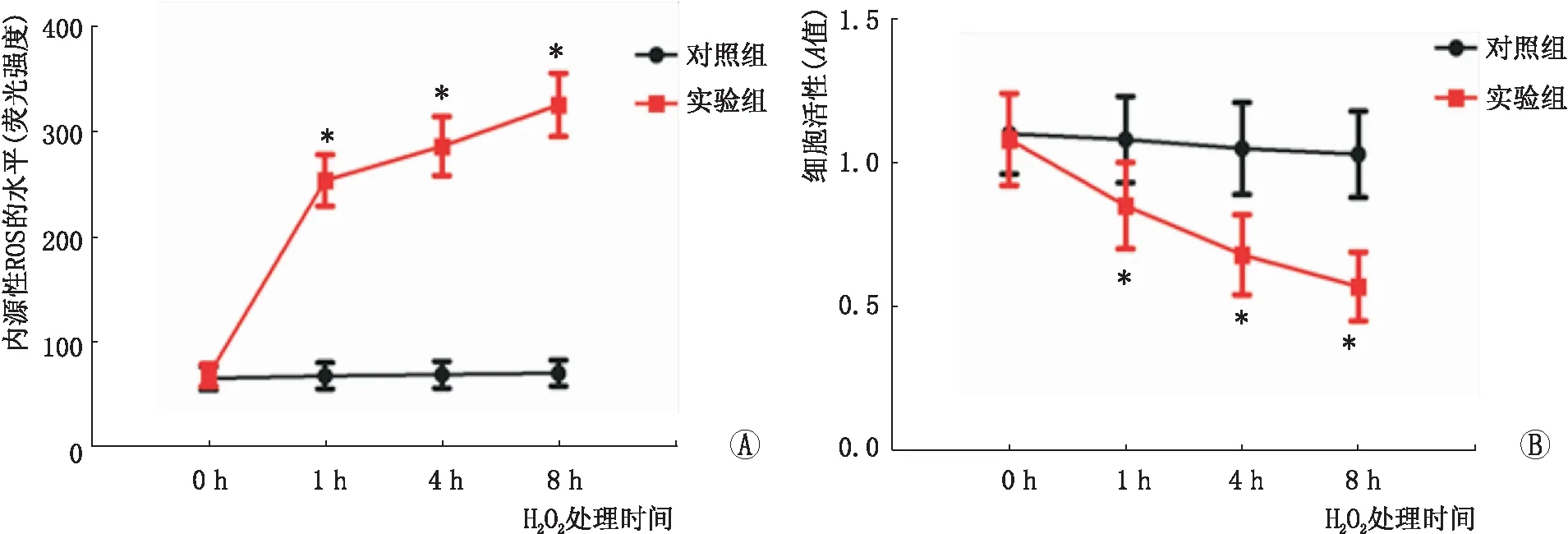
图3 氧化应激模型中内源性ROS的水平和HLEB-3细胞活性。A:内源性ROS的水平;B:HLEB-3细胞活性;与对照组比较,*P<0.05
表1 miR-34a-5p对内源性ROS水平和HLEB-3细胞增殖影响

参数模拟物对照miR-34a-5p模拟物抑制剂对照miR-34a-5p抑制剂miR-34a-5p表达1.05±0.054.83±0.35∗1.11±0.040.58±0.04#Nrf2表达1.04±0.050.59±0.08∗1.15±0.053.96±0.26#ROS水平68.30±3.50318.30±16.10∗70.10±5.1040.20±2.10#HLEB-3细胞活性1.01±0.040.56±0.09∗1.08±0.072.31±0.21#
注:与模拟物对照比较,*P<0.001;与抑制剂对照比较,#P<0.001

图4 各组中Nrf2蛋白表达比较
2.4 Nrf2是否miR-34a-5p的靶基因的检测根据对miRanda、TargetScan 及PicTar的预测分析,Nrf2在miR-34a-5p的3’UTR中具有推测的结合位点,并且推测Nrf2为miR-34a-5p的靶基因(图5A)。miR-34a-5p通过野生型(WT) Nrf2的3’UTR抑制荧光素酶活性,此外,miR-34a-5p不通过突变型(Mut) Nrf2的3’UTR抑制荧光素酶活性(图5B、图5C)。
3 讨论
白内障是一种常见的老年性疾病,仍是世界上第一位致盲性眼病。目前,手术仍是治疗白内障最有效的方法,已成为65岁以上老年人最常见的手术。患者对于手术一般都有一定的恐惧心理,加上手术治疗巨大的经济支出,这已成为白内障患者就诊率低的一个原因。因此,揭示白内障发病机制、探索经济有效的非手术防治新途径不仅具有学术意义,而且具有潜在的应用前景和广泛的社会效益。

图5 Nrf2是否miR-34a-5p的靶基因检测。A:Nrf2在miR-34a-5p的3’UTR中具有结合位点;B:miR-34a-5p通过野生型(WT)Nrf2的3’UTR抑制荧光素酶活性;C:miR-34a-5p不通过突变型(Mut)Nrf2的3’UTR抑制荧光素酶活性
microRNA是近年来发现的一类内源性非编码小RNA分子,通过与靶基因的3’-UTR互补配对、抑制靶基因翻译或介导靶基因降解来调节基因的表达。一种microRNA可以定位在多个mRNA中,参与调节细胞的发育、增殖、衰老和凋亡。microRNA的异常表达与多种疾病密切相关。目前,多种microRNA参与年龄相关性白内障的发生发展,有研究报道,miR-34a-5p的表达上调与年龄相关性核性白内障的发生发展有关[7],而miR-34a-5p与年龄相关性白内障的氧化损伤及其发病机制的关系尚不清楚。本研究结果发现,在年龄相关性白内障晶状体组织中,miR-34a-5p表达显著升高,在含400 μmol·L-1H2O2的HLEB-3中,miR-34a-5p表达显著升高,且作用时间越长,miR-34a-5p的异常表达越明显。此外,与对照组相比,含400 μmol·L-1H2O2HLEB-3中内源性ROS的水平显著升高。因此,本研究结果提示,miR-34a-5p参与了年龄相关性白内障的氧化损伤。
前期相关研究证实,各种刺激因子产生的氧自由基是白内障发生发展的重要因素[8]。氧化应激在白内障发病机制中起着重要作用,氧化应激损伤是指外源性或内源性ROS对细胞信号转导系统的综合作用,或对核酸、蛋白质和脂质分子的损伤[9]。在病理条件下,ROS会过度表达,超过细胞的抗氧化能力,造成细胞的严重氧化应激,进而导致衰老、凋亡或坏死等后果[10]。据报道,白内障患者前房水中H2O2含量显著增高,白内障早期氧化应激被触发,白内障患者房水中H2O2水平显著升高,是正常人的30倍[11]。体外研究也证实,白内障患者晶状体中H2O2可导致晶状体上皮细胞凋亡和晶状体混浊[12],这与白内障患眼病理改变相似。
Nrf2-Keap1信号通路在机体内是普遍存在的,Nrf2及其内源性抑制剂Keap1作为普遍存在的、进化上保守的细胞内防御机制发挥了重要的作用。在氧化应激的情况下,Nrf2被细胞质中Keap1截留,在基础条件下以蛋白酶体降解为目标,从Keap1上分离并转移到细胞核,与一种小的Maf蛋白形成异源二聚体,然后识别抗氧化反应原件,发挥相应的抗氧化应激作用[13-15]。当机体内Nrf2表达减少,Nrf2被细胞质中Keap1截留减少,从Keap1上分离并转移到细胞核并与Maf蛋白形成异源二聚体减少,识别抗氧化反应原件减少,发挥相应的抗氧化应激作用减弱。本研究发现,年龄相关性白内障晶状体组织及含400 μmol·L-1H2O2的HLEB-3中Nrf2表达减少,进一步实验证实,当Nrf2表达减少,其内源性ROS的水平显著升高。因此,Nrf2-Keap1信号通路调控的氧化应激也参与了年龄相关性白内障发生发展过程。最后,我们发现将miR-34a-5p模拟物感染HLEB-3后miR-34a-5p表达显著升高,Nrf2 mRNA和蛋白表达显著降低,内源性ROS水平显著增加,HLEB-3细胞增殖活性显著降低。然而,在miR-34a-5p抑制剂感染HLEB-3后,miR-34a-5p表达显著降低,Nrf2表达显著升高,内源性ROS水平显著降低,HLEB-3细胞增殖活性显著增强。此外,双荧光素酶报告基因分析也证实,Nrf2是miR-34a-5p发挥作用的靶点。
综上所述,miR-34a-5p在年龄相关性白内障的发病过程中表达上调,通过负调控下游靶基因Nrf2,调控Nrf2-Keap1信号通路,下调人晶状体上皮细胞抗氧化应激的能力,抑制人晶状体上皮细胞增殖和修复,从而参与年龄相关性白内障的发生发展过程。

