黑玛丽精子包特性及pH和温度对其精子活力的影响
李纪同,杨磊,王晶,王冰,杨威利,李瑞静,张永忠*
(1. 郑州大学附属儿童医院肾脏风湿科,郑州450018; 2. 河南省儿童遗传代谢性疾病重点实验室,郑州450018;3. 聊城大学生命科学学院,山东聊城252059)
黑玛丽Poecilialatipinna隶属于鳉形目Cyprinodontiformes花鳉科Poeciliidae花鳉属Poecilia,为卵胎生热带鱼类,又名黑摩利,全身漆黑如墨,体型较小。因繁殖周期短、成本低,可作为水族馆及家庭饲养的观赏动物,具有较高的经济价值。但产量低,长期供不应求。因此,研究黑玛丽精子的生物学特性及外界环境因素对其精子运动的影响,可为其人工授精、提高规模化养殖产量提供理论依据。
目前,有关环境中pH、温度、离子成分、渗透压等因素对鱼类精子运动活力的研究,在卵生鱼类中已有较多报道,但在卵胎生鱼类中较少。研究者以剑尾鱼Xiphophorushelleri(Huangetal.,2004;Dongetal.,2006)和孔雀鱼Poeciliareticulata(Tanaka & Oka,2005;郭明申等,2006)为实验材料对其精子的生物学特性进行了初步研究,但尚未有关于黑玛丽精子包特性,以及环境条件对其精子运动活力影响的研究报道。黑玛丽为卵胎生,体内受精,雌鱼受精后40~70 d就可繁殖,每次可产20~60条仔鱼甚至更多,仔鱼出生后生长5~6个月就能进行繁殖。黑玛丽具有精子包结构,精子包在交尾时随精液被输送到雌鱼体内,在特定条件下精子包破裂,释放出游离的精子,精子的激活和运动规律等特性与卵生鱼类显著不同。因此,本文就黑玛丽精子包特性以及pH和温度对其精子运动活力的影响进行了初步研究,旨在为黑玛丽等卵胎生鱼类的人工授精,以及生殖生物学特性等研究提供更丰富的基础资料。
1 材料和方法
1.1 实验用鱼
成年黑玛丽购自山东省聊城市鱼友水族馆,在本实验室饲养2周后用于实验。饲养条件为:鱼缸体积约45 L,缸内水温控制在(26±1) ℃,连续充气,设定光周期为14 h光照∶10 h黑暗,每天更换缸内水的1/5左右,每天喂食3次冷冻赤虫Glyceradibranchiata。雄鱼体质量为1.51 g±0.47 g,体长为4.73 cm±0.49 cm。
1.2 精液的收集和特征
成年黑玛丽于本实验室内进行常年饲养,一年四季均可采集精液。选用性成熟雄鱼,用干净纸巾将鱼体表的水擦净,再用纸巾将鱼泄殖孔和生殖肢周围擦干,轻挤鱼腹部两侧挤出精液,用20 μL毛细玻璃管收集精液,并将其转移到1.5 mL的Eppendorf管内,过程中避免尿液、血液和粪便对精液的污染。每次实验所用精液样本来自3尾及以上鱼精液的混合。精液为乳白色,充满着大量的微小颗粒(即精子包)。
1.3 Hank’s平衡盐溶液及其他溶液的配制
Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)的配制参考Huang等(2004):NaCl 8.0 g、KCl 0.4 g、CaCl2·2H2O 0.16 g、MgSO4·7H2O 0.2 g、Na2HPO40.06 g、KH2PO40.06 g、NaHCO30.35 g、C6H12O61.0 g溶于1 000 mL去离子水(Millipore S.A. 67120,Molshem,France)中,pH=7.5,渗透压为300 mOsm/kg,与精液等渗。不同pH溶液的配制:将配制好的HBSS分成7份,分别用1 mol·L-1HCl或1 mol·L-1NaOH滴定调节到pH分别为5、6、7、8、9和10。所有溶液均用去离子水配制。
1.4 精子包形态结构和荧光观察
用毛细玻璃管收集约8 μL新鲜精液后,立即将其均匀地涂在载玻片上,不盖盖玻片在荧光显微镜(40×10倍)(BX51,Olympus,日本)下观察精子包的形态结构,同时进行荧光观察并摄影。然后,再用移液器滴加适量的去离子水于载玻片上与精液混合均匀,观察其形态变化。
1.5 精子包破裂和精子运动的观察
用毛细玻璃管收集6~8 μL新鲜精液后立即转移到1.5 mL的Eppendorf管内,以1∶10的比例与HBSS(pH=7.5)混合制成精子悬浮液(Huangetal.,2004)。然后,再用精子悬浮液和HBSS(pH=7.5)以1∶50的比例在1.5 mL的Eppendorf管内混合均匀,后用移液器取出20 μL混合液滴在载玻片上,不盖盖玻片在显微镜下观察精子包破裂过程和精子运动情况,同时采集照片。为避免精液在载玻片上时间过长而影响精子运动,每隔0.5 h再次将混合均匀的精液用移液器取出20 μL滴在载玻片上另一位置,继续观察精子(Levanduski & Cloud,1988)和平均运动速率(Wilson-Leedyetal.,2009)等参数来衡量精子的运动活力。(1)精子运动(向前运动或曲线运动)百分数:在同一视野中,运动精子数占精子总数的百分比。记录向前运动或曲线运动精子的百分数,原位振动的精子不计(Paniagua-Chavez & Tiersch,2001);(2)精子运动时间:从精子包完全破裂、精子全部释放后开始到最终停止运动(运动精子<5%时)的时间(Leach & Montgomerie,2000;Dietrichetal.,2005);(3)精子运动速率:精子位移与时间之比。
1.6 pH对精子包及精子运动活力的影响
在室温(20 ℃)条件下,用pH为5、6、7、8、9和10的HBSS分别与精子悬浮液以1∶50的比例在1.5 mL的Eppendorf管内混合均匀,然后立即用移液器取出20 μL混合液滴在载玻片上,不盖盖玻片在显微镜下观察在不同pH条件下的精子包破裂过程以及精子运动情况,同时采集照片。为避免精液在载玻片上时间过长而影响精子运动,每隔0.5 h再次将混合均匀的精液用移液器取出20 μL滴在载玻片上另一位置,继续观察精子运动情况。通过计算机辅助精子分析(CASA)获得精子的运动时间、运动百分数和平均运动速率等参数来衡量不同pH对精子运动活力的影响。
1.7 低温及常温保存后精子运动情况的观察
将20 μL精子悬浮液用4 ℃条件下的HBSS(pH=7.5)以1∶50的比例稀释混匀后,立即用移液器取出20 μL置于载玻片上进行观察(同时将剩余精子混合液置于4 ℃冰箱),约5 min精子包开始破裂,约12 min全部破裂。之后每隔0.5 h用移液器再次混匀并快速取出20 μL置于载玻片上持续观察精子运动情况。其余实验均在室温(20 ℃)条件下操作完成,并进行与低温条件下保存相同时间的观察和记录。所有实验均由相同操作者完成,每项实验重复3次或以上。
1.8 统计学分析
数据以平均数±标准差表示,以GraphPad Prism 5进行统计学分析,采用t检验或方差分析(ANOVA),P<0.05为差异有统计学意义,P<0.01为差异有高度统计学意义。
2 结果
2.1 黑玛丽精子包和精子运动的特征
通过挤压腹部,每次从每尾鱼可收集6~8 μL精液,精液呈乳白色,充满精子包,易沉淀,可能由精子包所致。显微镜下可看到精液中含有大量圆形或椭圆形精子包(图1:A)。用荧光显微镜观察,发现精子包具有自发荧光现象,荧光强度随观察时间逐渐减弱直到消失(约持续20 s),精子包经蓝色光激发后绿色荧光减弱,而经绿色光激发后没有观察到精子包的红色荧光现象,经紫外光激发后精子包呈较暗的蓝灰色(图2:A~D)。将新鲜精液与去离子水混合,立即在显微镜下观察,发现精子包形状有所改变(图1:B),有的呈哑铃形,有的呈长方形,也有的呈不规则形,这可能是由于精子包内外的渗透压差造成的,但精子包仍完整,未观察到精子释放。
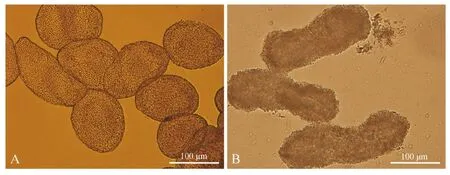
图1 新鲜精液(A)和与去离子水混合后(B)的精子包外部形态Fig. 1 The morphology of Poecilia latipinna spermatophore in fresh semen (A) and mixation with deionized water (B)

图2 黑玛丽精子包的荧光特性Fig. 2 Fluorescent characters of Poecilia latipinna spermatophore
A. 明场下的精子包,B. 精子包在蓝色激发光下呈现较弱的绿色荧光,C. 精子包在绿色激发光下无红色荧光现象,D. 精子包在紫外光下呈现较暗的蓝灰色
A. spermatophore under bright field,B. spermatophore showed weak green fluorescence under blue exciting light,C. spermatophore displayed no red fluorescence under green exciting light,D. spermatophore appeared dark steel gray fluorescence under ultraviolet light
黑玛丽具有精子包结构,其精子运动与卵生鱼类不同。Tanaka和Oka(2005)将孔雀鱼精子包破裂及精子由精子包释放出的过程分为3个阶段。但观察发现,黑玛丽精子由精子包释放出的过程分为4个阶段:第一阶段,精子包完整,精子未被激活;第二阶段,精子包未破裂,精子被激活(此时可观察到在精子包外周表面有精子头部在晃动);第三阶段,精子包开始破裂,开始有精子释放;第四阶段,精子包完全破裂,精子全部释放(图3:A~D)。
精液用HBSS(pH=7.5)稀释,孵育约5 min后精子包开始破裂(即第三阶段),这时可观察到精子陆续从精子包游离出来,且运动速度较快。约12 min后,多数精子包完全破裂,精子全部释放(即第四阶段结束)。脱离精子包的精子很快便停止了运动,但多数精子尾部仍以较快的速度在原位摆动。约经过50 min后,处于HBSS稀释液中的精子被激活而重新开始运动,并且精子运动的方式和刚从精子包释放时一样,在运动过程中都伴随鞭毛的摆动。
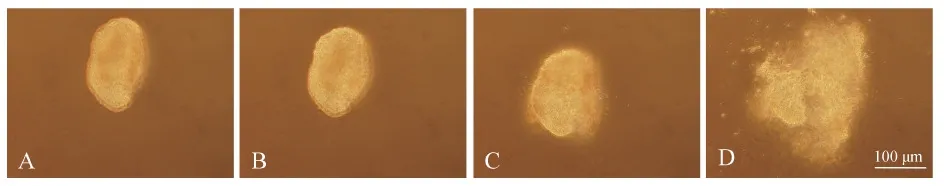
图3 黑玛丽精子包的破裂过程Fig. 3 The breakdown process of Poecilia latipinna spermatophore
A. 第一阶段,B. 第二阶段,C. 第三阶段,D. 第四阶段
A. the first stage,B. the second stage,C. the third stage,D. the fourth stage
2.2 pH对黑玛丽精子包及精子运动活力的影响
在室温(20 ℃)条件下,用不同pH的HBSS分别与精子悬浮液混合,精子包破裂情况不同,精子运动活力也不一样。在pH为10的HBSS中没有观察到精子包破裂和精子释放,将其精子运动百分数记为0。当精子悬浮液分别用pH为5~9的HBSS稀释后,均可观察到精子包破裂和精子运动。在0~0.2 h内为精子包破裂阶段,并且在0.2~1 h内精子运动百分数较小,几乎为0(图4)。随时间延长,在pH为6~9的HBSS中,精子运动百分数都有先增加后降低的趋势(图4)。但在pH为5的HBSS中,精子运动百分数一直较低,几乎为0。当pH为7和8时,HBSS中精子运动百分数在各时间段(点)都是最高的(图4),并且两者的运动百分数均值之间的差异无统计学意义(P>0.05)。当pH为7时,精子运动时间要略长于pH为8时,但两者之间的差异无统计学意义(P>0.05)。并且pH为7和8时的精子运动时间都显著长于pH为9时(P<0.05),而与pH为5、6和10时的精子运动时间相比,差异有高度统计学意义(P<0.01)(图5)。

图4 pH对黑玛丽精子运动百分数的影响
Fig.4 The effect of pH on the percentage of motile sperms ofPoecilialatipinna

图5 pH对黑玛丽精子运动时间的影响Fig.5 The effect of pH on the motility span ofPoecilia latipinna sperms
a与b、b与c之间的差异有统计学意义(P<0.05),a与c,以及a、b、c与d之间的差异有高度统计学意义(P<0.01)
There is a significant difference between a and b,b and c (P<0.05); there is an extreme significant difference between a and c,as well as between a and d,b and d,c and d (P<0.01)
在pH为10的HBSS中,精子包未破裂,精子不运动,运动速率记为0。在pH为5~9的HBSS中,精子平均运动速率最大值都位于时间段5~12 h内(图6)。在pH为7的HBSS中,精子平均运动速率在大部分时间段内显著高于在pH为5、6、9和10中的(P<0.05),而与pH为8中的相比,数值略高,但差异无统计学意义(P>0.05)(图6)。在不同pH的HBSS中精子平均运动速率都有先增加后降低的趋势(图6)。
2.3 温度对黑玛丽精子运动活力的影响
用HBSS(pH=7.5)稀释精液约12 min后,精子包完全破裂,释放出的精子暂时处于休眠状态,约经过50 min后,处于HBSS稀释液中的精子会被激活。因此,在精子由精子包释放停止运动到精子被激活的期间,精子运动百分数几乎为0,随时间延长,精子运动百分数逐渐增大。但约12 h后,精子运动百分数又开始逐渐减小(图7)。在1~30 h内,室温(20 ℃)条件下的精子运动百分数大于在低温(4 ℃)条件下的,而在30 h后,低温条件下的则又大于高温条件下的(图7)。在不同温度条件下,精子运动时间不同,处于20 ℃和4 ℃条件下HBSS(pH=7.5)中精子的平均运动时间分别约为39 h和58 h,两者之间的差异有高度统计学意义(P<0.01)。

图6 pH对黑玛丽精子平均运动速率的影响Fig.6 The effect of pH on the mean velocity of Poecilia latipinna sperms
精子平均运动速率(在20 ℃或4 ℃下)都有先加快而后减慢的趋势。在1~18 h内,保存在 20 ℃ HBSS中的精子平均运动速率略高于4 ℃条件下的,而在18 h后,情况则正好相反。在20 ℃的最大平均运动速率为12 μm·s-1(图8)。

图7 温度对黑玛丽精子运动百分数的影响Fig.7 The effect of temperature on the percentage of motile sperms of Poecilia latipinna
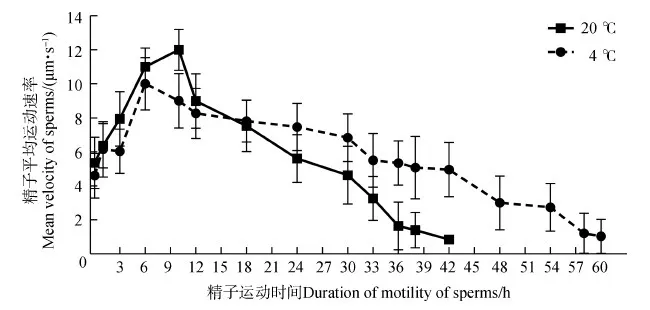
图8 温度对黑玛丽精子平均运动速率的影响Fig.8 The effect of temperature on the mean velocity of Poecilia latipinna sperms
3 讨论
与体外受精的硬骨鱼类相比,体内受精的黑玛丽精子在形态结构、生理特性,及运动规律等都有显著差异。在形态结构方面,体外受精的鱼类精子头部近似于球形,线粒体集中分布在头后部。而体内受精的鱼类精子头部为细长形,线粒体围绕尾最前段分布,这与哺乳动物有些类似(Stoss,1983)。在糖代谢活性等方面,体内受精的鱼类精子也与哺乳动物更为类似(Kallman,1975),这可能与精子持久运动和能量代谢的特殊需求有关。体内受精的鱼类,如剑尾鱼在精子发生过程中形成了精子包结构,交配时雄鱼将精子包传输到雌鱼体内,并可在雌鱼体内储存长达几个月,其中的精子一直保持授精能力(Yangetal.,2006)。这可能与精子包特性和精子所处环境的pH和温度等因素有重要关系。
3.1 黑玛丽的精子包和精子运动特征
体内受精的鱼类精子包与节肢动物、有尾两栖类及软体动物等的精荚或精包有所不同。部分体内受精鱼类,如孔雀鱼精子包是在精子发生过程中逐渐形成的,而不是像其他动物的精荚或精包那样在精子发育(基本)完成后再由其他腺体来源的物质粘接或包裹形成。另外一个特点是部分体内受精鱼类精液中的精子包在交配过程中随精液一起被输送到雌性体内,而不是像其他动物的精荚或精包那样以固形物的形式靠非液体的机械作用送到雌性体内。在中文文献中尚未见到对体内受精鱼类精子包的具体阐述,也未见对其专门命名。这里对这一特殊结构及其在适当溶液中的破裂过程作了初步研究,并把其名称初步定为“精子包”,以与其他动物的精荚、精包等区别。
观察发现,黑玛丽的精子包破裂和精子运动都需要在适当稀释液(或雌性体液)中实现,用HBSS(pH=7.5)对黑玛丽精液进行稀释,约5 min后,精子包开始破裂,精子从精子包外周各个方向游离出来,有的精子头部还披有精子包膜。精子包中不同部位的精子从精子包释放的位置和时间是不同的,可能与精子在精子包内的分布有关,排列在精子包内表面的精子先释放出来;也可能与精子的质量有关,质量较高的精子被激活后运动活力较强,能够先于质量较低的精子以较快的速度游离出来。将黑玛丽精子从精子包中释放出来的过程分为4个阶段,这样就可以对精子包从开始进入稀释液到精子完全释放的整个过程更好地了解和描述。另外,黑玛丽精子包的自发荧光现象和其形态特征很可能有利于进一步对其性腺的发育和精子的发生过程进行组织学方面的研究。
在黑玛丽精子包破裂和精子释放过程中发现一种特殊现象,大多数精子由精子包释放后就停止了运动,只有一些精子的尾部仍在摆动,约经过50 min后精子会再次运动起来,几十小时后最终又停止了运动,这种现象尚未见到有关报道。一般说来,体外受精的鱼类精子一旦被激活运动后,精子的运动时间很短暂,通常只有几秒到几分钟。但是体内受精的鱼类精子在HBSS中的运动时间在室温下可维持1 d,4 ℃下可持续几天(Huangetal.,2004;Yang & Tiersch,2009)。不同物种的精子在结构和生理上的差异可能是造成精子运动时间不同的主要原因。体内受精的鱼类精子在形态上与哺乳动物的精子形态更加相似,且可以在雌性生殖道的液体中运动几十小时(Yang & Tiersch,2009)。尖嘴鱼Syngnathusabaster精子在水中可以运动5 min,而在卵巢液中的运动时间可超过25 min(Dzyubaetal.,2008)。体外受精鱼类的精子在水中运动,而体内受精鱼类或哺乳动物的精子是在生殖道液体内运动,2种鱼类精子运动环境明显不同,这可能是导致 2种鱼类精子运动时间明显不同的重要原因。本实验中黑玛丽精子从精子包释放后,由于精子包内外的渗透压、pH、离子成分、营养成分等发生了变化,精子需要在新环境条件下适应后才能被再次激活。或者像哺乳动物的精子获能过程那样,由于在冲破精子包游离出的过程中精子表面粘上了某种(些)物质需要一定时间去除。也许是精子到达外界环境时需要吸收利用HBSS(pH=7.5)(或雌性体液)中的葡萄糖分解产生ATP,而后才能开始真正的前进式运动。精子静止一段时间后再次运动可能对保证其正常的运动活力和受精能力具有重要意义。但是,目前尚不清楚在雌鱼体内精子是否也静止一段时间之后再开始运动。另外,再次运动的精子和刚从精子包中游离出的精子相比,哪类精子更容易让卵子受精,以及其受精能力有何不同等问题也有待进一步研究。
3.2 pH对黑玛丽精子包和精子运动活力的影响
当pH为5时,尽管精子包可以破裂,但精子运动百分数一直都很低。而pH为10时,精子包不能破裂。这可能是由于强酸强碱不利于精子包破裂,精子不能被正常释放出来。即使能够被释放出来,在强酸强碱溶液中精子的正常生理过程也无法实现。当pH为7~8时,黑玛丽精子的运动百分数、平均运动速率和运动时间都较高(长),而且在pH为7或8下精子的运动百分数、平均运动速率和运动时间的差异均无统计学意义,这表明中性至弱碱性环境最适于黑玛丽精子运动。适宜的pH可以增加精子运动百分数、提高精子平均运动速率、延长精子运动时间。这与对体外受精的玫瑰无须鲃Puntiusconchonius精子研究结果(李纪同等,2012)相似。另外,虹鳟Oncorhynchusmykiss(Wojtczaketal.,2007)和波斯鲟Persiansturgeon(Alavietal.,2004)等体外受精的鱼类精子也是在弱碱性溶液中各项运动参数值最大。
3.3 温度对黑玛丽精子运动活力的影响
Huang等(2004)报道了绿剑尾Xiphophorushelleri精子在室温下的HBSS中能维持运动24 h,而在4 ℃条件下却能运动10 d。本实验中黑玛丽精子在低温(4 ℃)条件下约为58 h,而在室温(20 ℃)条件下运动时间约为39 h。在同一温度条件下,黑玛丽和绿剑尾的精子运动时间存在较大差别,可能是由于不同物种的精子运动特性所致。但本实验也足以说明低温条件可以显著延长黑玛丽精子的运动时间,这与前述报道是一致的。在20 ℃下精子的运动百分数和平均运动速率在开始一段时间内要显著高于4 ℃,而后来又低于4 ℃。这可能是由于在高温条件下精子的新陈代谢旺盛,线粒体产能较快较多,能量消耗也更快,对精子的细微结构及大分子等的损伤也快,因此精子的运动百分数和平均运动速率在一段时间后变得低于低温环境条件。Gardiner(1978)报道了孔雀鱼和海鲫鱼Cymatogasteraggregata的精子能够代谢细胞外的葡萄糖,Dong等(2006)报道在HBSS中加有适量的葡萄糖对剑尾鱼精子保持较高的运动活力是必不可少的。本实验中所用的HBSS稀释液中也加了葡萄糖,但是黑玛丽精子在运动过程中对葡萄糖的利用情况还有待进一步的研究。

