实时荧光定量PCR构建牛源粪肠球菌esp标准曲线
樊 杰,孙康永杰,魏亚琴,杨宇泽,万学瑞,丁巨财,王 川*
(1.甘肃农业大学动物医学院,甘肃 兰州730070;2.甘肃省科学院生物研究所厌氧微生物中心,甘肃 兰州730000;3.北京市畜牧总站,北京100101)
肠球菌是一种革兰阳性球菌, 在自然环境以及人和动物消化道内广泛分布,是人和动物肠道正常菌群的一部分, 粪肠球菌(Enterococcus faecalis)属于肠球菌的一种,是人和动物肠道内主要菌群之一, 能产生细菌素等抑菌物质,抑制大肠杆菌和沙门氏菌等病原菌的生长,改善肠道微环境;同时其还能抑制肠道内产尿素酶细菌和腐败菌的繁殖,减少肠道尿素酶和内毒素的含量,使血液中氨和内毒素的含量下降[1];另一方面当其侵入其他部位(如口腔、尿道、乳房等)会造成牙髓根尖周病、尿路感染、乳房炎等多种疾病。临床实验研究已发现,在乳房炎患牛乳房组织及分泌乳汁中能够分离得到粪肠球菌[2]。TODHUNTE 等发现在干乳期奶牛乳房疾病的病原微生物中粪肠球菌的比例达22.5%-70.4%[3]。esp(Enterococcus surface protein)基因的全长5791 bp,结构独特,核心区域由多个碱基序列重复组合而成,由其编码表达的粪肠球菌表面蛋白是一种黏附素,这是肠球菌众多致病因素之一,其在肠球菌对宿主细胞的黏附定植和逃避宿主免疫清除方面起到一定作用[4]。本实验室前期在大肠埃希氏菌BL21 中表达了部分牛源粪肠球菌表面蛋白ESP,利用生物信息学软件分析其编码氨基酸的基本理化性质[5]。目前检测粪肠球菌的方法有比较传统的革兰氏染色法、细菌分离培养、生化试验检等;也可通过间接ELISA 方法对猪源粪肠球菌Ace 蛋白进行检测[6];PCR 方法检测猪源粪肠球菌的16S rDNA[7];用基于TaqMan 探针的荧光定量PCR 方法检测粪肠球菌的d- 丙氨酸聚连接酶(ddl)基因[8];基于荧光定量PCR 方法检测水中活性粪肠球菌23S rRNA 拷贝数而确定粪肠球菌含量[9]。还可采用MALDI-TOF MS (Matrix-assisted laser desorption ionization-time-of-flight mass spectrometry, 基 质辅助激光解吸电离- 飞行时间质谱)方法对猪源粪肠球菌进行快速鉴定及同源性分析[10]; 以及建立针对16SrRNA序列的基因芯片检测系统, 鉴定人体肠道致病粪肠球菌[11]。其中传统的检测方法特异性差,且耗时较长,不符合快速检测的要求;MALDI-TOF MS 鉴定法和基因芯片技术对实验仪器要求较高。而实时荧光定量PCR 方法具有灵敏度高,特异性强,操作简单的优点,是快速检测病原微生物的首选方法。目前实时荧光定量PCR 方法检测牛源粪肠球菌处于空白状态。因此本项目建立了牛源粪肠球菌esp基因荧光定量PCR 标准曲线, 用于SYBR Green Ⅰ实时荧光定量PCR 方法快速检测牛源粪肠球菌。
1 材料和方法
1.1 材料
1.1.1 菌株
牛源粪肠球菌为本实验室保存。
1.1.2 培养基
用LB 培养基培养牛源粪肠球菌。
1.1.3 主要试剂和仪器
质粒 DNA 提取试剂盒、ChamqTM Universal SYBRQpcr Master Mix、DL2000 Plus DNA Maker(Vazyme)、胶回收试剂盒(ABigen)、IPTG、Amp、X-Gal(北京全式金生物技术有限公司)、其他试剂(国产分析纯)。电热恒温培养箱(南京电器三厂)、恒温震荡器(上海智诚分析仪器制造有限公司,ZHWY-200D)、离心机(eppendorf)、PCR 仪(Eppendorf,Mastercycler nexus GSX1)、凝胶成像系统(BIO-RAD)、金属浴(杭州奥盛仪器有限公司,MK-20)、核酸蛋白检测仪(GeneQuant 1300)、 荧光定量 PCR仪(Roche,LightCyclerR96)。
1.2 方法
1.2.1 引物设计
参照粪肠球菌esp 基因在Genbank 中的序列 (序列号为AF034779)进行引物设计,并送到金唯智生物科技有限公司合成。引物序列如下表:

表1 引物设计
1.2.2 法提取粪肠球菌基因组
采用CATB 法对粪肠球菌基因组DNA 提取,电泳检测合格后所得基因组于-18℃保存。
1.2.3 梯度PCR 确定引物退火温度
总反应体积为15 μL,上下游引物各0.6 μL,Taq 酶7.5 μL,dd 水,基因组模板1.8μL,进行梯度PCR︰94 ℃预变性5 min;94 ℃30 s;50~60 ℃30 s;72 ℃30 s;共35个循环,采用1.0%的琼脂糖凝胶电泳检测扩增结果。
1.2.4 esp 基因50μL 反应体系PCR
引物退火温度确定后采用50 μL 反应体系进行PCR, 上下游引物各2 μL,Taq 酶25 μL,ddH2O 18 μL,基因组模板3 μL, 反应程序︰94℃预变性5 min;94 ℃30s;58 ℃30 s;72 ℃30 s;共35 个循环。采用1.0%的琼脂糖凝胶电泳检测扩增结果。
1.2.5 重组标准品质粒的制备及鉴定
依照胶回收试剂盒说明进行esp 回收, 并于-20 ℃保存,采用1.0%的琼脂糖凝胶电泳检测回收结果。将esp基因连接到对电泳得到的目的条带进行胶回收,将回收产物与pMD18-T 载体于16 ℃恒温金属浴连接过夜; 将得到的连接产物转化至大肠埃希菌TOP10 感受态细胞中加入LB 液体培养基活化1 h,低速离心后涂于Amp+、XGal和IPTG 处理的LB 琼脂平板上,37 ℃过夜培养后挑取单菌落白斑, 在含有Amp 的LB 液体培养基37 ℃、200 r/min 振荡过夜培养。采用菌液PCR 检测esp 基因是否连接到载体质粒上。依照质粒提取试剂盒说明提取质粒,并于-20 ℃保存。采用1.0%的琼脂糖凝胶电泳检测质粒提取结果。取15 μL 提取的质粒送到擎科生物科技有限公司进行测序。结果用Megalign 软件分析。用紫外分光光度计测定阳性重组质粒的OD 值, 计算出拷贝数, 将重组质粒进行10 倍系列稀释[12]。
1.2.6 荧光定量PCR
反应总体积为25 μL, 其中上下游引物各0.8 μL,2×SuperReal PreMix12.5 μL,ddH2O 9.9 μL, 质粒模板1 μL。反应条件︰95℃预变性1 min;95 ℃5 s;58 ℃10 s;72 ℃20 s;共35 个循环。在延伸阶段进行荧光信号收集,反应结束后,使用软件Qrigin 2018 绘制标准曲线。
2 结果
2.1 菌液PCR 及阳性质粒验证
菌液PCR 扩增产物大小为120bp,与预期结果相符。(见图1)。阳性质粒验证结果也符合要求。测序结果表明重组质粒中含有esp 基因的核苷酸序列。
2.2 实时荧光定量PCResp 重组质粒标准曲线
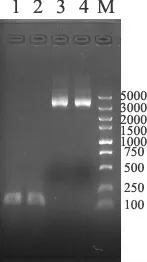
图1 菌液PCR 扩增产物及阳性质粒验证
2.2.1 动力学曲线与熔解曲线
经Lightcycler 96 分析后发现, 熔解曲线峰值单一,扩增产物的解链温度值非常均一,为81.9 ℃,说明产物扩增具有特异性。
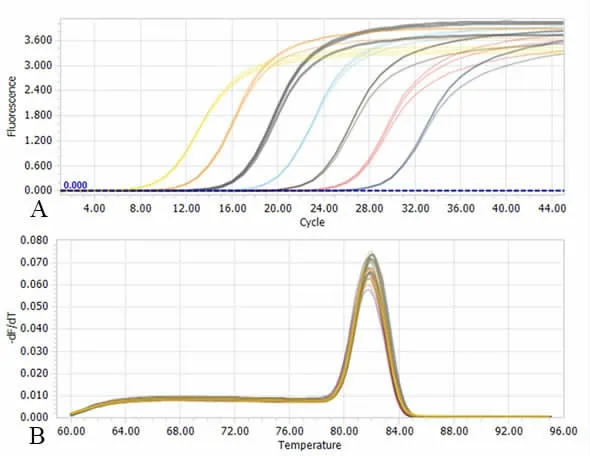
图2 实时荧光定量PCR esp 重组质粒DNA 动力学曲线与熔解曲线
2.2.2 标准曲线的建立
按上述的优化条件, 取109、108、107、106、105、104、103拷贝/μL 的重组质粒作为标准阳性模板,分别进行扩增,结果显示该标准曲线检测的灵敏度为109-103个模板;通过对其回归曲线进行分析, 发现其相关性良好, 相关系数r2=0.9998。系统生成的回归方程为:y=-0.29981x+11.742(见图3)。

图3 实时荧光定量PCR esp 重组质粒标准曲线
3 讨论
实时荧光定量PCR 可以通过标准曲线对未知模板进行定量分析,实现了PCR 技术从定性到定量的飞跃。该技术具有敏感性高、重复性好、快速、操作简便、可实时监测和无污染等优点[13]。本研究首次采用SYBR Green Ⅰ法检测牛源粪肠球菌esp 基因。对于导致粪肠球菌毒力因子esp 的检测,实时荧光定量PCR 法的灵敏度比普通的两步法RT- PCR 高100 倍[14];比普通的检测方法如生化实验、革兰氏染色鉴定特异性更强;而猪源粪肠球菌Ace 蛋白间接ELISA 实验是对Ace 蛋白基因构建原核表达载体,成功表达并纯化重组蛋白,以重组蛋白为抗原建立检测粪肠球菌特定基因的方法,由此可见,此方法比实时荧光定量PCR 法复杂得多, 后者不需要进行蛋白的表达[6]; 基于TaqMan 探针的荧光定量PCR 方法则需要设计特异性的基因探针;RT-qPCR 方法需要进行反转录, 操作难度大。MALDI-TOF MS 鉴定法、基因芯片技术所需实验仪器比较昂贵,且操作难度大。本实验通过设计esp 基因的特异性引物,并且调节引物与模板浓度、退火温度来优化两基因同时扩增的反应条件,减少假阳性的存在,并以不同浓度重组质粒DNA 分别进行荧光定量PCR 扩增,发现起始浓度越高,Ct 值越小,即起始模板浓度与Ct 值之间呈良好的线性关系。利用已知起始拷贝数的标准品质粒可做出标准曲线,因此只要获得未知样品的Ct 值, 即可从标准曲线上计算出该样品的起始拷贝数。本研究中,通过10 倍系列稀释标准品质粒浓度所得到的Ct 值绘制的标准曲线的相关系数高达0.9998,能够保证数据的精确性。根据回归方程,可直接计算出各样品模板的初始含量。本实验成功构建了esp 标准曲线,为牛源粪肠球菌快速检测和进一步测定esp基因的表达量奠定了基础。
——一道江苏高考题的奥秘解读和拓展

