单纯性肥胖儿童体循环miRNA表达变化及相关性分析
刘祖霖?侯乐乐?孟哲?张丽娜? 江转南?梁立阳

【摘要】目的 了解單纯性肥胖儿童体循环微小RNA(miRNA)表达变化的特点,分析其与肥胖相关指标的关系。方法 选取8 ~ 10岁单纯性肥胖儿童18例设为肥胖组,年龄分布、性别组成比例一致的正常体质量儿童18名设为正常对照组,测量体格数据及生化指标。2组均随机选取3例个体行miRNA基因芯片检测,筛选差异性miRNA,剩余15例行miRNA验证,并分析差异性miRNA表达量与体格数据、生化指标的相关性。结果 基因芯片筛选出表达差异的miRNA 67个,通过靶基因预测挑选miRNA-142-3p、miRNA-142-5p、miRNA-133b、miRNA-486-3p进行验证。肥胖儿童体循环中miRNA-142-5p表达上调,且表达量与体质量、腰围、腰围/身高、BMI、血压、甘油三酯、总胆固醇、非HDL呈正相关,与胰岛素敏感指数(ISI)呈负相关(P均 < 0.05)。miR-133b表达下调,且表达量与体质量、腰围、腰围/身高、BMI等指标呈负相关,与ISI呈正相关(P均 < 0.05)。结论 单纯性肥胖儿童体循环中miRNA的表达谱与正常儿童存在差异,且与代谢异常相关;miRNA有望成为筛查肥胖儿童、代谢综合征易患人群的分子标志物。
【关键词】儿童;单纯性肥胖; 微小核糖核酸
Changes in expression of circulating miRNAs and correlation with obesity-related parameters in children with simple obesity Liu Zulin, Hou Lele, Meng Zhe, Zhang Lina, Jiang Zhuannan, Liang Liyang. Department of Pediatrics, Sun Yat-sen Memorial Hospital of Sun Yat-sen University, Guangzhou 510120, China
Corresponding author, Liang Liyang, E-mail: doctorlly@ 126. com
【Abstract】Objective To investigate the changes of the expression of circulating microRNAs (miRNA) in children with simple obesity, and explore the correlation with obesity-related parameters. Methods Eighteen children with simple obesity, aged 8-10 years old, were assigned into the obesity group and 18 age-and gender-matched healthy children were enrolled in the control group. Morphometric data and biochemical parameters were quantitatively measured. In both groups, 3 chidlren were randomly selected for miRNA array to screen differential miRNA. The remaining 15 cases were subject to miRNA verification. The correlation between the expression levels of differential miRNA, and morphometric data and biochemical parameters was analyzed. Results A total of 67 differential miRNAs were screened. Through prediction of target genes, miRNA-142-3p, miRNA-142-5p, miRNA-133b and miRNA-486-3p were selected for miRNA verification. The expression of miRNA-142-5p was up-regulated in children with simple obesity, which was positively correlated with body weight, waist circumference, waist-to-height ratio, body mass index (BMI), blood pressure, triglyceride, total cholesterol, non-high density lipoprotein, whereas negatively correlated with insulin sensitivity index (ISI) (all P < 0.05). The expression level of miRNA-133b was down-regulated, which was negatively correlated with body weight, waist circumference, waist-to-height ratio and BMI, whereas positively correlated with ISI (all P < 0.05). Conclusions The expression profile of circulating miRNA differs between children with simple obesity and healthy counterparts, which is associated with metabolic disorders. Hence, miRNA might serve as a molecular marker for screening of children with obesity and high-risk metabolic disorders.
【Key words】Child;Simple obesity;microRNAs
微小RNA(miRNA)是指广泛存在于真核生物体内的一组具有调控mRNA表达功能、长约19 ~ 25核苷酸(nt)的小分子非编码RNA,其与靶基因以碱基互补配对方式形成沉默复合体,发挥影响mRNA稳定性、抑制mRNA翻译并促进其降解的作用,具有时序性、组织特异性等生物学特性[1]。近年有研究显示miRNA在脂肪细胞分化、糖脂代谢、胰岛素信号通路等代谢过程中发挥重要调控作用[2] 。然而笔者查阅文献发现目前世界范围内关于单纯性肥胖儿童体循环中miRNA表达变化的研究不多,且多处于统计描述阶段;另外肥胖儿童体循环中miRNA表达水平与体质量、腰围、BMI等体格测量数据及血脂、血糖、胰岛素等生化指标关系的分析缺乏大样本的数据支持。因此,本课题组拟以健康儿童的外周血样本为参考,对单纯性肥胖儿童体循环miRNA水平进行分析,以进一步探究miRNA作为儿童肥胖相关代谢异常的分子标志物的可能性。
对象与方法
一、研究对象
选取2011年8月至2017年4月于我院新确诊且未进行干预的8 ~ 10岁的单纯性肥胖儿童18例(男7例、女11例)设为肥胖组(单纯性肥胖指BMI大于同年龄、同性别第95百分位数,且除外继发性肥胖),将同期到我院进行入学体检的性别、年龄相匹配的正常儿童18名(男9名、女9名)设为正常对照组。分别随机抽取单纯性肥胖与正常儿童各3例,将其血样用于基因芯片筛查(miRNA初筛),各组其余15例血样用于miRNA验证。所有入选对象均排除继发性肥胖、自身免疫性疾病、家族遗传性疾病、血液病、各种恶性肿瘤及近期有严重感染、重大外伤或手术等情况。
二、方 法
1. 人体参数测量
按照WHO儿童身高体质量测量方法2003标准测量所有儿童的身高、体质量、腰围[3]。使用水银血压计测量所有儿童的血压,根据儿童上臂长度选择适当袖带,每例测量2次,取平均值。
2. 生化指标检测
于空腹8 h后采集所有儿童的静脉血用于检测。使用雅培安妥超越型血糖仪测定血糖,采用的是葡萄糖氧化酶电极测量法。使用日立7600全自动生化分析仪以直接化学发光免疫分析法测定总胆固醇、HDL、非HDL(non-HDL)、LDL、甘油三酯、胰岛素。
3. 基因芯片检测及逆转录-PCR(RT-PCR)验证
本部分研究委托广州金域检验公司完成。基因芯片采用高通量microRNA microarray技术,使用μParaflo 微流体芯片,miRNA的标记与芯片的杂交使用Cy3染料染色。杂交图像利用激光扫描仪(GenePix 4000B,Molecular Device)采集,并使用Array-Pro 图像分析软件(Media Cybernetics)进行图像数字化转换。验证使用实时荧光PCR仪(Bio-Rad CFX96)完成。
4. 目标miRNA选择方法
使用生物信息学分析软件对筛选出的表达差异倍数较高的miRNA进行靶基因预测,挑选目标miRNA进行验证。使用的生物信息学分析软件包括:第一代预测软件miRanda、TargetScans,第二代测序软件PicTar、microTar以及数据库miRBase。采用5种软件分别进行靶基因预测,后取交集。靶基因参与糖脂代谢、胰岛素信号通路或脂肪细胞分化等过程,即可作为目标miRNA。
三、统计学处理
应用SPSS 24.0进行统计分析。非正态分布定量资料采用中位数(下四分位数,上四分位数)描述,组间比较采用秩和检验。2组定性数据的比较采用Fisher确切概率法。各指标间相关性采用Spearman秩相关分析。P < 0.05为差异有统计学意义。
结果
一、 基因芯片检测及目标体循环miRNA选择
本研究共检测循环miRNA 1895个,筛选出存在统计学意义差异的miRNA 67个(差异2倍及以上),其中表达下调48个,表达上调19个,最大差异倍数9.02倍。通过靶基因预测,挑选miRNA-142-3p、miRNA-142-5p、miRNA-133b与miRNA-486-3p进行验证,见表1。
二、RT-PCR验证
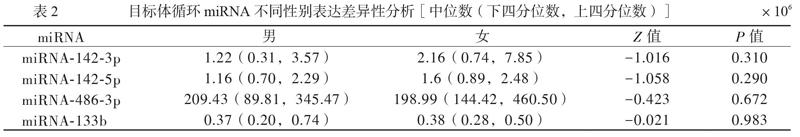
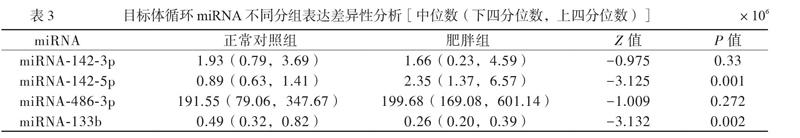
miRNA-142-3p、miRNA-142-5p、miRNA-486-3p及miRNA-133b 男、女间比较差异无统计学意义(P均> 0.05),见表2。肥胖组血浆中miRNA-142-5p表达上调,miRNA-133b表达下调,而miRNA-142-3p和miRNA-486-3p的表达水平2组间无差异(P均> 0.05),见表3。
三、体循环miRNA-142-3p、miRNA-142-5p、miRNA-486-3p及miRNA-133b代谢异常差异性分析
miRNA-142-3p表达水平仅在中心性肥胖儿童中升高,而不受代谢异常影响;miRNA-142-5p表达水平在合并有高甘油三酯血症、胰岛素抵抗(IR)等代谢异常的儿童中表达升高,而不受中心性肥胖、血压异常的影响; miRNA-133b表达水平不受代谢异常的影响;miRNA-486-3p表达水平在中心性肥胖及IR儿童中升高,不受高甘油三酯血症、高血压、高non-HDL血症等代谢异常的影响,见表4。
四、miRNA表达水平相关性分析
分析体格测量数据及生化指标与miRNA-142-5p、miRNA-142-3p、miRNA-133b、miRNA-486-3p的相关性,结果显示miRNA-142-5p表达水平与体质量、腰围、腰围/身高、BMI、血糖、血压、甘油三酯、non-HDL、胰岛素及胰岛素抵抗指数(HOMA-IR)呈正相关,与胰岛素敏感指数(ISI)呈负相关;而与年龄、总胆固醇、HDL、LDL等无相关性;miRNA-133b表达量与體质量、腰围、腰围/身高、BMI、胰岛素、HOMA-IR等呈负相关,与ISI呈正相关,与年龄、血脂、血压等无相关性;miRNA-142-3p表达水平与体格测量数据及生化指标均不存在相关性;miRNA-486-3p表达水平仅与血压水平呈正相关,见表5。
表5 目标体循环miRNA表达水平的相关性分析
项 目 miRNA-
142-3p miRNA-
142-5p miRNA-
133b miRNA-
486-3p
年龄 -0.330 0.070 -0.067 -0.077
体质量 -0.300 0.482a -0.487a 0.155
腰围 -0.349 0.452a -0.493a 0.180
腰围/身高 -0.285 0.490a -0.434a 0.170
BMI -0.272 0.534a -0.443a 0.169
血糖 -0.317 0.491a -0.296 -0.182
收縮压 -0.251 0.486a -0.300 0.401a
舒张压 0.198 0.460a -0.033 0.350
甘油三酯 -0.047 0.374a -0.199 -0.061
总胆固醇 -0.366a 0.322 -0.106 -0.120
HDL 0.030 -0.020 0.167 0.170
LDL -0.182 0.223 -0.108 -0.133
non-HDL 0.287 0.362a -0.199 -0.099
胰岛素 -0.282 0.578a -0.458a 0.085
HOMA-IR -0.200 0.590a -0.437a 0.092
ISI 0.253 -0.565a 0.466a -0.273
注:a为秩相关系数经检验P < 0.05
讨论
miRNA作为基因表达调节的关键因子,几乎参与生物体全部生命活动,从细胞的分化、发育、凋亡到机体的免疫应答、病毒感染、神经变性性疾病、肿瘤等,而且在脂肪细胞分化、糖脂代谢、胰岛素信号通路等代谢过程中发挥着重要的调控作用[4-9]。循环中miRNA的表达变化与机体的生理病理状态有关,并具有组织和疾病特异性,可以作为疾病的生物学标志物[2]。众多研究显示肥胖者与正常体质量者血浆中miRNA表达谱存在较大差异,并与体质量、腰围等指标存在明确的相关性,并且随体质量、BMI等指标的变化而改变,提示体循环miRNA可能是比血脂、胰岛素、胆固醇等生化指标更能敏感预测肥胖及其并发症的生物学标志物[2, 10-15]。
我们通过基因芯片初筛及RT-PCR验证,最终发现4个目标miRNA在儿童循环中的表达水平不受性别差异的影响;与正常儿童相比,单纯性肥胖儿童体循环中miRNA-142-5p表达上调,miRNA-133b表达下调,且其表达水平受代谢异常的影响,并与体格测量数据及生化指标存在明确相关性。
一、miRNA-142-5p、miRNA-133b与肥胖
miRNA-142-5p的靶基因包括ATP1B1和ACOX1, ATP1B1与Na+/K+ ATP酶的活性有关,参与调节胰岛素分泌等生物过程[16]。基因ACOX1编码过氧化物酶酰基辅酶A氧化酶,通过影响脂肪酸β氧化,参与PPAR信号通路调节的方式来调节机体血脂、甘油三酯及酮体代谢等生物学过程[17]。本研究显示与正常儿童相比,单纯性肥胖儿童体循环中miRNA-142-5p表达上调,其在合并有高甘油三酯血症、IR等代谢异常的儿童中表达升高,且其表达水平与体质量、腰围、腰围/身高、BMI、血糖、血压、甘油三酯、non-HDL、胰岛素及HOMA-IR呈正相关,与ISI呈负相关。miRNA-133b的靶基因包括TBL1X,参与调控脂肪细胞Wnt信号通路及脂肪细胞的分化。Wnt信号通路的激活,可以影响下游靶基因产物的磷酸化作用,进而抑制过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT/增强子结合蛋白α(C/EBPα)等脂肪细胞关键的转录因子,使细胞保持未分化状态,从而抑制脂肪的形成[18]。本研究显示miRNA-133b在单纯性肥胖儿童体循环中的表达下调,表达量与体质量、腰围、腰围/身高、BMI、胰岛素、HOMA-IR等指标呈负相关,与ISI呈正相关。因此,我们初步认为miRNA-142-5p和miRNA-133b可能通过转录后水平启动基因沉默机制参与肥胖相关的脂肪细胞异常分化、IR和脂质代谢紊乱的形成,参与肥胖代谢综合征的病理生理过程,是一种潜在的肥胖相关代谢异常的分子标志物。
二、miRNA-142-3p、miRNA-486-3p与肥胖
miRNA-142-3p靶基因包括OSBPL3和MAP4K3,其中OSBPL3为细胞内脂质受体氧类固醇结合蛋白(OSBP)家族的成员,参与脂质转运及胆固醇的结合等生物学过程。MAP4K3为丝裂原活化蛋白激酶家族成员,参与胰岛素信号通路的调节。人蛋白激酶B2是miRNA-486-3p的靶基因之一,是磷酸肌醇依赖性丝氨酸/苏氨酸蛋白激酶的异构体,主要富集于胰岛素敏感组织中,参与胰岛素信号通路的调节,对葡萄糖刺激性胰岛素反应及脂肪酸的β氧化具有正性调控作用[19]。既往研究表明miRNA-142-3p与miRNA-486-3p在肥胖者或糖尿病患者体循环中的表达水平升高,且与肥胖者的脂肪量、BMI、腰围、HOMA-IR等指标存在明确相关性[14-15, 20]。本研究显示,与正常儿童相比,单纯性肥胖儿童体循环miRNA-142-3p及miRNA-486-3p表达水平无明显差异,并与代谢异常、体格测量数据及生化指标无关,这可能与本次研究的样本量少有关,其在单纯性肥胖儿童循环中的表达特点尚需要更大样本量的研究阐述。
綜上所述,在单纯性肥胖儿童体循环中miRNA-142-5p呈高表达,而miRNA-133b却呈低表达,说明两者可能参与了儿童肥胖代谢综合征发生发展的病理生理过程,然而其具体作用机制尚未明确。本研究显示两者表达水平与单纯性肥胖儿童的体格测量数据、生化指标及代谢异常明显相关,为探讨miRNA-142-5p、miRNA-133b作为肥胖及其相关并发症生物学标志物的可能性奠定了基础。
参 考 文 献
[1] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell,2004,116(2):261-297.
[2] Veerle Rottiers,Anders M,Naar. MicroRNAs in metabolism and metabolic disorders. Nat Rev Mol Cell Biol,2012,13(4):239-250.
[3] 孙冰,朱逞. 小儿肥胖症与代谢综合征的关系. 中国实用儿科杂志,2004,19(3):168-171.
[4] Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell,2009,136(2): 215-233.
[5] Voinnet O. Origin, biogenesis, and activity of plant microRNAs. Cell,2009,136(4): 669-687.
[6] Fabian MR, Mathonnet G, Sundermeier T, Mathys H, Zipprich JT, Svitkin YV, Rivas F, Jinek M, Wohlschlegel J, Doudna JA, Chen CY, Shyu AB, Yates JR 3rd, Hannon GJ, Filipowicz W, Duchaine TF, Sonenberg N. Mammalian miRNA RISC recruits CAF1 and PABP to affect PABP-dependent Deadenlation. Mol Cell,2009, 35(6): 868-880.
[7] Betel D, Wilson M, Gabow A, Marks DS, Sander C. The microRNA. org resource: targets and expression. Nucleic Acids Res,2009,36: D149-D153.
[8] Hon LS, Zhang Z. The roles of binding site arrangement and combinatorial targeting in microRNA repression of gene expression. Genome Biol,2007, 8(9): R166.
[9] Rottiers V, Najafi-Shoushtari SH, Kristo F, Gurumurthy S, Zhong L, Li Y, Cohen DE, Gerszten RE, Bardeesy N, Mostoslavsky R, N??r AM. MicroRNAs in metabolism and metabolic diseases. Cold Spring Harb Symp Quant Biol,2011,76:225-233.
[10] 康春生,尤永平,浦佩玉. miRNA在恶性肿瘤诊断额治疗中的进展.中国神经肿瘤杂志,2007,5(2):138-141.
[11] Vickers KC, Palmisano BT, Shoucri BM, Shamburek RD, Remaley AT. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nature Cell Biol,2011, 13(4): 423-433.
[12] Zampetaki A, Kiechl S, Drozdov I, Willeit P, Mayr U, Prokopi M, Mayr A, Weger S, Oberhollenzer F, Bonora E, Shah A, Willeit J, Mayr M. Plasma microRNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes. Circ Res,2010,107(6):810-817.
[13] Li S, Zhu J, Zhang W, Chen Y, Zhang K, Popescu LM, Ma X, Lau WB, Rong R, Yu X, Wang B, Li Y, Xiao C, Zhang M, Wang S, Yu L, Chen AF, Yang X, Cai J. Signature microRNA expression profile of essential hypertension and its novel link to human cytomegalovirus infection. Circulation,2011, 124(2):175-184.
[14] Ortega FJ, Mercader JM, Catalán V, Moreno-Navarrete JM, Pueyo N, Sabater M, Gómez-Ambrosi J, Anglada R, Fernández-Formoso JA, Ricart W, Frühbeck G, Fernández-Real JM. Targeting the circulating microRNA signature of obesity. Clin Chem, 2013,59(5):781-792.
[15] Prats-Puig A, Ortega FJ, Mercader JM, Moreno-Navarrete JM, Moreno M, Bonet N, Ricart W, López-Bermejo A, Fernández-Real JM. Changes in circulating microRNAs are associated with childhood obesity. J Clin Endocrinol Metab,2013,98(10):E1655-E1660.
[16] Li Y, Yang J, Li S, Zhang J, Zheng J, Hou W, Zhao H, Guo Y, Liu X, Dou K, Situ Z, Yao L. N-myc downstream-regulated gene 2, a novel estrogen-targeted gene, is involved in the regulation of Na+/K(+)-ATPase. J Biol Chem,2011,286(37): 32289-32299.
[17] Li Y, Tharappel JC, Cooper S, Glenn M, Glauert HP, Spear BT. Expression of the hydrogen peroxide-generating enzyme fatty acyl CoA oxidase activates NF-kappa-B. DNA Cell Biol,2000,19(2): 113-120.
[18] 罗肖,李惠侠,杨公社.Wnt信号通路与前体脂肪细胞.中国生物化学与分子生物学报,2007,23(10):791-796.
[19] Li X, Monks B, Ge Q, Birnbaum MJ. Akt/PKB regulates hepatic metabolism by directly inhibiting PGC-1-alpha transcription coactivator. Nature,2007, 447(7147): 1012-1016.
[20] Collares CV, Evangelista AF, Xavier DJ, Rassi DM, Arns T, Foss-Freitas MC, Foss MC, Puthier D, Sakamoto-Hojo ET, Passos GA, Donadi EA. Identifying common and specific microRNAs expressed in peripheral blood mononuclear cell of type 1, type 2, and gestational diabetes mellitus patients. BMC Research Notes, 2013, 6:491.
(收稿日期:2019-05-28)
(本文編辑:洪悦民)

