CCR5第一、二胞外环特异性结合短肽对大鼠损伤性结肠上皮细胞的重建作用与机制
宋铱航 刘思雪 简嘉甫 黄花荣 钟英强


【摘要】目的探究CC趋化因子受体5 (CCR5)第一、二胞外环拮抗短肽对大鼠损伤性结肠上皮细胞的重建作用与机制。方法原代培养大鼠结肠上皮细胞并鉴定;建立由TNF-α诱导的损伤性结肠上皮细胞模型;CCK8法检测两短肽(分别简称GH和HY短肽)对损伤性上皮细胞生长的影响;实时荧光定量PC R和蛋白免疫印迹法检测各组(正常对照组、损伤模型组、各浓度GH短肽组、各浓度HY短肽组)黏蛋白2、occludin、CCR5、表皮生长因子(EGF)、三叶因子3(TFF3)的mRNA和蛋白表达水平。结果150ng/ml TNF-α作用细胞48h后可获得损伤性上皮细胞;GH和HY短肽在0.125~0.500mg/ml浓度下均能促进损伤性上皮细胞增殖;0.125~0.500mg/ml浓度的GH短肽组和HY短肽组occludin、EGF、TFF3的mRNA和蛋白水平均比损伤模型组高(P均<0.05);0.500mg/ml浓度的GH短肽组和HY短肽组黏蛋白2的mRNA和蛋白的表达均比损伤模型组高(P均<0.05):0.250~1.000mg/ml浓度的GH短肽组、0.500~1.000mg/ml浓度的HY短肽组CCR5的mRNA和蛋白表水平达均比损伤模型组低(P均<0.05)。结论CCR5第一、二胞外环特异性结合短肽在一定浓度范围内可促进损伤性上皮细胞的增殖,其机制可能与促进黏蛋白2、occludin、EGF、TFF3的表达有关。
【关键词】炎症性肠病;肠上皮细胞;原代培养;CC趋化因子受体5;拮抗短肽
炎症性肠病(IBD)是一组病因未完全明了的慢性肠道非特异性免疫炎性疾病,主要包括克罗恩病、溃疡性结肠炎和中间型IBD[1]。IBD除引起肠道损伤和炎症表现外,肠上皮细胞的修复和重建在病程中也起着重要作用。一方面,肠上皮细胞紧密连接结构的连续性和数量会因黏膜屏障的扰乱而改变,IBD患者紧密连接蛋白occludin的表达有所下降,另一方面,多种因子参与肠黏膜修复[2]。三叶因子3(TFF3)主要由肠上皮细胞和杯状细胞表达,其可与肠道其它保护因子如表皮生长因子(EGF)和黏蛋白2等共同作用,减轻多种因素介导的肠黏膜损伤[3]。
CC趋化因子受体5(CCRS)作为趋化因子受体的一种,已被证实与IBD有密切的关系[4]。既往研究发现,CCRS第一、二胞外环特异性结合的模拟肽治疗三硝基苯磺酸诱导的结肠炎大鼠后,肠道炎症明显减轻,结肠黏膜与上皮细胞发生了重建[5]。本研究拟进行大鼠结肠上皮细胞的原代培养,建立损伤性上皮细胞模型,探讨CCRS第一、二胞外环特异性结合短肽对损伤性上皮细胞生长的影响以及对黏蛋白2、occludin、CCRS、EGF、TFF3基因和蛋白表达的影响,为IBD的治疗提供新的靶点。
材料与方法
一、动物
SD乳鼠40只,雌雄不限,6~15日龄,体质量10~209、由中山大学动物实验中心(北校区)提供,许可证号:SYXK(粤)2017-0181,饲养条件为SPF级。本实验符合中山大学动物实验伦理要求。
二、主要試剂
CCRS第一、二胞外特异性拮抗肽由上海吉尔生化合成,其序列为GHWKVWL(简称GH)、HYIDFRA(简称HY);胎牛血清、DEME培养基和青链霉素混合液购自Gibco;牛垂体提取物、胰岛素铁硒传递蛋白购自ScienCell; Dispase I购自Roche;胶原酶XI和Y27632购自Sigma; TNF-α购自R&D; CK-18一抗和GAPDH一抗购自Affinity;EGF由七、TFF3一抗和黏蛋白2一抗购自Santa Cruz;CCR5一抗和occludin一抗购自Abcam;Alexa Fluor■488荧光二抗购自中杉金桥;CCK8试剂盒购自Dojindo。
三、主要方法
1.完全培养基和酶消化液的配置
完全培养基:DMEM培养基,10%胎牛血清,20ng/ml表皮生长因子,5 [[Lg/ml牛垂体提取物,10μg/ml胰岛素,10μg/ml转铁蛋白,100μg/ml肝素钠,100 IU/ml青霉素,100μg/ml链霉素。酶消化液:完全培养基,0.1mg/ml Dispase I、300U/ml胶原酶XI,10 nmol/ml Y27632。
2.SD大鼠原代结肠上皮细胞的分离与培养
参考文献[6-8]的方法并改进。取6一巧日龄乳鼠5只,颈椎脱臼处死,无菌下取出结肠并纵行剪开,用含青链霉素的磷酸盐缓冲液(PBS)清洗5次,剪碎至1mm3大小,反复清洗至上清澄清,加10ml酶消化液25℃震荡消化30min、反复吹打3~5min,室温静置1min。取上清至新离心管,加10ml梯度离心液(DMEM+5%胎牛血清+2%山梨醇),200~300转/分离心2min,弃上清,加10ml离心液重悬,重复3一5次后加培养基接种于25cm2培养瓶培养,每48h更换培养液。细胞长至80%~90%加0.05%胰酶消化,光镜下看到成纤维样细胞变圆飘起时倒弃消化液,PBS清洗后再加0.25%胰酶消化,离心后接种于新的培养瓶,90min后将培养液连同未贴壁细胞转移至新的培养瓶中继续培养。
3.大鼠结肠上皮细胞的鉴定
CK-18是上皮细胞表面特异性标记物之一,本实验采用免疫荧光法鉴定。将第2代细胞接种于爬片上,待长至60%~80%去除培养液,4%多聚甲醛固定15min,0.2% Triton X-100破膜10min、3% BSA室温封闭30min,CK-18一抗(1:200稀释)4℃孵育过夜,漂洗后荧光二抗(1:400稀释)避光孵育1h,DAPI避光染色10min,封片后荧光显微镜观察。
4.损伤性结肠上皮细胞的制备与细胞生长曲线
取第2代细胞,以1×104/ml密度种于85孔板,每孔100μl,共5组(含无细胞空白对照组)。24h贴壁后加入TNF-α使其终浓度为0、50、100、150ng/ml、培养1~8d(每48h换液),加入CCK8,孵育1h。酶标仪测定450nn波长下各孔吸光度(ODQ450)。以时间为横轴,以OD值为纵轴绘制各组细胞生长曲线。
5.透射电镜观察正常和损伤性上皮细胞
取第2代细胞种于培养皿,设正常对照组和损伤模型组,正常对照组不处理,损伤模型组TNF-α以150ng/ml刺激细胞,48h后电镜固定液4'C固定3h,回收细胞并经包裹、再固定、漂洗、脱水和包埋后,制成厚度约50~80nn的切片,醋酸双氧铀、枸橼酸铅双染后透射电镜观察。
6.应用拮抗短肽干预损伤性上皮细胞
取第2代细胞种于96孔板,设5组细胞孔和1组空白孔,对照组为不加短肽的损伤模型组。24h细胞贴壁后,TNF-α以150ng/ml浓度作用于各组细胞,48h后GH和HY短肽分别以0、0.125、0.250、0.500、1.000mg/ml的浓度作用于各组细胞1~7d。CCK8法测定OD值并绘制生长曲线。
7.实时荧光定量PCR检测黏蛋白2、occludin、CCR5、EGF、TFF3的mRNA表达水平
细胞种于6孔板,设正常对照组、损伤模型组、GI短肽组和HY短肽组(浓度各为0.125、0.250、0.500、1.000mg/ml)。24h贴壁后,TNF-α以150ng/ml浓度作用于损伤模型组和各给药组,48h后GH和HY短肽以上述浓度分别作用于各组细胞。5d后回收细胞。Trizol法提取总RNA,逆转录,扩增,检测结合SYBR染料的熒光强度,得到循环数Ct值。以β-actin为内参,2-△△Ct计算基因表达的相对定量。引物序列见表1。
8.蛋白免疫印迹法检测黏蛋白2、occludin、CCR5、EGF、TFF3的蛋白表达水平
参考7的分组和处理,提总蛋白,测蛋白浓度,变性后将蛋白样本等量等体积加入凝胶中电泳、转印。5%BSA封闭,黏蛋白2(1:1000)、occludin(1:5 000)、一抗CCR5(1:2 000)、EGF(1:1000)、TFF3(1:1000)、GAPDH(1:1000)4℃孵育过夜。二抗(1:10 000)室温孵育1h,ECL化学发光显影。结果用Image J软件进行灰度值分析比较。
四、统计学处理
用SPSS 22.0和GraphPad Prism 7.0统计和作图,计量资料采用x士s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法,P<0.05为差异有统计学意义。
结果
一、结肠上皮细胞形态
原代培养可获得大量完整隐窝单位(图IA、B),24h后见其贴壁,周围少量细胞爬出(图1C)。3~5d可见细胞呈片状集落,周围辐射出大量细胞。细胞形态多样,呈多角形或铺路石样,可见成纤维样细胞混杂生长(图1D、E)。纯化后的上皮细胞纯度大为提升,传代后依然生长良好(图1F)。
二、结肠上皮细胞鉴定
免疫荧光染色后,多数细胞呈现绿色荧光,即CK-18角蛋白表达阳性(图2A、D),胞核呈蓝色荧光(图2B、E),融合后图像如图2C、F。
三、正常和损伤性上皮细胞的生长曲线
正常结肠上皮细胞接种后2一8d位于指数生长期,提示了此段时间细胞活力最佳,是进行各种实验的良好时机。
TNF-α以50ng/ml浓度作用于细胞时,第6、8日的OD值有轻微降低(P均<0.05);当TNF-α为100ng/ml时,第5-8日细胞的OD值与正常对照组相比有所降低(P均<0.05);TNF-α为150ng/ml时,第2~8日的OD值与正常对照组相比降低(P均<0.05),见图3。
四、电镜观察正常和损伤性上皮细胞的超微结构
正常结肠上皮细胞(图4A、B)可见胞膜周围有较多的微绒毛(黑色箭头)以及线粒体(红色箭头)、内质网(蓝色箭头)等多种细胞器。损伤性上皮细胞(图4C、D)可见细胞膜局部破损,胞质内空泡较多。部分线粒体明显肿胀,嵴消失,呈空泡样,部分内质网轻微扩张,微绒毛明显肿胀,可见4个自噬小体(紫色箭头)。
五、GH和HY短肽对损伤性上皮细胞生长的影响
第4日GH短肽0.250、0.500mg/ml和HY短肤0.125一0.500mg/ml作用细胞的OD值与损伤模型组相比略有增高(P均<0.05);第5~7日两短肽以0.125~0.500mg/ml浓度作用细胞的OD值较损伤模型组均有升高(P均<0.05),见图5。
六、GI和日、短肽对黏蛋白2、occludin、CCR5、EGF、TFF3基因表达的影响
在0.125~0.500mg/ml浓度的GH短肽组和HY短肽组,occludin、EGF和TFF3的mRNA表达水平均比损伤模型组高(P均<0.05); 0.500mg/ml浓度的GI和日、短肽组黏蛋白2的mRNA表达水平均比损伤模型组高(P均<0.05);0.250~1.000mg/ml浓度的GH短肽组、0.500~1.000mg/ml浓度的HY短肽组CCRS的mRNA表达水平均比损伤模型组低(P均<0.05),见表2、3。
七、GH和HY短肽对黏蛋白2、occludin、CCR5、EGF、TFF3蛋白表达水平的影响
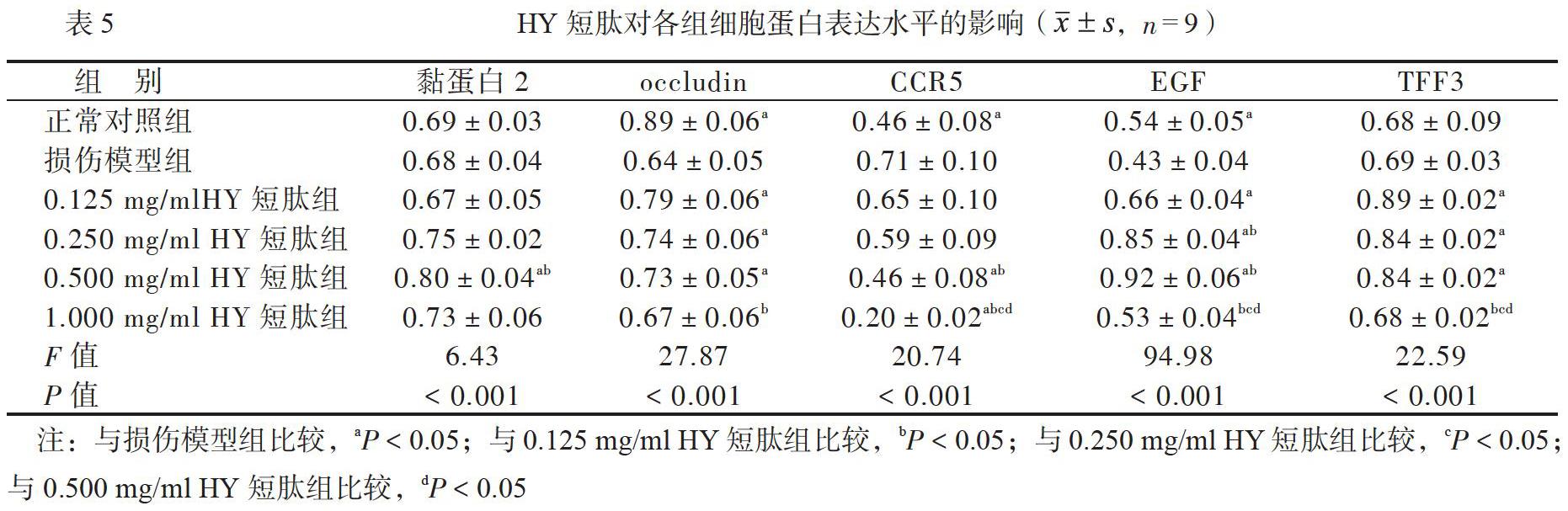
在0.125~0.500mg/ml浓度的GH短肽组和HY短肽组occludin、EGF和TFF3的蛋白表达水平均比损伤模型组高(P均<0.05); 0.500mg/ml浓度的GH短肽组和HY短肽组黏蛋白2蛋白的表达水平均比损伤模型组高(P均<0.05);0.250~1.000mg/ml浓度的GH短肽组、0.500~1.000mg/ml浓度的HY短肽组CCR5的蛋白表达水平均比损伤模型组低(P均<0.05),见表4、5。
讨论
IBD作为一种发病机制未完全明确的疾病,基础实验中动物模型的建立相对完善,缺乏相应的细胞模型。我们采用Dispase Ⅰ和胶原酶Ⅺ联合消化结肠组织,用鼠尾胶原包被培养瓶促进隐窝单位贴壁。酶消化液中添加Rho激酶抑制剂Y27632来抑制肠道干细胞的“失巢凋亡”[9]。上皮细胞的原代培养中常混杂成纤维细胞,纯化是培养的关键环节。成纤维细胞对胰酶更为敏感、贴壁速度更快,因此用差速消化法和差速贴壁法提纯,可显著减少成纤维细胞的数量,以满足后续实验的要求。
TNF-α作为与IBD相关的前沿炎症因子,是引起肠上皮细胞损伤的主要因素之一,可诱导结肠上皮细胞凋亡,增加肠道上皮的通透性帅[10]。TNF-α在IBD患者的表达可呈现慢性、长期的升高,且TNF-α单抗(如Infliximab)对中重度IBD有明显治疗效果[11]。我们用TNF-α制备损伤性肠上皮细胞,发现150ng/ml的TNF-α刺激48 h后对细胞的生长有较为明显的抑制,且随着时间延长,抑制作用持续存在。电镜结果也表明,该条件下细胞的超微结构也发生了明显损伤。
CCR5主要表达于T细胞、单核细胞和未成熟树突状细胞的胞膜上,有关CCR5的研究也多集中在对炎症细胞自身的影响。Dwine且等[12]发现了人类多种结肠癌细胞系和正常结肠黏膜组织中也表达CCR5,随后Ye等[13]发现了IBD活动期患者肠黏膜CCR5表达的阳性率明显增高,且主要集中在固有层炎症细胞、固有腺体上皮细胞和血管内皮细胞的胞膜上。遗憾的是,CCR5在结肠上皮细胞和炎症细胞中的功能是否完全相同并未有报道。
本课题组通过噬菌体肽库展示技术筛选出2条特异性结合CCR5胞外环的短肽,发现它们可改善TNBS诱导的大鼠结肠炎的病理和组织学的改变[14-15]。本研究中0.125~0.500mg/ml濃度的GH和HY短肽均有促进损伤性结肠上皮细胞增殖的作用。实时荧光定量PCR和蛋白免疫印迹试验结果也表明,适当浓度的 GH、HY短肽均可促进黏蛋白2、occludin、EGF、TFF3 mRNA和蛋白的表达。另外,一定浓度GH、HY短肽可抑制CCR5mRNA和蛋白的表达,且随着浓度升高,抑制作用更加明显。这充分说明GH和HY短肽促进损伤性肠上皮细胞重建机制与这些生长因子的表达增高有关[16]。
CCR5拮抗剂能否直接影响细胞表面CCR5的表达,目前尚无定论,Venuti等[17]发现CCR5抗体与其胞外环结合时,可造成T细胞表面CCR5阴性表达,可能由于胞内信号通路被激活,形成了以CCR5为中心的复合体。还有研究发现,CCR5除了以单体形式存在于细胞表面,也能在内质网中聚合成同源寡聚体,还可与其他趋化因子受体聚合发生生物学效应[18]。Sohy等[19]发现在T细胞和单核细胞中,CCR2、CCR5以及CXCR4可共同组成异源三聚体,任一单体的拮抗剂都可影响到另外两者的生物活性。现阶段有多种CCR5抑制剂被开发,马拉维若是目前唯一被批准可应用于临床的CCR5小分子拮抗剂,但不会影响CD4+T细胞表面CCR5的表达,而蛋白激酶C拮抗剂苔藓虫素-1却能使CCR5的表达降低[20]。GH和HY短肽可能有别于传统拮抗剂,除特异性结合CCR5以外还具有其他生物学功能。
综上所述,细胞水平上适宜浓度的GH和HY短肽可促进损伤性上皮细胞增殖,分子水平上其可促进肠黏膜修复相关蛋白黏蛋白2、occludin、EFG和TFF3的表达。这其中涉及的具体信号通路和分子机制尚未完全明确,有待进一步研究。
参考文献
[1]钟英强,黄花荣,陈其奎,朱兆华.肠道溃疡性疾病.北京:人民卫生出版社,2009:197-204.
[2]Martini E,Krug SM,Siegmund B,Neurath MIT,Becker C.Mend your fences:the epithelial barrier and its relationshipwith mucosal immunity in inflammatory bowel disease.Cell MolGastroenterol Hepatol,2017,4(1):33-46.
[3]Xu LF,Teng X,Guo J,Sun M.Protective effect of intestinaltrefoil factor on injury of intestinal epithelial tight junctioninduced by platelet activating factor.Inflammation,2012,35(1):308-315.
[4]胡梅,钟英强.CC趋化因子受体5与炎症性肠病的研究进展.胃肠病学,2015,20(12):753-756.
[5]宋杨达,刘思雪,宋铱航,沈溪明,黄花荣,钟英强.CCR5第一和第二胞外环特异性结合短肽对大鼠结肠炎的炎症细胞浸润及NF-KB/TNF-α信号通路的影响.新医学,2018,49(5):309-314.
[6]Gracz AD,Puthoff BJ,Magness ST.Identification,isolation,and culture of intestinal epithelial stem cells from murine intes-tine.Methods Mol Biol,2012,879:89-107.
[7]Campbell CF.Isolation and culture of mouse intestinal cells.Methods Mol Biol,2010,633:197-206.
[8]O'Rourke KP,Ackerman S,Dow LE,Lowe SW.Isolation,culture,and maintenance of mouse intestinal stem cells.BinProtoc,2016,6(4).pii:e1733.
[9]Watanabe K,Ueno M,Kamiya D,Nishiyama A,Matsumura M,Wataya T,TakahashiJB,Nishikawa S,Nishikawa S,Muguru-ma K,Sasai Y.A ROCK inhibitor permits survival of dissociatedhuman embryonic stem cells.Nat Biotechnol,2007,25(6):681-686.
[10]Jones-Hall YL,Nakatsu CH.The intersection of TNF,IBD andthe microbiome.Gut Microbes,2016,7(1):58-62.
[11]Billmeier U,Dieterich W,Neurath MF,Atreya R.Molecularmechanism of action of anti-tumor necrosis factor antibodies ininflammatory bowel diseases.World J Gastroenterol,2016,22(42):9300-9313.
[12]Dwinell MB,Eckmann L,Leopard JD,Varki NM,Kagnoff MEChemokine receptor expression by human intestinal epithelialcells.Gastroenterology,1999,117(2):359-367.
[13]Ye X,Liu S,Hu M,Song Y,Huang H,Zhong Y.CCR5expression in inflammatory bowel disease and its correlationwith inflammatory cells and beta-arresting expression.Scand JGastroenterol,2017,52(5):551-557.
[14]劉思雪,胡梅,叶小研,黄花荣,钟英强.应用噬菌体展示肽库技术淘选大鼠CCR5膜外第一、二胞外环特异性结合的活性拮抗肽与初步鉴定.中国病理生理杂志,2015,31(7):1225-1230.
[15]胡梅,宋杨达,刘思雪,宋铱航,沈溪明,黄花荣,钟英强.CCR5第一、二胞外环特异性结合的拮抗短肽对TNBS诱导SD大鼠结肠炎的治疗作用.中国病理生理杂志,2017,33(5):902-907.
[16]宋铱航,钟英强.炎症性肠病肠上皮细胞修复机制的进展.新医学,2019,50(2):5-9.
[17]Venuti A,Pastori C,Siracusano G,Pennisi R,Riva A,Tom-masino M,Sciortino MT,Lopalco L.The abrogation of phosph-orylation plays a relevant role in the CCR5 signalosome formationwith natural antibodies to CCR5.Viruses,2017,10(1).pH:9.
[18]Isik N,Hereld D,Jin T.Fluorescence resonance energy transferimaging reveals that chemokine-binding modulates heterodimersof CXCR4 and CCR5 receptors.PLoS One,2008,3(10):e3424.
[19]Sohy D,Yano H,de Nadai P,Urizar E,Guillabert A,JavitchJA,Parmentier M,Springael JY.Hetero-oligomerization ofCCR2,CCR5,and CXCR4 and the protean effects of "selective"antagonists.J Biol Chem,2009,284(45):31270-31279.
[20]L6pez-Huertas MR,Jim6nez-Tormo L,Madrid-Elena N,Guti6rrez C,Rodrfguez-Mora S,Coiras M,Alcamf J,Moreno S.The CCR5-antagonist Maraviroc reverses HIV-1 latency in vitroalone or in combination with the PKC-agonist Bryostatin-1.SciRep,2017,7(1):2385
(收稿日期:2019-01-28)
(本文编辑:杨江瑜)
DOI:10.3969/j.issn.0253-9802.2019.05.011
基金项目:广州市科技计划项目(No.201803010004)
作者单位:510120广州,中山大学孙逸仙纪念医院消化内科(宋铱航,刘思雪,简嘉甫,钟英强),儿科(黄花荣)
通信作者,钟英强,E-mail:zhongyingqiang@126.com

