氢氯吡格雷治疗急性缺血性脑卒中的疗效及对血清炎症介质水平的影响
潘绮玲
急性缺血性脑卒中(acute ischemic stroke,AIS)是由于脑动脉闭塞导致的脑组织供血障碍,并因此产生脑组织缺血性梗死,从而出现以神经功能障碍为主的临床综合征,临床致死致残率较高[1],患者病后多生活无法自理,影响生命质量,加重家庭经济负担。该病起病急,救治时间窗窄,临床紧急救治要求高,早期诊断评估、救治及预防具有重要意义。但该病病因较多,发病机制复杂,高血压、高血糖、高热、颅内动脉狭窄等均可能加重病情,临床常用治疗方法包括血管器械介入治疗及抗血小板聚集、扩 张血管剂等药物治疗。目前,扩张发病机制普遍认为是由于缺血区域建立侧支血流不及时或脑灌注下降[2]。因此改善和恢复脑缺血区域组织血流灌注,促进缺血半暗带迅速建立有效的侧支循环是治疗关键。丁苯酞可促进脑供血循环重构,改善脑部缺血区灌注,此外可抑制炎症介质表达,提高过氧化氢酶活性,从而实现保护脑作用[3]。氢氯吡格雷属于脑组织保护剂,当脑组织缺氧后会产生大量氧自由基,其可有效清除自由基,其对脂质过氧化具有抑制作用,对于脑细胞、血管内皮细胞以及神经细胞的氧化损伤可起到抑制作用,从而降低脑组织缺血、缺氧后的进一步损伤[4-5]。本研究就氢氯吡格雷治疗AIS 患者的疗效及对血清炎症介质水平的影响进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2017年5月至2018年5月于顺德医院接受治疗的84 例AIS 患者作为研究对象,按随机数字表法分为对照组与观察组,各42 例。对照组中男23 例,女19 例;年龄47~81 岁,平均(65.2 士6.7)岁;病程2~10 h,平均(5.8±2.2)h。观察组中男22 例,女20 例;年龄46~80 岁,平均(63.8 士7.2)岁;病程3~9 h,平均(5.5±2.6)d。两组患者性别、年龄、病程一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:符合《中国急性缺血性脑卒中诊治指南2018》中AIS 诊断标准[6];局灶神经功能缺损;经CT/磁共振成像(MRI)及心电图、心脏彩超等检查确诊。排除标准:脑瘤、脑炎、出血性脑梗死患者;近期内脑部手术及创伤患者;肝肾功能不全者;既往神经功能缺损、意识障碍、精神疾病及痴呆患者;药物过敏患者。
1.3 治疗方法
两组患者均予以降低血压、血糖治疗,及降低颅内压等对症支持治疗,减少高脂、高糖饮食摄入。对照组口服丁苯酞软胶囊(石药集团恩必普药业有限公司,国药准字H20050299,0.1 g/粒)治疗,2 粒/次,3 次/d。观察组:氢氯吡格雷片[赛诺菲(杭州)制药有限公司,国药准字J20180029,75 mg×28 片],75 mg/次,1 次/d。两组患者均治疗2 周。
1.4 观察指标
1.4.1 神经功能、认知功能 中国卒中量表(CSS)可用于评价神经功能缺损程度,0~45 分,分值越高表示神经功能缺损程度越严重(0~15 分为轻度;16~30 分为中度;31~45 分为重度)[7];蒙特利尔认知评估量表(MoCA)可评估卒中患者认知功能障碍程度,总分30 分,低于26 分视为存在认知功能障碍,分值越高认知功能越好[8]。
1.4.2 凝血功能指标 比较两组治疗前后凝血功能指标变化,包括D-D 二聚体(D-D)、活化部分凝血活酶时间(APTT)和血小板(PLT)。
1.4.3 生化指标 比较两组治疗前后血清炎症介质水平。采用免疫比浊法分别于治疗前后检测患者血清炎症介质水平[血清超敏C 反应蛋白(hs-CRP)、白细胞介素-8(IL-8)和白细胞介素-10(IL-10)],IL-8、IL 一10 水平越低,治疗越好[9]。
1.4.4 疗效判定标准 痊愈:CSS 减分率大于91%;显效:CSS 减分率为46%~90%;有效:CSS 减分率18%~45%;无效:CSS 减分率低于18%[10]。治疗有效率(%)=(痊愈例数+显效例数+有效例数)/总例数×100%。
1.5 统计学分析 采取SPSS 17.0 统计软件进行数据分析,计量资料以±s表示,组间比较采用t检验,计数资料以百分率表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 MoCA 和CSS 评分比较
治疗前,两组患者MoCA、CSS 评分比较差异均无统计学意义(均P>0.05);治疗后,两组MoCA、CSS 评分较治疗前均有所改善,差异均有统计学意义(均P<0.05);治疗后,观察组MoCA、CSS 评分均优于对照组,差异均有统计学意义(均P<0.05)。见表1。
2.2 临床疗效比较
观察组治疗有效率明显高于对照组,差异有统计学意义(P<0.05)。见表2。
2.3 凝血功能比较
治疗前,两组患者D-D、APTT 及PLT 水平比较差异均无统计学意义(均P>0.05);治疗后两组D-D、APTT 及PLT 水平较治疗前均有所改善,差异均有统计学意义(均P<0.05);治疗后观察组D-D 水平低于对照组,APTT 短于对照组,PLT 高于对照组,差异均有统计学意义(均P<0.05)。见表3。
2.4 治疗前后血清IL-8、hs-CRP 和IL-10 水平比较
治疗前两组患者血清IL-8、hs-CRP 和IL-10 水平比较,差异均无统计学意义(均P>0.05);治疗后两组血清IL-8、hs-CRP 和IL-10 水平比较治疗前均有所降低均(P<0.05);治疗后,观察组血清IL-8、hs-CRP 和IL-10 水平低于对照组,差异均有统计学意义(均P<0.05)。见表4。
3 讨论
AIS 是常见卒中类型,在脑卒中所占比例较大[11],其是目前脑卒中死亡的最大原因之一,是致残的重要原因[12]。有研究显示,氧化应激、炎症反应、神经细胞损伤等均为本病脑损伤重要因素,微循环与神经细胞存在密切关系,当疾病发生破坏彼此间协调关系后,炎症反应激活胶质细胞,受细胞因子及 其他成分调节影响而产生一系列病理改变,导致神经元的损伤,影响认知功能[13]。
在AIS 中,因早期血肿占位效应造成脑组织缺血及病灶部位的白细胞浸润产生大量自由基,自由基对细胞膜磷脂中多聚不饱和脂肪酸及其不饱和双键造成损伤,破坏血管内皮细胞使血管通透性增强,促进病情进展,并促发更多自由基产生,形成恶性循环。同时白细胞的浸润可产生大量氧自由基,对细胞膜造成损害,加重脑组织的损伤[14]。D-D 是交联纤维蛋白在纤溶酶作用下产生的特异性降解物,其增高可提示血栓的形成及溶解增强,高水平的D-D提示缺血性脑血管疾病的发生。当机体动脉粥样硬化斑块能损伤血管内皮细胞,促进血小板活化,使血小板-纤维蛋白原血栓形成,从而使血管闭塞,脑部供血出现障碍,导致脑组织急性缺血;此外血小板激活后血栓素A2释放量,促进Ca2+进入至胞质,使微小丝肌动球蛋白系统收缩和腺苷酸环化酶含量降低,加快血小板的活化,促进血小板黏附与聚集,形成恶性循环[15]。APTT 为凝血系统异常的筛选指标,已被广泛应用于血栓性疾病筛查,其可反映缺血性脑卒中患者凝血功能增强及纤溶能力降低,临床检测意义为AIS 采用溶栓类药物治疗,势必延长APTT,从而增加出血风险,造成病情进展,因此在选溶栓前的凝血指标APTT检测具有重要参考价值[16]。AIS 是多因素造成血管病变形成脑部供血障碍的疾病,该过程中伴随血管细胞损伤,产生炎症反应,炎症介质hs-CRP 在机体组织损伤或发生炎症反应时其水平显著上升,其可反映动脉粥样硬化严重程度[17]。丁苯酞为多靶点抗脑缺血类药物,其有效成分是消旋-3-正丁基苯酞(NBP)。有研究显示,其可作用于多病理环节,可通过提高前列环素及血管内皮一氧化氮表达从而减少钙离子向细胞内流入及花生四烯酸的含量,抑制氧自由基产生,降低机体炎症反应[18-19];同时可提高抗氧化酶活性,诱导凋亡因子表达,从而发挥护脑作用[20];其还可保护缺血缺氧状态下的线粒体结构的完整,解除微血管痉挛,改善局部脑血液循环,抑制血栓形成,使缺血区的灌注增加,从而缓解病情进展[21]。
表1 两组患者治疗前后MoCA 和CSS 评分比较(分,±s)
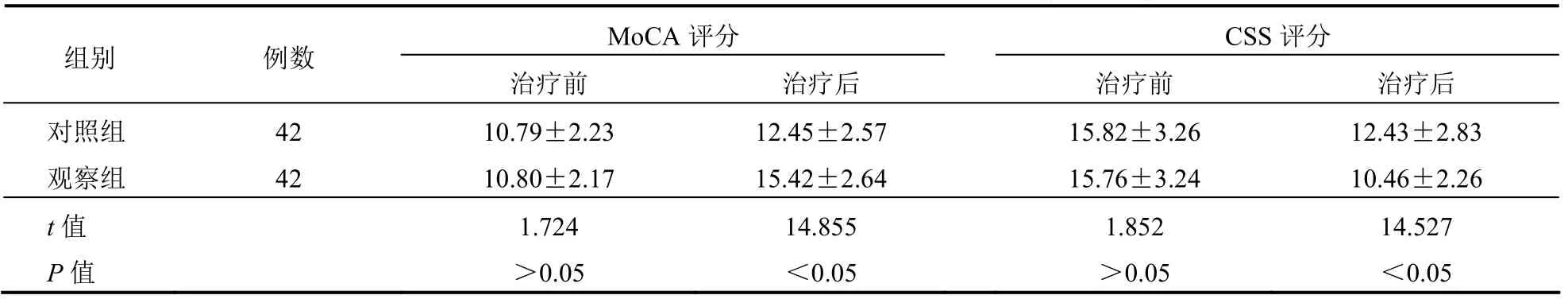
表1 两组患者治疗前后MoCA 和CSS 评分比较(分,±s)
MoCA 评分 CSS 评分 组别 例数 治疗前 治疗后 治疗前 治疗后 对照组 42 10.79±2.23 12.45±2.57 15.82±3.26 12.43±2.83 观察组 42 10.80±2.17 15.42±2.64 15.76±3.24 10.46±2.26 t 值 1.724 14.855 1.852 14.527 P 值 >0.05 <0.05 >0.05 <0.05

表2 两组患者临床疗效比较
表3 两组患者治疗前后凝血功能比较(±s)
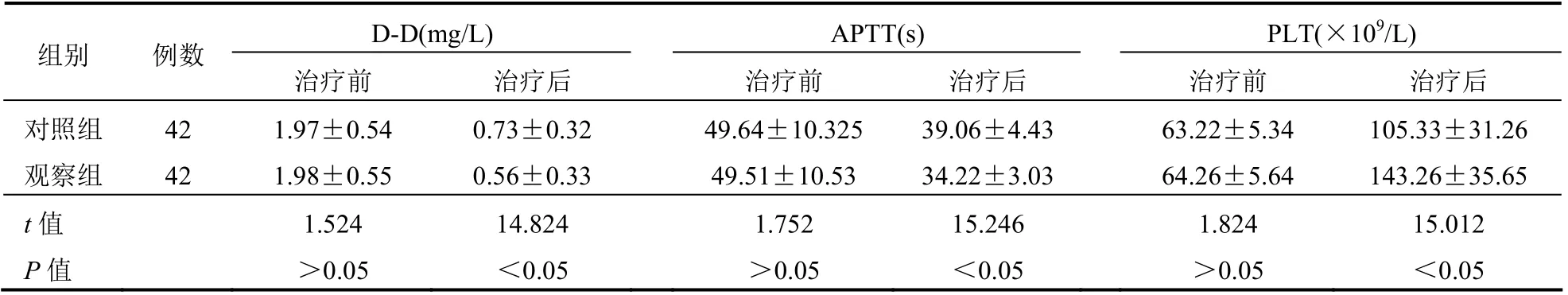
表3 两组患者治疗前后凝血功能比较(±s)
D-D(mg/L) APTT(s) PLT(×109/L) 组别 例数 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 对照组 42 1.97±0.54 0.73±0.32 49.64±10.325 39.06±4.43 63.22±5.34 105.33±31.26 观察组 42 1.98±0.55 0.56±0.33 49.51±10.53 34.22±3.03 64.26±5.64 143.26±35.65 t 值 1.524 14.824 1.752 15.246 1.824 15.012 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
表4 两组患者治疗前后血清IL-8、hs-CRP 和IL-10 水平比较(±s)
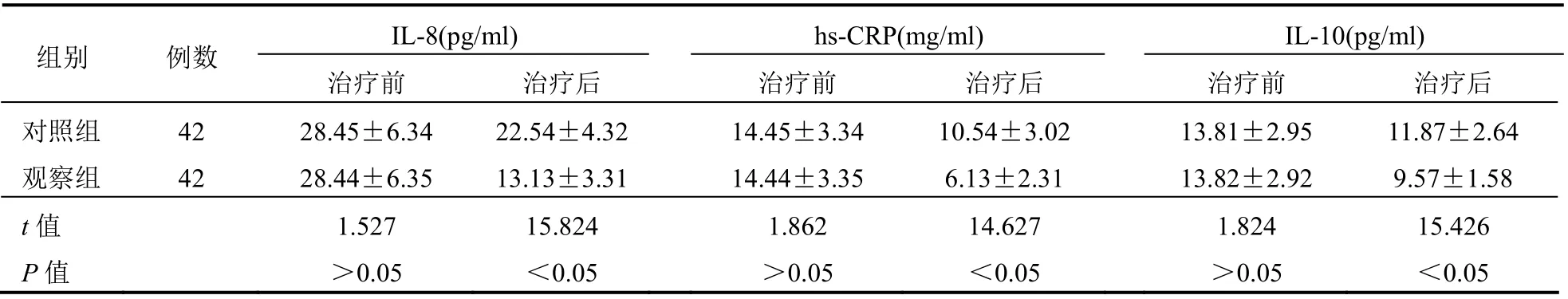
表4 两组患者治疗前后血清IL-8、hs-CRP 和IL-10 水平比较(±s)
IL-8(pg/ml) hs-CRP(mg/ml) IL-10(pg/ml) 组别 例数 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 对照组 42 28.45±6.34 22.54±4.32 14.45±3.34 10.54±3.02 13.81±2.95 11.87±2.64 观察组 42 28.44±6.35 13.13±3.31 14.44±3.35 6.13±2.31 13.82±2.92 9.57±1.58 t 值 1.527 15.824 1.862 14.627 1.824 15.426 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
因急性脑卒脑损伤与自由基生成相关,自由基与细胞分子反应致脂质体过氧化,导致神经功能损伤,氢氯吡格雷属于脑组织保护剂,当脑组织缺氧后会产生大量氧自由基,其可有效清除自由基,对脂质过氧化具有抑制作用,对于脑细胞、血管内皮细胞以及神经细胞的氧化损伤可起到抑制作用,从而降低脑组织缺血、缺氧后的进一步损伤;IL-8 具有激活、吸引中粒细胞的作用,当与中粒细胞结合,其会定向移动并促进表皮细胞聚集、黏附,释放活性物质、产生自由基等,引发局部炎症反应,导致脑组织血管内皮细胞内皮损坏。其与IL-6 均可刺激C 反应蛋白(CRP)产生。IL-10 由淋巴细胞、单核巨细胞等产生,其可阻碍基因转录抑制IL-6、TNF-α等炎症介质合成,下调基质金属蛋白酶水平,同时其具有保护神经的作用[22]。CRP 受IL-8、IL-6 刺激产生,当脑急性缺血及再灌注损伤,其可加速血管内皮细胞分化成熟及激活周围炎性细胞,释放细胞因子IL-lβ 和TNF-α,触发炎症反应,促使IL-6、IL-8释放,而IL-6、IL-lβ、TNF-α 刺激肝脏与上皮细胞合成CRP,其在动脉粥样硬化斑块产生过程中起到重要作用[23]。CRP 检测作为急性炎症和组织损伤的指标,在临床容易测定,在心血管病中其浓度可反映动脉硬化的易损性及斑块破裂可能性,对预测全身性血栓再发及心血管病事件具有重要意义。氯吡格雷为抗血小板聚集药物,其能抑制hs-CRP 等炎症介质释放、改善脑组织缺氧、缺血状态,并通过抑制血小板表面二磷酸腺苷受体来发挥抗血小板聚集作用、预防血栓形成[24-25];同时氯吡格雷可选择性与血小板膜表面ADP 受体结合,在其作用下与ADP受体相偶联的血小板糖蛋白GPⅡb/Ⅲa 受体的纤维蛋白原结合位点无法暴露而无法结合,从而抑制血小板聚集[26]。
本研究结果显示,观察组临床疗效、凝血功能、神经功能、认知功能优于对照组,血清炎症介质水平低于对照组。提示采用氢氯吡格雷片治疗AIS,可有效降低急性缺血或再灌注损伤引起的炎症反应,清除自由基,抑制血小板聚集,改善认知功能障碍及神经功能缺损。
综上所述,以氢氯吡格雷片治疗AIS 可有效改善患者认知功能障碍,促进神经功能恢复,临床疗效确切。

