水稻转录因子OsWRKY68蛋白质的表达特征及其功能特性
陈悦,王田幸子,杨烁,张彤,马金姣,燕高伟,刘玉晴,周艳,史佳楠,兰金苹,魏健,窦世娟,刘丽娟,杨明,李莉云,刘国振
(河北农业大学生命科学学院,河北保定 071001)
0 引言
【研究意义】在高等植物中广泛存在 WRKY转录因子,其核心序列由60个氨基酸残基组成,最为保守的序列是WRKYGQK,WRKY之名也由此得来[1]。全基因组序列分析表明,水稻品种日本晴(粳稻)中有98个WRKY成员,9311(籼稻)中有102个WRKY成员[2]。根据基因符号、命名和连锁关系委员会(The Committee on Gene Symbolization,Nomenclature and Linkage,CGSNL)的建议,每个水稻WRKY基因成员都有特定的编号或名称[3]。水稻WRKY成员的功能研究对了解水稻的生长发育、抗病抗逆机理等具有重要的理论意义和应用价值,但每一个 WRKY成员的功能并不相同,它们作为转录因子可能调控不同的生物学过程,所以需要逐个调查,才能对 WRKY家族整体有完整的了解。【前人研究进展】超表达水稻OsWRKY11的植株呈现卷叶表型、抽穗时间晚于对照[4],OsWRKY11在干旱和病原菌侵染中也发挥作用[5]。超表达OsWRKY13的水稻开花时间延迟、株高降低[6],对高盐胁迫更为敏感[6-7],对白叶枯病和稻瘟病的抗性提高[8]。超表达OsWRKY22提高了水稻对稻瘟病菌的抗性[9]。OsWRKY28的超表达使水稻更易感稻瘟病[10]。超表达OsWRKY30提高了水稻对稻瘟病和纹枯病的抗性[11]及抗旱性[12]。超表达OsWRKY55的水稻侧根数目减少,稻瘟病抗性提高[13]。超表达OsWRKY42的水稻表现为叶片早衰,并伴随着活性氧积累和叶绿素下降[14],在拟南芥中超表达OsWRKY42提高了其耐盐能力[15]。超表达OsWRKY45提高了水稻对白叶枯病和稻瘟病的抗性[16-17],在水稻-稻瘟病菌互作过程中,OsWRKY45-2转录激活OsWRKY13,OsWRKY13可以抑制OsWRKY42,而OsWRKY42通过抑制茉莉酸(jasmonate acid,JA)途径相关基因,负调控水稻抗稻瘟病的抗性[18]。OsWRKY45的转录水平受脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)、NaCl、PEG、甘露醇(mannitol)、干旱、0℃和42℃等处理诱导[17-19]。此外,还有报道表明,OsWRKY45能促进水稻产量的提高[20]。超表达OsWRKY47提高了水稻对稻瘟病的抗性[21],对OsWRKY47的超表达和敲除试验证明该基因是水分胁迫的负调控因子[22]。OsWRKY53是油菜素内酯(brassinosteroids,BR)信号的正调控因子,超表达使水稻叶倾角增大,种子增大,而敲除植株表现出叶倾角变小,种子变小,株高变矮[23],超表达OsWRKY53提高了水稻对稻瘟病的抗性[24]。超表达OsWRKY62的水稻对白叶枯病菌(Xanthomonas oryzaepv.oryzae,Xoo)的抗性下降[25]。OsWRKY67[26]和OsWRKY71[27]正调控Xa21介导的白叶枯病抗性。在拟南芥中超表达OsWRKY72表现出侧枝生长增强,在 ABA信号和吲哚乙酸(indoleacetic acid,IAA)运输途径中发挥作用[28]。OsWRKY74参与了磷、铁和氮营养元素的吸收及对冷胁迫的应答[29]。超表达OsWRKY76的水稻对Xoo抗性下降[30]。OsWRKY87超表达使水稻茎秆伸长[31]。OsWRKY104超表达的水稻生长迟缓,株高降低,转录水平受茉莉酸甲酯(methyl jasmonate,MeJA)和紫外线B(UV-B)的诱导表达,并提高了水稻对稻瘟病的抗性[32]。综上可见,WRKY家族基因在水稻正常生长发育和逆境胁迫应答过程中发挥着重要作用。【本研究切入点】河北农业大学生命科学学院分子生物学与生物信息学实验室(molecular biology & bioinformatics lab,MBB)前期鉴定了一个水稻转录因子OsWRKY68,该蛋白质在叶片中组成型表达,在水稻接种白叶枯病菌后诱导表达,且表达量逐渐增加,OsWRKY68蛋白质在体外能与下游靶基因OsPR1b和OsPR10a启动子上游的W-box元件结合[33]。文献报道OsWRKY68的转录水平受赤霉素(gibberellic acid,GA3)和ABA的诱导表达[34],在冷、水淹、PEG、H2O2、NaCl和白背飞虱(white backed planthopper,WBPH)处理后转录下调[35-36]。转录数据虽然能为功能研究提供一些线索,但蛋白质是生命活动的执行者,因此,了解 OsWRKY68蛋白质的表达特征,对增进 OsWRKY68功能的了解具有重要意义。【拟解决的关键问题】本研究采用基于抗体的蛋白质组学策略[37],通过免疫印迹技术分析了水稻不同发育时期、不同部位,以及多种逆境和激素处理条件下 OsWRKY68蛋白质的表达特征,获得了其功能线索,并进一步构建OsWRKY68的RNAi载体,转化水稻后获得 OsWRKY68蛋白质表达丰度下降的转基因植株,分析表明转基因植株的株高降低,结实率、分蘖数及小穗数下降等。增进了对 OsWRKY68蛋白质表达特征的了解,丰富了对 OsWRKY68功能的认识。
1 材料与方法
1.1 水稻种植和胁迫处理
水稻(Oryza sativaL.)TP309和转基因材料种植在河北农业大学西校区稻竹园水稻试验田和温室内(2014—2018年,河北保定)。
苗期培养:水稻种子表面消毒后,在30℃蒸馏水中浸泡3 d露白,土培用土壤与蛭石11混合的蛭石土,水培用纱网将露白的种子播放在上面。播种后于光照培养箱(30℃,60 µmol·m-2s-1,L12 h/D12 h)培养5 d,用于后续非生物胁迫,各种胁迫处理条件参见文献[38]。
离体叶片处理:选择四叶期完全伸展的叶片,将叶片剪为2 cm的小段,放置于3 mmol·L-1MES(2,4-morpholino-ethane sulfonic acid)缓冲液中,pH 5.8,于30℃光照培养箱中,分别进行恒暗(24 h黑暗)和恒光(24 h光照)处理;激素处理分别为100 μmol·L-1ABA、100 μmol·L-1MeJA、100 μmol·L-1SA 和 1 mmol·L-1乙烯利(ethephon,ET)。
采集种植在水稻试验田中的TP309不同生长发育时期的组织样品,包括萌发期、幼苗期、分蘖期、孕穗期以及开花期的根、茎、叶、叶鞘、叶枕、穗子、花药、颖壳和种子等材料,提取蛋白质后进行免疫印迹分析。
1.2 质粒和菌株
pTCK303和pCAMBIA2300质粒由中国科学院遗传与发育生物学研究所江光怀博士提供。pEASY-T1质粒购自生工生物工程(上海)股份有限公司。含有水稻OsWRKY68全长的 cDNA质粒 AK072938(Os04g51560)购自日本农业生物资源研究所水稻基因组资源中心(Rice Genome Resource Center,National Institute of Agrobiological Sciences)。
1.3 RNAi载体构建和水稻转化
首先以pTCK303质粒为模板PCR扩增获得水稻Intron序列,正向引物序列为5′-GCAAGCTTGGATCC CCGGGTACCCTCGAG-3′(下划线为Hind Ш酶切位点),反向引物序列为5′-GCGATATC CTGCAGGAG CTCTCTAGAACTAGTATCG-3(′下划线为EcoRV酶切位点),将Intron序列连接到pEASY-T1质粒构建中间载体。然后选取水稻OsWRKY68cDNA的两段长约220 bp编码序列(RNAi1:5′-TGGACCTGATGGGCTGCTA CGCCCCGCGCCGCGCAGACGACCAGCTCGCCAT CCAGGAGGCGGCCACCGCCGGCCTCCGCAGCCT GGAGATGCTCGTGTCGTCCCTCTCCTCCTCCTCT CAGGCCGCCGGGGCTCACAAGGCCTCGCCGCAG CAGCAGCCGTTCGGCGAGATCGCCGACCAGGCC GTCTCCAAGTTCCGCAAGGTCATCTCCATCCTCG ACCG-3′;RNAi2:5′-ACGTCGTTCTTCTCGTCGGTG ACGGCCGGCGAGGGAAGCGTTTCCAAGGGCCGG AGCCTGCTCTCCTCCGGCAAGCCGCCGCTGTCTG GGCACAAGCGGAAGCCCTGCGCCGGCGGCCACT CCGAGGCCACCGCCAACGGCGGCCGCTGCCACT GCTCCAAGAGAAGGAAGAACCGGGTGAAGAGG ACGATCCGAGTGCCGGCAATCAGCTCGAAGAT-3′)作为靶序列,设计引物并添加酶切位点进行扩增,RNAi1的正向引物序列为 5′-CCGGATCCGAGCTCTGGAC CTGATGGGCTGCTAC-3′(下划线分别为BamHⅠ和SacⅠ酶切位点),反向引物序列为 5′-TTGGTACCACTAGTCGGTCGAGGATGGAGATGA C-3′(下划线分别为SpeⅠ和KpnⅠ酶切位点);RNAi2的正向引物序列为 5′-GGGGATCCGAGCTCACGTC GTTCTTC TCGTCGGT-3′(下划线分别为BamHⅠ和SacⅠ酶切位点),反向引物序列为5′-TTGGTACCACTAGTATCTTCGAGCTGATTGC CGG-3(′下划线分别为SpeⅠ和KpnⅠ酶切位点)。将获得的 RNAi片段正向和反向插入带有 Intron序列的中间载体形成pEASY-T1- RNAi质粒。最后把测序正确的重组质粒经Hind III和PstⅠ双酶切插入到 pCAMBIA2300质粒,构建OsWRKY68RNAi表达载体。通过农杆菌介导法转化水稻TP309,遗传转化由武汉伯远生物科技有限公司完成。
1.4 转基因植株的PCR鉴定
OsWRKY68RNAi转基因植株验证的上游引物为35S启动子的部分序列(5′-GAGTCGTAAGAGACTC TGTATG-3′),下游引物为水稻 Intron的部分序列(5′-CTTTATCTACTGCCGTGGAAC-3′)。扩增条件为 94℃ 5 min,94℃ 30 s,60℃ 30 s,72℃ 1 min,共30个循环。扩增片段大小约为1 000 bp,1.0%琼脂糖凝胶电泳进行检测。引物由北京华大基因研究中心有限公司合成。
1.5 水稻蛋白质的提取及免疫印迹(Western blot,WB)检测
采集水稻组织样品,液氮速冻后,-70℃保存备用。将冻存的水稻样品在液氮中充分研磨,每100 mg样品加入1 mL蛋白质提取液(62.5 mmol·L-1Tris-HCl pH 7.4、10%甘油、0.1% SDS、2 mmol·L-1EDTA、1 mmol·L-1PMSF和5% DTT),混匀冰上放置10 min,12 000 r/min,4℃离心20 min,取上清即为总蛋白质。WB试验至少重复3次,使用OsHSP82蛋白质作为等量加样的内参进行检测[39]。在膜上滴加皮克级 ECL发光液(百智生物)并使用 Sage Capture软件扫描WB条带信号[40]。使用 OsWRKY68特异的多克隆抗体进行表达特征分析和转基因材料的WB鉴定[33]。通过 Lane 1D软件的凝胶分析系统采集 WB检测中OsWRKY68和OsHSP82蛋白质的信号,计算获得相同OsHSP82情况下,OsWRKY68蛋白质的含量,然后进行定量比较。OsWRKY68多克隆抗体、HRP标记的羊抗兔二抗、OsHSP82单克隆抗体和HRP标记的羊抗鼠二抗均购自北京华大蛋白质研发中心有限公司。
1.6 水稻农艺性状调查和转基因植株表型鉴定
将TP309和OsWRKY68RNAi转基因材料种植于水稻试验田,成熟后随机选取10株调查株高(主茎第一个伸长节基部到第一个小穗着生位置的距离)、分蘖数(主茎及分蘖茎的总数,包括有效分蘖和无效分蘖)、穗长(第一个小穗着生位置起至穗子顶部)、小穗数和结实率。计算平均数和标准差并进行差异显著性分析,绘制柱形图。
2 结果
2.1 OsWRKY68蛋白质在水稻正常生长发育过程中的表达特征
为了解 OsWRKY68蛋白质在水稻正常生长发育过程中的表达特征,采集水稻TP309不同生长发育时期的多个组织样品,包括萌发期的种子(浸种 1、2和3 d);幼苗(长度分别为1、2、3和5 cm);分蘖期的叶片上、中、下部;孕穗期的幼穗(长度分别为0.5、1、2、4、6.5、8、10.5、12、14和23.5 cm)、叶片上、中、下部;开花期的茎间和茎节(由下到上分为1—5节),以及不同生长发育时期的根尖、叶枕和叶鞘,提取总蛋白质后用 OsWRKY68特异抗体进行WB检测(图1)。由图1可见,OsWRKY68在不同生长发育时期的组织中基本呈组成型表达,分子量约为32 kD,和预测大小相符,且在大部分组织中其表达丰度差异倍数不大,只是在个别组织中(如孕穗期的幼穗),随着幼穗长度的增加其表达丰度逐渐降低。在分蘖期和孕穗期的叶鞘中不表达,仅在开花期的叶鞘中表达。在开花期,花药中的 OsWRKY68表达丰度高于成熟穗、穗轴和颖壳。从蛋白质的组成型表达特征来看,OsWRKY68应该在水稻生长发育过程中多个时期和组织中发挥作用。

图1 OsWRKY68蛋白质在水稻不同生长发育时期和不同组织的表达特征Fig. 1 Expression profiling of OsWRKY68 protein in different tissues at different developmental stages
2.2 OsWRKY68蛋白质在非生物胁迫下的表达特征
利用前期建立的 RiceS-A300水稻组织样品资源库和离体叶片胁迫处理样品,用WB检测OsWRKY68蛋白质的表达特征。由图2-A可见,正常生长的对照植株表达丰度维持不变, NaCl(200 mmol·L-1)胁迫处理时,OsWRKY68蛋白质的表达丰度随时间延长持续下降,在2 d时已经下降了一半以上,3 d时基本检测不到。由图 2-B可见,离体叶片在恒光处理后OsWRKY68表达量持续上升,3 d时出现一条分子质量较大的条带,且表达量逐渐增加,为了区分所出现的分子质量较大的条带,将其标注为 OsWRKY68+,OsWRKY68+的分子量略小于45 kD,与OsWRKY68相差 10 kD左右,从分子量大小的变化推测是OsWRKY68翻译后修饰或不同的选择性拼接的蛋白质形式。这一结果提示 OsWRKY68蛋白质在盐和恒光胁迫应答过程中发挥作用。除上述非生物逆境下的表达特征发生变化外,在受检的其他胁迫处理条件下,未见明显的表达特征改变(结果未附)。

图2 水稻OsWRKY68蛋白质在非生物胁迫下的表达特征Fig. 2 Expression profiling of OsWRKY68 protein under abiotic stresses
2.3 OsWRKY68蛋白质在激素处理条件下的表达特征
为了解OsWRKY68蛋白质表达与激素处理的相关性,选择四叶期完全伸展的叶片,剪下叶片进行离体激素处理(图3)。WB检测发现正常对照叶片的OsWRKY68表达丰度基本维持不变,而MeJA(100 μmol·L-1)及乙烯利(1 mmol·L-1)处理5 d时均能诱导OsWRKY68+的表达丰度升高,但ABA和SA处理(结果未附)没有明显影响OsWRKY68的表达。这一结果提示OsWRKY68蛋白质的功能发挥可能与激素MeJA和乙烯相关的信号转导途径有关联。
2.4 OsWRKY68 RNAi载体的构建和转基因水稻的鉴定
首先以含有OsWRKY68全长cDNA的质粒为模板,将选定的 RNAi片段扩增出来,如图4-A所示,PCR片段大小约为250 bp,再将RNAi片段正向和反向插入带有Intron序列的中间载体,成为pEASY-T1-RNAi质粒,经Hind Ⅲ和SacⅠ双酶切后电泳检测大小正确(图4-B),测序验证后,将正向和反向的RNAi片段插入到转化终载体pCAMBIA-2300中,Hind Ⅲ和PstⅠ双酶切验证,确认与理论值大小相符(图4-C),证明获得了正确的转化质粒。
通过农杆菌介导法将OsWRKY68的RNAi质粒导入水稻受体TP309,T0代获得了24个转基因株系(line)。对这24个转基因株系进行PCR鉴定,得到6个阳性lines,将PCR阳性的lines种植并在后代中继续通过PCR和WB进行鉴定,在T3代获得4个PCR和WB阳性的OsWRKY68 RNAi的转基因株系Y316、Y317、Y326和Y337。WB结果表明,在4个转基因材料中,OsWRKY68蛋白质的表达量比野生型TP309分别下降了31%、35%、70%和48%(图5)。
2.5 OsWRKY68蛋白质敲低转基因水稻的农艺性状鉴定
对转基因水稻进行了表型和农艺性状调查(图6)。结果表明,与野生型相比,OsWRKY68蛋白质敲低的转基因水稻表现为株高、分蘖数、穗长和结实率等指标的显著降低,而生育期没有明显的差别。说明降低OsWRKY68的表达对水稻生长发育产生了比较严重的影响,由此说明正常表达的OsWRKY68蛋白质对维持水稻的生长发育具有重要意义。
3 讨论
WRKY转录因子是植物中最大的转录因子家族之一,已有多篇报道证明水稻WRKY转录因子在生长发育以及应对外界逆境胁迫时都发挥重要的作用。
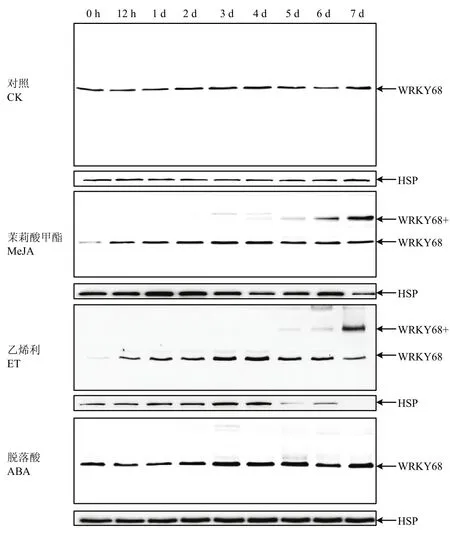
图3 水稻OsWRKY68蛋白质受MeJA和乙烯利诱导表达Fig. 3 The expression of OsWRKY68 protein were induced by MeJA and ET treatments

图4 水稻OsWRKY68 RNAi表达载体的构建与验证Fig. 4 The construction and verification of transformation plasmid for OsWRKY68 RNAi

图5 OsWRKY68 RNAi转基因株系的鉴定Fig. 5 The identification of OsWRKY68 RNAi transgenic lines

图6 水稻OsWRKY68 RNAi转基因株系的表型和农艺性状鉴定Fig. 6 The phenotype and agronomic traits of OsWRKY68 RNAi transgenic lines
MBB前期鉴定到 OsWRKY68在水稻-白叶枯病菌互作中表达上调,本研究试图进一步挖掘OsWRKY68的功能。用免疫印记技术检测了 OsWRKY68蛋白质在水稻不同生长发育阶段和不同组织部位、非生物胁迫和激素诱导下的表达特征,结果表明,OsWRKY68在水稻生长发育过程中基本呈组成型表达,OsWRKY68在盐胁迫过程中表达量降低,OsWRKY68表达受光照、MeJA和乙烯利的诱导。经转基因获得了OsWRKY68下调的水稻材料,表现出株高、分蘖数、穗长和结实率等重要农艺性状的显著降低,说明该基因在水稻生长发育中发挥作用,表达特征数据也提示其在盐胁迫、光照、乙烯利和MeJA等激素处理过程中发挥作用。
蛋白质是生命活动的执行者,对蛋白质的丰度、修饰等变化的研究对了解其功能具有重要的指导意义。本研究发现 OsWRKY68蛋白质在种子萌发期、幼苗期、分蘖期、孕穗期以及开花期的根、茎、叶、穗子和种子等绝大部分组织中均有表达,一般组织中其丰度波动幅度不大,但在花药中表达丰度较高(图1)。将蛋白质表达特征与基于 RNA-seq转录数据(http://rice.plantbiology.msu.edu/)进行比对,在水稻雌蕊和花药中OsWRKY68的转录水平较高,在多种组织中都能检测到转录信号,说明蛋白质表达和转录二者间具有一定的对应关系。OsWRKY68RNAi转基因水稻的结实率降低,提示表达丰度可能与花药的发育以及结实率有关。对水稻OsWRKY68上游启动子序列分析发现,其含有器官特异性表达的 POLLEN元件(https://omictools.com/plantcare-tool),且在开花期的叶枕和叶鞘中其表达量均比分蘖期和孕穗期高(图1)。另有文献报道OsWRKY68在耐旱型水稻近等基因系材料中呈现花序特异性表达[34],提示OsWRKY68在开花期发挥重要作用。
非生物逆境如干旱、淹涝、高盐、低温和高温等都是降低水稻产量的影响因素。转录因子在植物逆境信号传递和调控功能基因表达过程中起着核心调节作用,盐胁迫是影响盐/碱稻区水稻产量的主要逆境因素,在水稻中已鉴定出几个参与耐盐的基因[41]。超表达OsWRKY13抑制水稻对盐的应答[6]。OsWRKY45-2是盐胁迫应答的负调控因子[42]。在拟南芥中超表达WRKY42提高了耐盐能力[15]。水稻OsWRKY68在盐处理后转录下调[35]。拟南芥的AtWRKY18和AtWRKY60单突和双突植株对盐胁迫的耐受性均比野生型高[43]。本研究结果表明 OsWRKY68蛋白质的表达丰度受到盐和光照等因素的调控,提示其可能参与这些胁迫的应答反应,OsWRKY68敲低转基因材料的获得,为鉴定其在盐胁迫和光照处理过程中的功能奠定了基础。水杨酸(SA)和茉莉酸(JA)等信号分子能够激活植物体内防御基因的表达,从而使植物表现出对生物胁迫的抗性反应。OsWRKY13转录因子可激活SA依赖的信号途径并抑制 JA依赖的信号途径,直接或间接调控SA和JA上下游基因的表达,参与调节水稻的抗病性[8]。OsWRKY114和OsWRKY117受MeJA的诱导表达[36]。本研究发现 OsWRKY68蛋白质受 ET和MeJA的诱导表达,MBB前期研究发现 OsWRKY68在水稻接种Xoo后表达量增加[33],由此可推测OsWRKY68在耐盐和抗白叶枯病过程中的功能发挥与乙烯/茉莉酸途径有关。
本研究对 OsWRKY68蛋白质表达特征的调查涉及的样品超过500个,蛋白质的存在部位、丰度变化及受诱导的情况为了解蛋白质的功能提供了重要的线索,也可以认为,表达特征是功能的一种表现形式。除了鉴定到蛋白质丰度的变化外,还鉴定到更高分子量条带(OsWRKY68+)的出现,这种现象以前也报道过[33],水稻体内的OsWRKY68分子量为32 kD,WB检测到的OsWRKY68+的分子质量大于32 kD,略小于45 kD。从分子量大小推测,OsWRKY68+可能是 OsWRKY68翻译后修饰,或者是不同选择性拼接形式的蛋白质,因为都能被同一抗体特异识别,所以一定带有相同的识别区域。在恒光、MeJA和乙烯利处理后,WB检测到的 OsWRKY68+的表达量增加,说明在这些处理过程中,提高了OsWRKY68+的丰度,或者说,OsWRKY68+的蛋白质形式可以被这些处理特异诱发。能够直观地看到不同的蛋白质形式,是 WB的一个特点。对特定蛋白质形式的了解有助于功能的挖掘和阐释。对这些变化信息的深度挖掘将有助于了解不同蛋白质形式(Form)的功能,希望将来能对此现象有更具体的解释。
水稻中有近百个 WRKY基因,同一个代谢过程中会有多个WRKY共同参与[18],有些WRKY成员除了调控下游靶基因之外,WRKY基因之间甚至自身也可以相互调节。已经发现一些 WRKY基因的启动子上游也存在W-box或类W-box序列,如OsWRKY13[6]、OsWRKY45[42]和OsWRKY68[33]等。MBB 前期研究结果表明OsWRKY68可以与OsPR1b和OsPR10a的W-box结合[33],提示对W-box元件的筛选有助于下游靶基因的鉴定。
WRKY转录因子是一类重要的功能蛋白质,每一个不同的WRKY成员都有其特定的功能,李莉云等[44]比较系统地对 WRKY家族成员的功能和转录数据进行了整理。本研究通过系统调查水稻 OsWRKY68蛋白质在不同生长发育时期不同组织部位,以及多种非生物胁迫和激素处理条件下的表达特征,鉴定到OsWRKY68在盐胁迫、光照和激素(MeJA和ET)处理条件下表达丰度发生了变化,为进一步深入探讨其功能提供了线索,OsWRKY68RNAi转基因材料表现蛋白质丰度的下调,同时显著降低了水稻的株高和分蘖数等,表明该基因在水稻正常生长发育及逆境胁迫应答过程中都扮演重要角色。
4 结论
水稻转录因子 OsWRKY68参与水稻正常生长发育,盐胁迫时表达量下降,受光照、MeJA和ET的诱导表达,说明该蛋白质具有广谱的功能,OsWRKY68RNAi转基因材料的株高、结实率、分蘖数、穗长和小穗数显著降低。
——一道江苏高考题的奥秘解读和拓展

